Standard Operating Procedure
|
|
|
- Petrus Willemsen
- 8 jaren geleden
- Aantal bezoeken:
Transcriptie
1 Standard Operating Procedure STZ SOP: U10 Audit Distributielijst : STZ Datum : Revisiedatum : Veranderingen ten opzichte van eerdere versies Versiedatum Opmerkingen Versiedatum Opmerkingen Jaarlijkse revisie, administratieve wijzigingen. Versiedatum Pagina 1 van 7
2 1. Doel Het beschrijven van de procedures voor voorbereidingen, uitvoering, rapportage en opvolging van een audit op de onderzoekslocatie. Een audit kan plaatsvinden in opdracht van de overheid (inspectie) of een sponsor. Het doel van een audit van klinisch onderzoek is, naast het reguliere monitoren, om te controleren of: de rechten en het welzijn van de proefpersonen worden beschermd; de gegevens die uit het onderzoek worden gerapporteerd juist en volledig verifieerbaar zijn in de brondocumenten; de uitvoering van het onderzoek in overeenstemming is met het op dat moment goedgekeurde protocol, met GCP en met de relevante wettelijke vereisten; alle benodigde documenten aanwezig en compleet zijn. 2. Afkortingen, definities en termen CRF CCMO GCP METC SOP Case Report Form Centrale Commissie Mensgebonden Onderzoek Good Clinical Practice Medisch Ethische Toetsingscommissie Standard Operating Procedure Audit: een systematisch en onafhankelijk onderzoek van activiteiten en documenten in verband met een klinisch onderzoek om na te gaan of de activiteiten in verband met het geëvalueerde onderzoek werden uitgevoerd en de gegevens werden vastgelegd, geanalyseerd en gerapporteerd in overeenstemming met het protocol, Standard Operating Procedures (SOP's) van de sponsor, Good Clinical Practice (GCP), en de relevante wettelijke vereisten. Auditor: persoon met de juiste kwalificaties die een audit uitvoert. Case Report Form: Een gedrukt, optisch of elektronisch document dat ontworpen is om alle volgens het protocol vereiste informatie die per proefpersoon aan de sponsor moet worden gerapporteerd in vast te leggen. Corrective action and preventive action plan: document dat wordt toegevoegd aan een audit rapport en waar de te ondernemen acties ter correctie van de data of procedures in beschreven staat. GCP: Een standaard voor het ontwerpen, opzetten, uitvoeren, monitoren, auditen, vastleggen, analyseren en rapporteren van klinisch onderzoek, die zeker stelt dat de gegevens en de gerapporteerde resultaten betrouwbaar en nauwkeurig zijn, en dat de rechten, integriteit en vertrouwelijkheid van proefpersonen beschermd worden. Investigator / onderzoeker: De persoon die verantwoordelijk is voor de uitvoering van een klinisch onderzoek op één onderzoekslocatie. De onderzoeker die landelijk verantwoordelijk is voor de studie wordt de CCI (country co-ordinating investigator) genoemd. Als een klinisch onderzoek op één onderzoekslocatie door één team van personen wordt uitgevoerd dan is de onderzoeker de verantwoordelijke teamleider en kan deze als hoofdonderzoeker (principal investigator; PI) worden aangeduid. METC: Een zelfstandig en onafhankelijk bestuursorgaan (instellings-, regionale, nationale of supranationale beoordelingsraad of commissie), bestaande uit medici, wetenschappers en niet-medici/wetenschappers, dat de verantwoordelijkheid heeft er voor te zorgen dat de rechten, veiligheid en het welzijn van de proefpersonen in een onderzoek worden zeker gesteld. Deze bescherming moet openbaar worden gewaarborgd door onder andere het beoordelen van en een positief oordeel geven over het onderzoeksprotocol, de geschiktheid van de onderzoekers, de faciliteiten en de methoden en het materiaal dat zal Versiedatum Pagina 2 van 7
3 worden gebruikt om het informed consent van de proefpersonen te verkrijgen en te documenteren. Monitoring / Monitoren: Het bewaken van de voortgang van een klinisch onderzoek, en van de uitvoering, het vastleggen van de gegevens en de rapportage hiervan conform het protocol, de Standard Operating Procedures (SOP's), Good Clinical Practice (GCP), en de relevante wettelijke vereisten. Onderzoekslocatie: De locatie(s) waar onderzoeksactiviteiten plaatsvinden. Protocol: Een document waarin doelstelling(en), opzet, methodologie, statistische overwegingen en organisatie van een onderzoek staan beschreven. Het protocol beschrijft doorgaans ook de achtergrond van en de verantwoording voor het onderzoeksproject, maar deze kunnen ook in de andere documenten, waarnaar in het protocol wordt verwezen, zijn opgenomen. In het ICH GCP richtsnoer verwijst de term protocol zowel naar protocol als naar protocolamendementen. Sponsor/verrichter: Een persoon, bedrijf, instelling of organisatie die de verantwoordelijkheid neemt voor het initiëren, organiseren en/of financieren van een klinisch onderzoek. In de WMO spreekt men van verrichter als zijnde diegene die opdracht heeft gegeven voor de organisatie en/of uitvoering van een klinisch onderzoek. Standard Operating Procedure (SOP): Dit zijn gedetailleerde schriftelijke instructies om uniformiteit te bereiken in de uitvoering van een bepaalde taak. 3. Verantwoordelijkheden Hieronder worden de verantwoordelijkheden van de verschillende partijen met betrekking tot deze STZ SOP U10 Audit benoemd. Auditor is verantwoordelijk voor: volgen van de van toepassing zijnde audit vereisten; het bespreken en toelichten van audit vereisten; plannen van de audit en op een nauwgezette en efficiënte wijze uitvoering geven aan de toegewezen verantwoordelijkheden; documenteren van de bevindingen; het rapporteren van de audit resultaten; beheer documenten m.b.t. de audit, zoals: - op verzoek indienen van documenten - garanderen dat documenten vertrouwelijk blijven - discreet omgaan met vertrouwelijke informatie. Monitor is verantwoordelijk voor: controle op de correcte uitvoering en documentatie van het onderzoek, overeenkomstig de eisen van de sponsor, en zoals beschreven staat in Richtsnoer voor Good Clinical Practice, ; het audit bezoek afstemmen met de site (denk ook aan andere betrokken afdelingen zoals apotheek, laboratorium en/of röntgenafdeling); het begeleiden van de audit, d.w.z. in overeenstemming met de research verpleegkundige en/of investigator aanwezig zijn om vragen te beantwoorden en bevindingen toe te lichten; het aanleveren van een audit certificaat en/of rapport met daarin opgenomen het corrective action and preventive action plan ; controle op de uitvoering van het corrective action and preventive action plan. Investigator is eindverantwoordelijk voor: de nauwkeurigheid, volledigheid en leesbaarheid van de gegevens in de CRF's en in alle vereiste rapporten; Versiedatum Pagina 3 van 7
4 het geven van directe inzage in alle aan het onderzoek gerelateerde documenten op verzoek van de auditor of andere bevoegde autoriteit; het audit bezoek afstemmen met de monitor en eventuele andere betrokken afdelingen zoals apotheek, laboratorium en/of röntgenafdeling; beschikbaarheid om eventuele vragen van de auditor te beantwoorden of bevindingen toe te lichten en het rapport te bespreken; het regelen van een ruimte voor de auditor voor de gewenste tijdsduur en zorgdragen voor aanwezigheid van (enkel) de benodigde documentatie in deze ruimte; uitvoering van de acties opgenomen in het corrective action and preventive action plan en bewijsvoering daarvan naar de inspectie ofwel de sponsor. Sponsor / verrichter is eindverantwoordelijk voor: In geval van een audit geïnitieerd vanuit de sponsor: contacten met de auditor; het aanleveren van het audit certificaat aan de onderzoeker; communicatie. Versiedatum Pagina 4 van 7
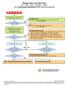
5 4. Stroomdiagram 5.1 Plannen van audit op initiatief van de overheid (inspectie) of de sponsor 5.2 Voorbereiding audit 5.3 Audit Audit rapport 5.4 Bespreken van de bevindingen en het rapport 5.5 Uitvoeren van de corrective actions and preventive actions Invoering correct? Ja Audit certificate Nee 5. Werkwijze 5.1. Inspecteur of monitor neemt contact op met investigator om te melden dat er een audit zal plaatsvinden en spreekt een datum af met investigator (of functionaris welke binnen delegation of duties is afgesproken). Vooraf wordt in een gesprek of schriftelijk aangegeven wat het doel van de audit is, hoeveel tijd er nodig zal zijn en welke gegevens ter inzage beschikbaar moeten zijn. Investigator bevestigt de audit intern aan alle betrokkenen Investigtor of functionaris aan wie dit gedelegeerd is (b.v. secretaresse / researchverpleegkundige) regelt een rustige ruimte voor de audit waar alleen de benodigde (bron)documentatie voor de audit aanwezig is. Welke dit is, dient vooraf aangegeven te worden door de auditor of monitor. Versiedatum Pagina 5 van 7
6 5.3. Gedurende de audit zijn de researchverpleegkundige en/of investigator beschikbaar om vragen te beantwoorden of toelichting te geven op de bevindingen. Indien het een inspectie betreft waar geen monitor van een sponsor aanwezig is dient de researchverpleegkundige beschikbaar te blijven voor de auditor om vragen te beantwoorden en indien nodig zaken op te zoeken voor de auditor. Kortom het begeleiden van de audit. Van de bevindingen wordt een rapport opgemaakt door de auditor Aansluitend aan de audit worden de bevindingen / aanbevelingen besproken met de investigator en de researchverpleegkundige. Het rapport wordt doorgenomen en eventueel aangepast naar aanleiding van verklarende antwoorden op de bevindingen voortkomend uit de besprekingen Na afloop van de audit wordt een definitief rapport opgesteld met daarbij de aanbevelingen in een corrective action and preventive action plan. Dit plan moet worden uitgevoerd en bewijs van uitvoering moet ter controle worden verstrekt aan de inspectie of de sponsor. Na uitvoering van het corrective action and preventive action plan dient aan de site een bewijs van uitvoering van de correcties verstrekt te worden. Het audit certificaat. Dit wordt gedaan door de sponsor of auditor conform gemaakte afspraken. De verstrekte documentatie gedurende en na afloop van de audit wordt (minimaal 15 jaar) bewaard bij de overige studiedocumentatie. Kopieën die gedurende de audit gemaakt worden t.b.v. de auditor worden bijgehouden op een lijst. Aan het eind van de audit wordt op deze lijst bijgehouden welke documenten teruggekregen zijn en welke, met medeweten van de onderzoeker, in het bezit van de auditor zijn gebleven. Van de documenten die in bezit van de auditor blijven wordt een extra kopie gemaakt voor de site. De lijst met daarop alle genoemde gekopieerde documenten moet door zowel de auditor als de investigator ondertekend worden. Wat als er een onaangekondigde inspectie komt? Wanneer een onaangekondigde inspectie zich voordoet wordt de investigator van de betreffende studie ingelicht. Tot die tijd wordt geen inzage verstrekt. De investigator gaat de identiteit van de auditor na en verder wordt gehandeld als ware het een geplande audit of er wordt een afspraak gemaakt voor het uitvoeren van de audit op een later tijdstip. 6. Archivering De volgende documenten dienen gearchiveerd te worden in de Investigator site file (zie STZ SOP VL4 Investigator Site File ): lijst waarop wordt bijgehouden wanneer de auditor van een studie aanwezig is geweest in het onderzoekscentrum audit rapport audit certificaat 7. Referenties Richtsnoer voor Good Clinical Practice (CPMP/ICH/135/95), officiële Nederlandse vertaling STZ SOP VL4: Investigator Site File 8. Literatuur Richtsnoer voor Good Clinical Practice (CPMP/ICH/135/95), officiële Nederlandse vertaling Website van CCMO ( 9. Bijlage(n) Versiedatum Pagina 6 van 7
7 10. MGG specifiek Researchverpleegkundige is verantwoordelijk voor: het organiseren en afhandelen van de audit het ontvangen en begeleiden van de audit het beschikbaar zijn van alle relevante brondocumenten en CRF s tijdens het bezoek van de auditor het audit bezoek afstemmen met de monitor en eventuele andere betrokken afdelingen zoals apotheek, laboratorium en/of röntgenafdeling beschikbaar zijn tijdens de audit om vragen te beantwoorden en bevindingen toe te lichten in geval van een audit door de inspectie is de researchverpleegkundige verplicht de sponsor te informeren Indien functie beschikbaar binnen specialisme, zo niet dan is MGG onderzoeker verantwoordelijk voor onderstaande). Versiedatum Pagina 7 van 7
Standard Operating Procedure
 Standard Operating Procedure STZ SOP: U9 Monitoren Distributielijst : STZ Datum : 15-10-2012 Revisiedatum : 15-10-2013 Veranderingen ten opzichte van eerdere versies Versiedatum Hoofdstuk Versiedatum Hoofdstuk
Standard Operating Procedure STZ SOP: U9 Monitoren Distributielijst : STZ Datum : 15-10-2012 Revisiedatum : 15-10-2013 Veranderingen ten opzichte van eerdere versies Versiedatum Hoofdstuk Versiedatum Hoofdstuk
Standard Operating Procedure
 Standard Operating Procedure STZ SOP: U4 Registratie /randomisatie procedure Distributielijst : STZ Datum : 19-06-2014 Revisiedatum : 19-06-2015 Veranderingen ten opzichte van eerdere versies Versiedatum
Standard Operating Procedure STZ SOP: U4 Registratie /randomisatie procedure Distributielijst : STZ Datum : 19-06-2014 Revisiedatum : 19-06-2015 Veranderingen ten opzichte van eerdere versies Versiedatum
Standard Operating Procedure
 Standard Operating Procedure STZ SOP: VL2 Aanpassen proefpersoneninformatie / toestemmingsformulier aan lokale situatie Distributielijst : STZ Datum : 20-03-2014 Revisiedatum : 20-03-2015 Veranderingen
Standard Operating Procedure STZ SOP: VL2 Aanpassen proefpersoneninformatie / toestemmingsformulier aan lokale situatie Distributielijst : STZ Datum : 20-03-2014 Revisiedatum : 20-03-2015 Veranderingen
Standard Operating Procedure
 Standard Operating Procedure STZ SOP: U11 Voortgangsrapportage Distributielijst : STZ Datum : 19-06-2014 Revisiedatum : 19-06-2015 Veranderingen ten opzichte van eerdere versies Versiedatum Opmerkingen
Standard Operating Procedure STZ SOP: U11 Voortgangsrapportage Distributielijst : STZ Datum : 19-06-2014 Revisiedatum : 19-06-2015 Veranderingen ten opzichte van eerdere versies Versiedatum Opmerkingen
Standard Operating Procedure
 Standard Operating Procedure STZ SOP: U1 Identificatie, werving en pre-screening proefpersonen Distributielijst : STZ Datum : 19-06-2014 Revisiedatum : 19-06-2015 Veranderingen ten opzichte van eerdere
Standard Operating Procedure STZ SOP: U1 Identificatie, werving en pre-screening proefpersonen Distributielijst : STZ Datum : 19-06-2014 Revisiedatum : 19-06-2015 Veranderingen ten opzichte van eerdere
Standard Operating Procedure
 Standard Operating Procedure STZ SOP: VL5 Protocolamendement (lokaal) Distributielijst : STZ Datum : 03-06-2014 Revisiedatum : 03-06-2015 Veranderingen ten opzichte van eerdere versies Versiedatum Opmerkingen
Standard Operating Procedure STZ SOP: VL5 Protocolamendement (lokaal) Distributielijst : STZ Datum : 03-06-2014 Revisiedatum : 03-06-2015 Veranderingen ten opzichte van eerdere versies Versiedatum Opmerkingen
Standard Operating Procedure
 Standard Operating Procedure STZ SOP: VC8 Beoordeling amendement toetsende commissie (centraal) Distributielijst : STZ Datum : 10-03-2014 Revisiedatum : 10-03-2015 Veranderingen ten opzichte van eerdere
Standard Operating Procedure STZ SOP: VC8 Beoordeling amendement toetsende commissie (centraal) Distributielijst : STZ Datum : 10-03-2014 Revisiedatum : 10-03-2015 Veranderingen ten opzichte van eerdere
Standard Operating Procedure
 Standard Operating Procedure STZ SOP: VC9 Proefpersonen- en aansprakelijkheidsverzekering (centraal) Distributielijst : STZ Datum : 10-03-2014 Revisiedatum : 10-03-2015 Veranderingen ten opzichte van eerdere
Standard Operating Procedure STZ SOP: VC9 Proefpersonen- en aansprakelijkheidsverzekering (centraal) Distributielijst : STZ Datum : 10-03-2014 Revisiedatum : 10-03-2015 Veranderingen ten opzichte van eerdere
Standard Operating Procedure
 Standard Operating Procedure STZ SOP: U5 Datamanagement Distributielijst : STZ Datum : 19-06-2014 Revisiedatum : 19-06-2015 Veranderingen ten opzichte van eerdere versies Versiedatum Opmerkingen Versiedatum
Standard Operating Procedure STZ SOP: U5 Datamanagement Distributielijst : STZ Datum : 19-06-2014 Revisiedatum : 19-06-2015 Veranderingen ten opzichte van eerdere versies Versiedatum Opmerkingen Versiedatum
Standard Operating Procedure
 Standard Operating Procedure SOP: V9 Initiatievisite Auteur Naam: Functie instelling/afdeling Judie van den Elshout Staffunctionaris Wetenschapsbureau Wetenschapsbureau / Cluster Leerhuis Handtekening:...
Standard Operating Procedure SOP: V9 Initiatievisite Auteur Naam: Functie instelling/afdeling Judie van den Elshout Staffunctionaris Wetenschapsbureau Wetenschapsbureau / Cluster Leerhuis Handtekening:...
Standard Operating Procedure
 Standard Operating Procedure STZ SOP: A1 Afsluiting studie Distributielijst : STZ Datum : 03-06-2014 Revisiedatum : 03-06-2015 Veranderingen ten opzichte van eerdere versies Versiedatum Opmerkingen Versiedatum
Standard Operating Procedure STZ SOP: A1 Afsluiting studie Distributielijst : STZ Datum : 03-06-2014 Revisiedatum : 03-06-2015 Veranderingen ten opzichte van eerdere versies Versiedatum Opmerkingen Versiedatum
Standard Operating Procedure
 Standard Operating Procedure STZ SOP: A2 Archiveren studie Distributielijst : STZ Datum : 03-06-2014 Revisiedatum : 03-06-2015 Veranderingen ten opzichte van eerdere versies Versiedatum Opmerkingen Versiedatum
Standard Operating Procedure STZ SOP: A2 Archiveren studie Distributielijst : STZ Datum : 03-06-2014 Revisiedatum : 03-06-2015 Veranderingen ten opzichte van eerdere versies Versiedatum Opmerkingen Versiedatum
Standard Operating Procedure
 Standard Operating Procedure STZ SOP: U7 Ondersteunende diensten Distributielijst : STZ Datum : 19-06-2014 Revisiedatum : 19-06-2015 Veranderingen ten opzichte van eerdere versies Versiedatum Opmerkingen
Standard Operating Procedure STZ SOP: U7 Ondersteunende diensten Distributielijst : STZ Datum : 19-06-2014 Revisiedatum : 19-06-2015 Veranderingen ten opzichte van eerdere versies Versiedatum Opmerkingen
Standard Operating Procedure
 Standard Operating Procedure STZ SOP: O3 Ontwikkelen, implementeren en beheren van SOP s Distributielijst : STZ Datum : 15-10-2012 Revisiedatum : 15-10-2013 Veranderingen ten opzichte van eerdere versies
Standard Operating Procedure STZ SOP: O3 Ontwikkelen, implementeren en beheren van SOP s Distributielijst : STZ Datum : 15-10-2012 Revisiedatum : 15-10-2013 Veranderingen ten opzichte van eerdere versies
Standard Operating Procedure
 Standard Operating Procedure STZ SOP: A4 Publicatie Distributielijst : STZ Datum : 20-03-2014 Revisiedatum : 20-03-2015 Veranderingen ten opzichte van eerdere versies Versiedatum Opmerkingen Versiedatum
Standard Operating Procedure STZ SOP: A4 Publicatie Distributielijst : STZ Datum : 20-03-2014 Revisiedatum : 20-03-2015 Veranderingen ten opzichte van eerdere versies Versiedatum Opmerkingen Versiedatum
Standard Operating Procedure
 Standard Operating Procedure STZ SOP: U2 Informed consent Distributielijst : STZ Datum : 19-06-2014 Revisiedatum : 19-06-2015 Veranderingen ten opzichte van eerdere versies Versiedatum Opmerkingen Versiedatum
Standard Operating Procedure STZ SOP: U2 Informed consent Distributielijst : STZ Datum : 19-06-2014 Revisiedatum : 19-06-2015 Veranderingen ten opzichte van eerdere versies Versiedatum Opmerkingen Versiedatum
Standard Operating Procedure
 Standard Operating Procedure STZ SOP: U6 Studie medicatie Distributielijst : STZ Datum : 19-06-2014 Revisiedatum : 19-06-2015 Veranderingen ten opzichte van eerdere versies Versiedatum Opmerkingen Versiedatum
Standard Operating Procedure STZ SOP: U6 Studie medicatie Distributielijst : STZ Datum : 19-06-2014 Revisiedatum : 19-06-2015 Veranderingen ten opzichte van eerdere versies Versiedatum Opmerkingen Versiedatum
Aanmelden medischwetenschappelijk
 Aanmelden medischwetenschappelijk onderzoek SOP Aanmelden WMO-plichtig onderzoek_versie juli 2016.doc Pagina 1 van 10 Aanmelden WMO-plichtig onderzoek 1. Doel Het beschrijven van de procedure die gevolgd
Aanmelden medischwetenschappelijk onderzoek SOP Aanmelden WMO-plichtig onderzoek_versie juli 2016.doc Pagina 1 van 10 Aanmelden WMO-plichtig onderzoek 1. Doel Het beschrijven van de procedure die gevolgd
Aanmelden WMO-plichtig onderzoek
 Aanmelden WMO-plichtig onderzoek 1. Doel Het beschrijven van de procedure die gevolgd wordt bij het aanmelden van onderzoek dat onder de WMO valt en waarbij ZGV optreedt als deelnemend centrum. Voordat
Aanmelden WMO-plichtig onderzoek 1. Doel Het beschrijven van de procedure die gevolgd wordt bij het aanmelden van onderzoek dat onder de WMO valt en waarbij ZGV optreedt als deelnemend centrum. Voordat
Standard Operating Procedure
 Standard Operating Procedure STZ SOP: VL4 Investigator Site File Distributielijst : STZ Datum : 03-06-2014 Revisiedatum : 03-06-2015 Veranderingen ten opzichte van eerdere versies Versiedatum Opmerkingen
Standard Operating Procedure STZ SOP: VL4 Investigator Site File Distributielijst : STZ Datum : 03-06-2014 Revisiedatum : 03-06-2015 Veranderingen ten opzichte van eerdere versies Versiedatum Opmerkingen
Standard Operating Procedure
 Standard Operating Procedure STZ SOP: U8 Melding van (Serious) Adverse Events en SUSARs Distributielijst : STZ Datum : 19-06-2014 Revisiedatum : 19-06-2015 Veranderingen ten opzichte van eerdere versies
Standard Operating Procedure STZ SOP: U8 Melding van (Serious) Adverse Events en SUSARs Distributielijst : STZ Datum : 19-06-2014 Revisiedatum : 19-06-2015 Veranderingen ten opzichte van eerdere versies
1. Voorafgaand aan de klinische fase van het onderzoek
 Essentiële documenten Bron: Richtsnoer voor good clinical practice (CPMP/ICH/135/95) De verwijzingen in dit document verwijzen naar de artikelen in bovenstaand document. 1. Voorafgaand aan de klinische
Essentiële documenten Bron: Richtsnoer voor good clinical practice (CPMP/ICH/135/95) De verwijzingen in dit document verwijzen naar de artikelen in bovenstaand document. 1. Voorafgaand aan de klinische
Monitorplan voorbeeld
 Monitorplan voorbeeld Protocol Er moet in het protocol beschreven worden dat er monitoring plaatsvindt (zie ook CCMO voorbeeld template). Het monitoringplan mag als bijlage worden toegevoegd (in dat geval
Monitorplan voorbeeld Protocol Er moet in het protocol beschreven worden dat er monitoring plaatsvindt (zie ook CCMO voorbeeld template). Het monitoringplan mag als bijlage worden toegevoegd (in dat geval
IC ICF ICH ISF. Lijst met afkortingen, definities en termen STZ-Kwaliteitshandboek SOP s
 Lijst met afkortingen, definities en termen STZ-Kwaliteitshandboek SOP s ABR ADR AE AR BROK CCMO CRF CTA CV DSMB EMEA EU EudraCT FU brief GCP GMP IB IC ICF ICH IMPD ISF MEB METC EU RCT SAE SOP SPC SUSAR
Lijst met afkortingen, definities en termen STZ-Kwaliteitshandboek SOP s ABR ADR AE AR BROK CCMO CRF CTA CV DSMB EMEA EU EudraCT FU brief GCP GMP IB IC ICF ICH IMPD ISF MEB METC EU RCT SAE SOP SPC SUSAR
Toezicht op klinisch onderzoek: bevindingen uit inspecties bij GGZ instellingen
 Toezicht op klinisch onderzoek: bevindingen uit inspecties bij GGZ instellingen Afdeling Farmaceutische Bedrijven, Klinisch Onderzoek Good Clinical Practice Inhoud Wat doet de IGJ aan toezicht op klinisch
Toezicht op klinisch onderzoek: bevindingen uit inspecties bij GGZ instellingen Afdeling Farmaceutische Bedrijven, Klinisch Onderzoek Good Clinical Practice Inhoud Wat doet de IGJ aan toezicht op klinisch
Site selectie visite checklist
 Site selectie visite checklist Informatie sponsor: Naam sponsor: Contactpersoon: Functie: Afdeling: Telefoonnummer : Email : Informatie onderzoekslocatie: Naam onderzoekslocatie : Naam onderzoeker: Functie:
Site selectie visite checklist Informatie sponsor: Naam sponsor: Contactpersoon: Functie: Afdeling: Telefoonnummer : Email : Informatie onderzoekslocatie: Naam onderzoekslocatie : Naam onderzoeker: Functie:
Aanvraagformulier REGISTRATIE oncologie monitor
 Aanvraagformulier REGISTRATIE oncologie monitor 1. Gegevens aanvrager Naam + Voorletters:... Adres:... Postcode + Woonplaats:.... Geboortedatum:... Geboorteplaats:... Werkzaam bij: Organisatie + Afdeling:...
Aanvraagformulier REGISTRATIE oncologie monitor 1. Gegevens aanvrager Naam + Voorletters:... Adres:... Postcode + Woonplaats:.... Geboortedatum:... Geboorteplaats:... Werkzaam bij: Organisatie + Afdeling:...
Standard Operating Procedure
 Standard Operating Procedure STZ SOP: VC2 Ontwikkelen proefpersoneninformatie / toestemmingsformulier (centraal) Distributielijst : STZ Datum : 18-02-2014 Revisiedatum : 18-02-2015 Veranderingen ten opzichte
Standard Operating Procedure STZ SOP: VC2 Ontwikkelen proefpersoneninformatie / toestemmingsformulier (centraal) Distributielijst : STZ Datum : 18-02-2014 Revisiedatum : 18-02-2015 Veranderingen ten opzichte
Monitoren vs auditen. CRA dag 21 april 2016
 Monitoren vs auditen CRA dag 21 april 2016 Introductie Freelance consultant, mede oprichter TAPAS Group B.V. Mede oprichter/directeur van CRA B.V. Medical Adviser Yamanouchi Pharma Clinical trial monitor
Monitoren vs auditen CRA dag 21 april 2016 Introductie Freelance consultant, mede oprichter TAPAS Group B.V. Mede oprichter/directeur van CRA B.V. Medical Adviser Yamanouchi Pharma Clinical trial monitor
29 juni Initiatie bijeenkomst PORTEC 4. Kwaliteitsborging WMO GCP richtsnoer. Frank van Leeuwen IKNL
 29 juni 2012 Initiatie bijeenkomst PORTEC 4 Kwaliteitsborging WMO GCP richtsnoer Frank van Leeuwen IKNL Wet en regelgeving Verklaring van Helsinki Richtsnoer voor Good Clinical Practice (CPMP/ICH/135/95)
29 juni 2012 Initiatie bijeenkomst PORTEC 4 Kwaliteitsborging WMO GCP richtsnoer Frank van Leeuwen IKNL Wet en regelgeving Verklaring van Helsinki Richtsnoer voor Good Clinical Practice (CPMP/ICH/135/95)
Titel: Good Clinical Practice & Monitoring. Initiation Investigator Driven Studies. Versie: 14-jan-2013
 Titel: Good Clinical Practice & Monitoring Initiation Investigator Driven Studies Inhoud Wet- en regelgeving/declaration of Helsinki Good Clinical Practice Patiënteninformatie/ informed consent Basisvereisten
Titel: Good Clinical Practice & Monitoring Initiation Investigator Driven Studies Inhoud Wet- en regelgeving/declaration of Helsinki Good Clinical Practice Patiënteninformatie/ informed consent Basisvereisten
Antwoorden CRO-vragenlijst - foto van het veld
 Antwoorden CRO-vragenlijst - foto van het veld In samenwerking met het RIVM heeft de Inspectie voor de Gezondheidszorg (IGZ) een digitale vragenlijst ontwikkeld die bestond uit drie delen (zie Vragenlijst
Antwoorden CRO-vragenlijst - foto van het veld In samenwerking met het RIVM heeft de Inspectie voor de Gezondheidszorg (IGZ) een digitale vragenlijst ontwikkeld die bestond uit drie delen (zie Vragenlijst
Toezicht op klinisch onderzoek bij STZ-ziekenhuizen. Farmaceutische Bedrijven Deelteam Klinisch Onderzoek
 Toezicht op klinisch onderzoek bij STZ-ziekenhuizen Farmaceutische Bedrijven Deelteam Klinisch Onderzoek Toezicht op klinisch onderzoek bij STZ-ziekenhuizen Bevindingen vanuit de praktijk Conclusies en
Toezicht op klinisch onderzoek bij STZ-ziekenhuizen Farmaceutische Bedrijven Deelteam Klinisch Onderzoek Toezicht op klinisch onderzoek bij STZ-ziekenhuizen Bevindingen vanuit de praktijk Conclusies en
Toezicht op onderzoeker geïnitieerd klinisch onderzoek (IIT) Team Klinisch Onderzoek
 Toezicht op onderzoeker geïnitieerd klinisch onderzoek (IIT) 2014-2016 Team Klinisch Onderzoek Toezicht op IIT 2014-2016 Aanleiding en werkwijze Bevindingen vanuit de praktijk Conclusies en aandachtspunten
Toezicht op onderzoeker geïnitieerd klinisch onderzoek (IIT) 2014-2016 Team Klinisch Onderzoek Toezicht op IIT 2014-2016 Aanleiding en werkwijze Bevindingen vanuit de praktijk Conclusies en aandachtspunten
Toezicht op kwaliteitsborging: ken uw verantwoordelijkheden
 Toezicht op kwaliteitsborging: ken uw verantwoordelijkheden Elysée Hille Karina van Wonderen namens deelteam Klinisch Onderzoek-GCP Afdeling Farmaceutische Bedrijven Workshop Kwaliteitsbewaking door samenwerking
Toezicht op kwaliteitsborging: ken uw verantwoordelijkheden Elysée Hille Karina van Wonderen namens deelteam Klinisch Onderzoek-GCP Afdeling Farmaceutische Bedrijven Workshop Kwaliteitsbewaking door samenwerking
INFORMATIEBLAD. Maart 2011
 INFORMATIEBLAD AANMELDING TRIALBUREAU/DATACENTRUM Maart 2011 Kanker zo snel mogelijk terugdringen en onder controle brengen. We zijn er voor mensen die leven met kanker en de mensen die met hen samenleven.
INFORMATIEBLAD AANMELDING TRIALBUREAU/DATACENTRUM Maart 2011 Kanker zo snel mogelijk terugdringen en onder controle brengen. We zijn er voor mensen die leven met kanker en de mensen die met hen samenleven.
De rol van de Contract Research Organisatie (CRO) Klinisch onderzoek
 De rol van de Contract Research Organisatie (CRO) in klinisch geneesmiddelenonderzoek Klinisch onderzoek Inhoud Aanleiding CRO project Methode en resultaten» Werkwijze en resultaten foto van het veld vragenlijst»
De rol van de Contract Research Organisatie (CRO) in klinisch geneesmiddelenonderzoek Klinisch onderzoek Inhoud Aanleiding CRO project Methode en resultaten» Werkwijze en resultaten foto van het veld vragenlijst»
Monitoring van Investigator Initiated onderzoek
 Monitoring van Investigator Initiated onderzoek V1.0 Angela Vlug Clinical Research Bureau VUmc Wat is een IIS (volgens de NFU) Onderzoek waarvoor de raad van bestuur van een (universitair) medisch centrum
Monitoring van Investigator Initiated onderzoek V1.0 Angela Vlug Clinical Research Bureau VUmc Wat is een IIS (volgens de NFU) Onderzoek waarvoor de raad van bestuur van een (universitair) medisch centrum
BROK staat voor Basiscursus Regelgeving en Organisatie voor Klinisch onderzoekers.
 VEELGESTELDE VRAGEN OVER DE BROK CURSUS Wat is de BROK cursus? BROK staat voor Basiscursus Regelgeving en Organisatie voor Klinisch onderzoekers. Aan de uitvoering van mensgebonden onderzoek worden door
VEELGESTELDE VRAGEN OVER DE BROK CURSUS Wat is de BROK cursus? BROK staat voor Basiscursus Regelgeving en Organisatie voor Klinisch onderzoekers. Aan de uitvoering van mensgebonden onderzoek worden door
Kwaliteitsborging onderzoek in het. NVMETC bijeenkomst 23 november UMC Utrecht. Oktober 2016
 1 Kwaliteitsborging onderzoek in het UMC Utrecht NVMETC bijeenkomst 23 november 2016 Eugenie Ram, kwaliteitsmanager Onderzoek - Office Concernstaf Raad van Bestuur Oktober 2016 UMC Utrecht breed kwaliteitssysteem
1 Kwaliteitsborging onderzoek in het UMC Utrecht NVMETC bijeenkomst 23 november 2016 Eugenie Ram, kwaliteitsmanager Onderzoek - Office Concernstaf Raad van Bestuur Oktober 2016 UMC Utrecht breed kwaliteitssysteem
1. Beschrijving werkgebieden / thema s
 1. Beschrijving werkgebieden / thema s Nr 1 Thema Wetenschappelijke Achtergrond en Opzet van Onderzoek 2 Ethische en veiligheid overwegingen 3 Ontwikkeling en Regelgeving 4 Clinical Trial Operations (Projectorganisatie)
1. Beschrijving werkgebieden / thema s Nr 1 Thema Wetenschappelijke Achtergrond en Opzet van Onderzoek 2 Ethische en veiligheid overwegingen 3 Ontwikkeling en Regelgeving 4 Clinical Trial Operations (Projectorganisatie)
Toezicht op IIT: bevindingen vanuit de praktijk
 Toezicht op IIT: bevindingen vanuit de praktijk Elysée Hille, senior inspecteur namens deelteam KO-GCP Teamcoördinator KO-GCP/PhV/GZH Afdeling Farmaceutische Bedrijven Wat doet de IGZ? Toezicht op klinisch
Toezicht op IIT: bevindingen vanuit de praktijk Elysée Hille, senior inspecteur namens deelteam KO-GCP Teamcoördinator KO-GCP/PhV/GZH Afdeling Farmaceutische Bedrijven Wat doet de IGZ? Toezicht op klinisch
SOP: Voorlichtingsgesprek en uitgesteld informed consent CONTRAST trials
 SOP: Voorlichtingsgesprek en uitgesteld informed consent CONTRAST trials SOP: IC1 Versie Nr.: 1.1 Geldig m.i.v.: 03-04-2018 Auteur: S.A. van den Berg, arts-onderzoeker AMC Autorisator: Dr. H.B. van der
SOP: Voorlichtingsgesprek en uitgesteld informed consent CONTRAST trials SOP: IC1 Versie Nr.: 1.1 Geldig m.i.v.: 03-04-2018 Auteur: S.A. van den Berg, arts-onderzoeker AMC Autorisator: Dr. H.B. van der
Toezicht op klinisch onderzoek - bevindingen vanuit de praktijk
 Toezicht op klinisch onderzoek - bevindingen vanuit de praktijk Namens Deelprogramma Klinisch Onderzoek, IGZ Spreker Dr. ir. J. Eland-Gerritsen Coördinerend/Specialistisch Senior inspecteur Inhoud Toezicht
Toezicht op klinisch onderzoek - bevindingen vanuit de praktijk Namens Deelprogramma Klinisch Onderzoek, IGZ Spreker Dr. ir. J. Eland-Gerritsen Coördinerend/Specialistisch Senior inspecteur Inhoud Toezicht
Het Clinical Research Bureau (CRB) van VUmc
 1 Het Clinical Research Bureau (CRB) van VUmc Angela Vlug Kwaliteitsborging van mensgebonden onderzoek 1 Het Clinical Research Bureau heeft als doel om optimale kwaliteit van de uitvoering van mensgebonden
1 Het Clinical Research Bureau (CRB) van VUmc Angela Vlug Kwaliteitsborging van mensgebonden onderzoek 1 Het Clinical Research Bureau heeft als doel om optimale kwaliteit van de uitvoering van mensgebonden
Bijlage I bij het Kaderreglement van het Parelsnoer Initiatief. Handleiding Parelspecifiek reglement
 Bijlage I bij het Kaderreglement van het Parelsnoer Initiatief Handleiding Parelspecifiek reglement Op grond van artikel 4 lid 17 van het Kaderreglement Parelsnoer Initiatief dient per Parel een reglement
Bijlage I bij het Kaderreglement van het Parelsnoer Initiatief Handleiding Parelspecifiek reglement Op grond van artikel 4 lid 17 van het Kaderreglement Parelsnoer Initiatief dient per Parel een reglement
Vragen en antwoorden over de gegevenssectie van de model-pif
 Vragen en antwoorden over de gegevenssectie van de model-pif Algemene informatie over de Algemene Verordening Gegevensbescherming Waar vind ik algemene informatie over de gevolgen van de Algemene Verordening
Vragen en antwoorden over de gegevenssectie van de model-pif Algemene informatie over de Algemene Verordening Gegevensbescherming Waar vind ik algemene informatie over de gevolgen van de Algemene Verordening
SEMINAR 4 NOVEMBER 2014
 SEMINAR 4 NOVEMBER 2014 Professioneel opzetten en uitvoeren van klinisch onderzoek www.deresearchmanager.nl Striksteeg 7 7411 KR Deventer 0570 594 789 info@deresearchmanager.nl Ontwikkeling Afdeling Innovatie
SEMINAR 4 NOVEMBER 2014 Professioneel opzetten en uitvoeren van klinisch onderzoek www.deresearchmanager.nl Striksteeg 7 7411 KR Deventer 0570 594 789 info@deresearchmanager.nl Ontwikkeling Afdeling Innovatie
SOP aanleveren en afhandelen WMO onderzoek METC Onze Lieve Vrouwe Gasthuis, versie 1, juli
 Aanmelden en afhandelen medisch-wetenschappelijk onderzoek met mensen (WMO-onderzoek) Medisch-ethische toetsingscommissie (METC) Onze Lieve Vrouwe Gasthuis Hieronder treft u aan de procedure van aanmelding
Aanmelden en afhandelen medisch-wetenschappelijk onderzoek met mensen (WMO-onderzoek) Medisch-ethische toetsingscommissie (METC) Onze Lieve Vrouwe Gasthuis Hieronder treft u aan de procedure van aanmelding
Kwaliteitsborging vanuit academisch perspectief DCTF jaarcongres 2016
 Kwaliteitsborging vanuit academisch perspectief DCTF jaarcongres 2016 Gemma Voss 5 oktober 2016 Mensgebonden onderzoek (WMO) in Nederland 2015 CCMO-jaarverslag 2015 CCMO-jaarverslag 2015 Mensgebonden onderzoek
Kwaliteitsborging vanuit academisch perspectief DCTF jaarcongres 2016 Gemma Voss 5 oktober 2016 Mensgebonden onderzoek (WMO) in Nederland 2015 CCMO-jaarverslag 2015 CCMO-jaarverslag 2015 Mensgebonden onderzoek
WMO-GCP opfriscursus Nederlandse Vereniging voor Oncologie Datamanagers 27 februari 2019
 WMO-GCP opfriscursus Nederlandse Vereniging voor Oncologie Datamanagers 27 februari 2019 Agenda Introductie ICH-GCP R2 AVG Kwaliteitssyteem Informed Consent ISF e-tmf Monitoren SAE rapportage Waarom wetgeving?
WMO-GCP opfriscursus Nederlandse Vereniging voor Oncologie Datamanagers 27 februari 2019 Agenda Introductie ICH-GCP R2 AVG Kwaliteitssyteem Informed Consent ISF e-tmf Monitoren SAE rapportage Waarom wetgeving?
Checklist Lokale Uitvoerbaarheid
 Primaire indieningsproces Lokale Uitvoerbaarheid in METC Management, screening door Assistent Secretaris. Hieronder staan de generieke uitgangspunten en is toegelicht hoe de toetsing indiening Lokale Uitvoerbaarheid
Primaire indieningsproces Lokale Uitvoerbaarheid in METC Management, screening door Assistent Secretaris. Hieronder staan de generieke uitgangspunten en is toegelicht hoe de toetsing indiening Lokale Uitvoerbaarheid
9 Documenten. 9.1 t/m 9.3 beheer van documenten. Statusoverzicht. Voorgenomen besluit Bestuursgroep OR. Vastgesteld door Bestuursgroep
 Statusoverzicht. Consultatie 1 Consultatie 2 Voorgenomen besluit Bestuursgroep OR q Instemming q Advies q N.v.t. Vastgesteld door Bestuursgroep N.v.t. N.v.t. Borging. Implementatie m.i.v. Opgenomen in
Statusoverzicht. Consultatie 1 Consultatie 2 Voorgenomen besluit Bestuursgroep OR q Instemming q Advies q N.v.t. Vastgesteld door Bestuursgroep N.v.t. N.v.t. Borging. Implementatie m.i.v. Opgenomen in
Concept procedure Lokale Haalbaarheid
 -------------------------------------------------------------------------------------------------------------------------------------------- Opzet pilot Stap 2 Lokale Haalbaarheid ter voorbereiding op
-------------------------------------------------------------------------------------------------------------------------------------------- Opzet pilot Stap 2 Lokale Haalbaarheid ter voorbereiding op
Publicatieblad van de Europese Unie
 25.3.2017 L 80/7 UITVOERINGSVERORDENING (EU) 2017/556 VAN DE COMMISSIE van 24 maart 2017 houdende de nadere regeling voor de inspectieprocedures inzake goede klinische praktijken overeenkomstig Verordening
25.3.2017 L 80/7 UITVOERINGSVERORDENING (EU) 2017/556 VAN DE COMMISSIE van 24 maart 2017 houdende de nadere regeling voor de inspectieprocedures inzake goede klinische praktijken overeenkomstig Verordening
Kwaliteitssysteem datamanagement. Meetbaar Beter
 Kwaliteitssysteem datamanagement Meetbaar Beter Datum: 20 juli 2017 Versie : 0.10 Kwaliteitssysteem Meetbaar Beter versie 0.10.docx Pagina 1 van 8 Voorwoord Het aantal centra dat is aangesloten bij Meetbaar
Kwaliteitssysteem datamanagement Meetbaar Beter Datum: 20 juli 2017 Versie : 0.10 Kwaliteitssysteem Meetbaar Beter versie 0.10.docx Pagina 1 van 8 Voorwoord Het aantal centra dat is aangesloten bij Meetbaar
Kwaliteitssysteem datamanagement. Meetbaar Beter
 Kwaliteitssysteem datamanagement Meetbaar Beter Datum: 22 maart 2016 Versie : 0.8 Kwaliteitssysteem Meetbaar Beter versie 0.8 Pagina 1 van 8 Voorwoord Het aantal centra dat is aangesloten bij Meetbaar
Kwaliteitssysteem datamanagement Meetbaar Beter Datum: 22 maart 2016 Versie : 0.8 Kwaliteitssysteem Meetbaar Beter versie 0.8 Pagina 1 van 8 Voorwoord Het aantal centra dat is aangesloten bij Meetbaar
Handleiding Goedkeuringsprocedure Raad van Bestuur Zuyderland wetenschappelijk onderzoek
 Handleiding Goedkeuringsprocedure Raad van Bestuur Zuyderland wetenschappelijk onderzoek INLEIDING oor al het onderzoek dat binnen Zuyderland wordt uitgevoerd moet goedkeuring worden verkregen van de Raad
Handleiding Goedkeuringsprocedure Raad van Bestuur Zuyderland wetenschappelijk onderzoek INLEIDING oor al het onderzoek dat binnen Zuyderland wordt uitgevoerd moet goedkeuring worden verkregen van de Raad
Henk Jan Out, Paul van Meurs en Rudolf van Olden. Van eerste humane toediening tot algemeen gebruik
 VII 1 Introductie tot de farmaceutische geneeskunde................................ 1 Henk Jan Out, Paul van Meurs en Rudolf van Olden I Van eerste humane toediening tot algemeen gebruik 2 Exploratory
VII 1 Introductie tot de farmaceutische geneeskunde................................ 1 Henk Jan Out, Paul van Meurs en Rudolf van Olden I Van eerste humane toediening tot algemeen gebruik 2 Exploratory
Aanvraagformulier REGISTRATIE oncologie datamanager
 Aanvraagformulier REGISTRATIE oncologie datamanager 1. Gegevens aanvrager Naam + Voorletters:... Adres:... Postcode + Woonplaats:.... Geboortedatum:.... Geboorteplaats:.... Werkzaam bij: Organisatie +
Aanvraagformulier REGISTRATIE oncologie datamanager 1. Gegevens aanvrager Naam + Voorletters:... Adres:... Postcode + Woonplaats:.... Geboortedatum:.... Geboorteplaats:.... Werkzaam bij: Organisatie +
Gedigitaliseerd onderzoek..
 Gedigitaliseerd onderzoek.. ITC Validation Consultants an extra measure of Quality Frans Leijse Managing Director GSK Global QA-eCompliance Manager Adviseurs voor.. GxP compliance van ICT Systemen Computer
Gedigitaliseerd onderzoek.. ITC Validation Consultants an extra measure of Quality Frans Leijse Managing Director GSK Global QA-eCompliance Manager Adviseurs voor.. GxP compliance van ICT Systemen Computer
AMC Uitvoeringsrichtlijnen: Goedkeuring medisch-wetenschappelijk onderzoek door de Raad van Bestuur
 AMC Uitvoeringsrichtlijnen: Goedkeuring medisch-wetenschappelijk onderzoek door de Raad van Bestuur en Deelname van personeelsleden en studenten aan medisch-wetenschappelijk onderzoek Versie 1.1 Dit document
AMC Uitvoeringsrichtlijnen: Goedkeuring medisch-wetenschappelijk onderzoek door de Raad van Bestuur en Deelname van personeelsleden en studenten aan medisch-wetenschappelijk onderzoek Versie 1.1 Dit document
GOOD CLINICAL PRACTICE
 INTERNATIONAAL RICHTSNOER VOOR GOOD CLINICAL PRACTICE VOOR HET ONDERZOEK MET GENEESMIDDELEN VERTALING NAAR DE NEDERLANDSE PRAKTIJK eerste versie: september 1993 herziene versie: maart 1995 compleet herziene
INTERNATIONAAL RICHTSNOER VOOR GOOD CLINICAL PRACTICE VOOR HET ONDERZOEK MET GENEESMIDDELEN VERTALING NAAR DE NEDERLANDSE PRAKTIJK eerste versie: september 1993 herziene versie: maart 1995 compleet herziene
Procedure multicenter WMO-plichtig klinisch wetenschappelijk onderzoek geïnitieerd vanuit het Elisabeth-TweeSteden Ziekenhuis
 Wetenschappelijk onderzoek in het Elisabeth-TweeSteden Ziekenhuis Procedure multicenter WMO-plichtig klinisch wetenschappelijk onderzoek geïnitieerd vanuit het Elisabeth-TweeSteden Ziekenhuis Bij dit type
Wetenschappelijk onderzoek in het Elisabeth-TweeSteden Ziekenhuis Procedure multicenter WMO-plichtig klinisch wetenschappelijk onderzoek geïnitieerd vanuit het Elisabeth-TweeSteden Ziekenhuis Bij dit type
Clinical Trials in Nederland: op weg naar topkwaliteit DCTF Congres 3 oktober 2012 Lunteren. M.P.W. Lamberti, BA Algemeen Directeur
 Clinical Trials in Nederland: op weg naar topkwaliteit DCTF Congres 3 oktober 2012 Lunteren M.P.W. Lamberti, BA Algemeen Directeur Maastricht UMC-Holding MUMC-Holding CTCM BPCM MI Groningen Utrecht Nijmegen
Clinical Trials in Nederland: op weg naar topkwaliteit DCTF Congres 3 oktober 2012 Lunteren M.P.W. Lamberti, BA Algemeen Directeur Maastricht UMC-Holding MUMC-Holding CTCM BPCM MI Groningen Utrecht Nijmegen
Dit onderzoek wordt uitgevoerd en gefinancierd door Acerta (een farmaceutisch bedrijf).
 Titel: Een gerandomiseerd, multicenter, open-label, fase 3-onderzoek naar de nietinferioriteit van ACP-196 versus Ibrutinib bij eerder behandelde proefpersonen met hoog-risico chronische lymfatische leukemie
Titel: Een gerandomiseerd, multicenter, open-label, fase 3-onderzoek naar de nietinferioriteit van ACP-196 versus Ibrutinib bij eerder behandelde proefpersonen met hoog-risico chronische lymfatische leukemie
Ongewenste voorvallen flow AE SAE SAR SUSAR SADE voor onderzoeker geïnitieerd WMO-plichtig onderzoek
 Ongewenste voorvallen flow AE SAE SAR SUSAR SADE voor onderzoeker geïnitieerd WMO-plichtig onderzoek Melding voorval proefpersoon aan onderzoeker/arts 1 Rapportage voorval door onderzoeker/arts in patiëntenstatus
Ongewenste voorvallen flow AE SAE SAR SUSAR SADE voor onderzoeker geïnitieerd WMO-plichtig onderzoek Melding voorval proefpersoon aan onderzoeker/arts 1 Rapportage voorval door onderzoeker/arts in patiëntenstatus
Voorzitter, vice-voorzitter en secretaris(sen) van de METC Erasmus MC.
 REGLEMENT MEDISCH ETHISCHE TOETSINGS COMMISSIE ERASMUS MC Inleiding Dit reglement geeft, in aanmerking nemende het bepaalde in artikel 16, lid 2, onder b tot en met d van de WMO, voorschriften betreffende
REGLEMENT MEDISCH ETHISCHE TOETSINGS COMMISSIE ERASMUS MC Inleiding Dit reglement geeft, in aanmerking nemende het bepaalde in artikel 16, lid 2, onder b tot en met d van de WMO, voorschriften betreffende
Procedure faciliteren audits
 info@huibhezemans.nl www.huibhezemans.nl Procedure faciliteren audits Inhoud 1 Inleiding... 2 2 Doel... 2 3 Toepassingsgebied... 2 4 Referenties... 2 5 Definities en afkortingen... 2 6 Verantwoordelijkheden,
info@huibhezemans.nl www.huibhezemans.nl Procedure faciliteren audits Inhoud 1 Inleiding... 2 2 Doel... 2 3 Toepassingsgebied... 2 4 Referenties... 2 5 Definities en afkortingen... 2 6 Verantwoordelijkheden,
EU verordening no 536/2014 betreffende klinische proeven met geneesmiddelen voor menselijk gebruik
 EU verordening no 536/2014 betreffende klinische proeven met geneesmiddelen voor menselijk gebruik -Implicaties voor onderzoekers- Paula Vossebeld Symposium van de V&VN RP 10 november 2015 Verordening
EU verordening no 536/2014 betreffende klinische proeven met geneesmiddelen voor menselijk gebruik -Implicaties voor onderzoekers- Paula Vossebeld Symposium van de V&VN RP 10 november 2015 Verordening
5. Goedkeuring deelname door de toetsende METC 6. Start- en einddatum onderzoek 7. Rekening
 Aanleveren documenten voor het uitbrengen van advies over lokale uitvoerbaarheid bij de Medisch-ethische toetsingscommissie (METC) in het Onze Lieve Vrouwe Gasthuis Mocht u nog vragen hebben naar aanleiding
Aanleveren documenten voor het uitbrengen van advies over lokale uitvoerbaarheid bij de Medisch-ethische toetsingscommissie (METC) in het Onze Lieve Vrouwe Gasthuis Mocht u nog vragen hebben naar aanleiding
Kwaliteit borgen wij samen! Monitoren van studies in het ziekenhuis door onderzoekers zelf
 Kwaliteit borgen wij samen! Monitoren van studies in het ziekenhuis door onderzoekers zelf Noortje Koppelman, Adviseur Opleiding & Ontwikkeling Olivier Wegelin, AIOS PhD-student DCTF-congres 5 oktober
Kwaliteit borgen wij samen! Monitoren van studies in het ziekenhuis door onderzoekers zelf Noortje Koppelman, Adviseur Opleiding & Ontwikkeling Olivier Wegelin, AIOS PhD-student DCTF-congres 5 oktober
Tracers als methodiek voor kwaliteitsborging onderzoek in het UMC Utrecht. DCTF jaarcongres 5 oktober Oktober 2016
 Tracers als methodiek voor kwaliteitsborging onderzoek in het UMC Utrecht DCTF jaarcongres 5 oktober 2016 1 Oktober 2016 Eugenie Ram Kwaliteitsmanager Onderzoek afdeling Kwaliteit van Onderzoek Directie
Tracers als methodiek voor kwaliteitsborging onderzoek in het UMC Utrecht DCTF jaarcongres 5 oktober 2016 1 Oktober 2016 Eugenie Ram Kwaliteitsmanager Onderzoek afdeling Kwaliteit van Onderzoek Directie
KLINISCH GENEESMIDDELEN- ONDERZOEK
 KLINISCH GENEESMIDDELEN- ONDERZOEK HET PROCES VAN HET OPSTARTEN VAN KLINISCH ONDERZOEK MET GENEESMIDDELEN GAAT VERANDEREN De ECTR verandert het klinisch onderzoek met geneesmiddelen in Europa. Dit heeft
KLINISCH GENEESMIDDELEN- ONDERZOEK HET PROCES VAN HET OPSTARTEN VAN KLINISCH ONDERZOEK MET GENEESMIDDELEN GAAT VERANDEREN De ECTR verandert het klinisch onderzoek met geneesmiddelen in Europa. Dit heeft
Aanvraagformulier REGISTRATIE CENTRAAL ONCOLOGIE DATAMANAGER GEGEVENS AANVRAGER
 GEGEVENS AANVRAGER Naam + Voorletters Voorna(a)m(en) Adres Postcode + Woonplaats Geboortedatum Geboorteplaats E-mailadres/telefoon Lidmaatschapsnummer NVvOD geen lid Datum preregistratie CDM Werkervaring
GEGEVENS AANVRAGER Naam + Voorletters Voorna(a)m(en) Adres Postcode + Woonplaats Geboortedatum Geboorteplaats E-mailadres/telefoon Lidmaatschapsnummer NVvOD geen lid Datum preregistratie CDM Werkervaring
Checklist en toelichting indienen Lokale Uitvoerbaarheid
 Checklist en toelichting indienen Lokale Uitvoerbaarheid In onderstaande tabel staan de documenten die u moet indienen als u toestemming wilt van de Raad van Bestuur VUmc voor uitvoering van uw onderzoek
Checklist en toelichting indienen Lokale Uitvoerbaarheid In onderstaande tabel staan de documenten die u moet indienen als u toestemming wilt van de Raad van Bestuur VUmc voor uitvoering van uw onderzoek
Officiële uitgave van het Koninkrijk der Nederlanden sinds 1814.
 STAATSCOURANT Officiële uitgave van het Koninkrijk der Nederlanden sinds 1814. Nr. 20221 17 juli 2015 Regeling van de Minister van Volksgezondheid, Welzijn en Sport van 9 juli 2015, houdende regels voor
STAATSCOURANT Officiële uitgave van het Koninkrijk der Nederlanden sinds 1814. Nr. 20221 17 juli 2015 Regeling van de Minister van Volksgezondheid, Welzijn en Sport van 9 juli 2015, houdende regels voor
Procedure multicenter WMO-plichtig klinisch wetenschappelijk onderzoek geïnitieerd vanuit het Elisabeth-TweeSteden Ziekenhuis
 Wetenschappelijk onderzoek in het Elisabeth-TweeSteden Ziekenhuis Procedure multicenter WMO-plichtig klinisch wetenschappelijk onderzoek geïnitieerd vanuit het Elisabeth-TweeSteden Ziekenhuis Bij dit type
Wetenschappelijk onderzoek in het Elisabeth-TweeSteden Ziekenhuis Procedure multicenter WMO-plichtig klinisch wetenschappelijk onderzoek geïnitieerd vanuit het Elisabeth-TweeSteden Ziekenhuis Bij dit type
Handleiding. Investigational Medicinal Product Dossier (IMPD)
 Handleiding Investigational Medicinal Product Dossier (IMPD) Inhoudsopgave Afkortingen... - 3 - Wat is het IMPD?... - 4 - Beslisschema inhoud IMPD... - 5 - Beschrijving inhoud IMPD... - 6 - Overzicht hoofdstukken
Handleiding Investigational Medicinal Product Dossier (IMPD) Inhoudsopgave Afkortingen... - 3 - Wat is het IMPD?... - 4 - Beslisschema inhoud IMPD... - 5 - Beschrijving inhoud IMPD... - 6 - Overzicht hoofdstukken
Praktisch: Wetenschappelijk onderzoek in het Elisabeth-TweeSteden Ziekenhuis. Procedure niet-wmo-plichtig klinisch wetenschappelijk onderzoek
 Wetenschappelijk onderzoek in het Elisabeth-TweeSteden Ziekenhuis Procedure niet-wmo-plichtig klinisch wetenschappelijk onderzoek Deze procedure geldt voor niet-wmo-plichtig onderzoek dat of: a) enkel
Wetenschappelijk onderzoek in het Elisabeth-TweeSteden Ziekenhuis Procedure niet-wmo-plichtig klinisch wetenschappelijk onderzoek Deze procedure geldt voor niet-wmo-plichtig onderzoek dat of: a) enkel
Veel gestelde vragen Melden voorvallen/bijwerkingen bij geneesmiddelenonderzoek
 Veel gestelde vragen Melden voorvallen/bijwerkingen bij geneesmiddelenonderzoek Wat is een SUSAR? SUSAR is de afkorting van Suspected Unexpected Serious Adverse Reaction. In het Nederlands betekent dit
Veel gestelde vragen Melden voorvallen/bijwerkingen bij geneesmiddelenonderzoek Wat is een SUSAR? SUSAR is de afkorting van Suspected Unexpected Serious Adverse Reaction. In het Nederlands betekent dit
Procedure deelnemend aan multicenter WMO-plichtig klinisch wetenschappelijk onderzoek
 Wetenschappelijk onderzoek in het Elisabeth-TweeSteden Ziekenhuis Procedure deelnemend aan multicenter WMO-plichtig klinisch wetenschappelijk onderzoek Bij dit type onderzoek neemt de onderzoeker van het
Wetenschappelijk onderzoek in het Elisabeth-TweeSteden Ziekenhuis Procedure deelnemend aan multicenter WMO-plichtig klinisch wetenschappelijk onderzoek Bij dit type onderzoek neemt de onderzoeker van het
3 april 2014 Partnership in Clinical Trials Martijn Griep, PhD Associate Director Kwaliteit en Naleving Janssen GCO Benelux, Tilburg
 Ideale site ideale samenwerking in clinical trials 3 april 2014 Partnership in Clinical Trials Martijn Griep, PhD Associate Director Kwaliteit en Naleving Janssen GCO Benelux, Tilburg MICROSOFT CORPORATION
Ideale site ideale samenwerking in clinical trials 3 april 2014 Partnership in Clinical Trials Martijn Griep, PhD Associate Director Kwaliteit en Naleving Janssen GCO Benelux, Tilburg MICROSOFT CORPORATION
Standard Operating Procedure
 Standard Operating Procedure SOP: V1 Ontwikkelen Onderzoeksprotocol Auteur Naam: Functie instelling/afdeling Judie van den Elshout Staffunctionaris Wetenschapsbureau Wetenschapsbureau / Cluster Leerhuis
Standard Operating Procedure SOP: V1 Ontwikkelen Onderzoeksprotocol Auteur Naam: Functie instelling/afdeling Judie van den Elshout Staffunctionaris Wetenschapsbureau Wetenschapsbureau / Cluster Leerhuis
1 Wat zijn interne audits?
 1 Wat zijn interne audits? Binnen de organisatie willen we kwaliteit garanderen in de zorgverlening die wij bieden of het product dat we maken. We hebben daarom allerlei afspraken gemaakt over het werk.
1 Wat zijn interne audits? Binnen de organisatie willen we kwaliteit garanderen in de zorgverlening die wij bieden of het product dat we maken. We hebben daarom allerlei afspraken gemaakt over het werk.
Procedure aanvraag voor het verrichten van wetenschappelijk onderzoek in Meander Medisch Centrum
 Procedure aanvraag voor het verrichten van wetenschappelijk onderzoek in Meander Medisch Centrum Commissie Toetsing Wetenschappelijk Onderzoek (TWO) I II Algemeen 1. Alvorens onderzoek in Meander MC van
Procedure aanvraag voor het verrichten van wetenschappelijk onderzoek in Meander Medisch Centrum Commissie Toetsing Wetenschappelijk Onderzoek (TWO) I II Algemeen 1. Alvorens onderzoek in Meander MC van
Wetenschappelijk onderzoek in het Elisabeth-TweeSteden Ziekenhuis. Procedure niet-wmo-plichtig klinisch wetenschappelijk onderzoek
 Wetenschappelijk onderzoek in het Elisabeth-TweeSteden Ziekenhuis Procedure niet-wmo-plichtig klinisch wetenschappelijk onderzoek Deze procedure geldt voor niet-wmo-plichtig onderzoek dat of: a) enkel
Wetenschappelijk onderzoek in het Elisabeth-TweeSteden Ziekenhuis Procedure niet-wmo-plichtig klinisch wetenschappelijk onderzoek Deze procedure geldt voor niet-wmo-plichtig onderzoek dat of: a) enkel
HOVON 141 CLL. Instructies voor de deelnemende site: ICF studie template aanpassen naar een lokaal biobank ICF
 Instructies voor de deelnemende site: ICF studie template aanpassen naar een lokaal biobank ICF Doel van deze studie template Deze studie template is bestemd voor de deelnemende sites in Nederland van
Instructies voor de deelnemende site: ICF studie template aanpassen naar een lokaal biobank ICF Doel van deze studie template Deze studie template is bestemd voor de deelnemende sites in Nederland van
Jouw GCP up-to-date in 45 minuten. Marieke Meulemans, oprichter GCP Central
 Jouw GCP up-to-date in 45 minuten Marieke Meulemans, oprichter GCP Central Waarom een GCP update tijdens de CRA dag? Gedreven Meesterschap. Meesterschap is vakmanschap. Vakmanschap is beheersing van het
Jouw GCP up-to-date in 45 minuten Marieke Meulemans, oprichter GCP Central Waarom een GCP update tijdens de CRA dag? Gedreven Meesterschap. Meesterschap is vakmanschap. Vakmanschap is beheersing van het
Kwaliteit: Minder is meer
 Kwaliteit: Minder is meer Kwaliteit in klinisch onderzoek met medische hulpmiddelen Jako Pranger QA Manager Cardialysis 9 Nov 2012 Kwaliteit en integriteit Mensgebonden onderzoek Trends in kwaliteitsbeleving
Kwaliteit: Minder is meer Kwaliteit in klinisch onderzoek met medische hulpmiddelen Jako Pranger QA Manager Cardialysis 9 Nov 2012 Kwaliteit en integriteit Mensgebonden onderzoek Trends in kwaliteitsbeleving
INTERNATIONAL STANDARD ON AUDITING 560 GEBEURTENISSEN NA DE EINDDATUM VAN DE PERIODE
 INTERNATIONAL STANDARD ON AUDITING 560 GEBEURTENISSEN NA DE EINDDATUM VAN DE PERIODE INHOUDSOPGAVE Paragraaf Inleiding... 1-3 Definities... 4 Gebeurtenissen die zich vóór de datum van de controleverklaring
INTERNATIONAL STANDARD ON AUDITING 560 GEBEURTENISSEN NA DE EINDDATUM VAN DE PERIODE INHOUDSOPGAVE Paragraaf Inleiding... 1-3 Definities... 4 Gebeurtenissen die zich vóór de datum van de controleverklaring
Titel van het onderzoek Inbrengen van continue ambulante peritoneaal dialyse katheters: Kijkoperatie of open techniek?
 Titel van het onderzoek Inbrengen van continue ambulante peritoneaal dialyse katheters: Kijkoperatie of open techniek? Inleiding Geachte heer/mevrouw, Wij vragen u vriendelijk om mee te doen aan een medisch-wetenschappelijk
Titel van het onderzoek Inbrengen van continue ambulante peritoneaal dialyse katheters: Kijkoperatie of open techniek? Inleiding Geachte heer/mevrouw, Wij vragen u vriendelijk om mee te doen aan een medisch-wetenschappelijk
Patiënteninformatieformulier imprint studie
 Patiënteninformatieformulier imprint studie (imaging of PSMA: Registratie en Inventarisatie voor Nederlandse Toepassing) Inleiding Uw arts heeft voorgesteld een aanvraag te doen voor een PSMA-PET-scan.
Patiënteninformatieformulier imprint studie (imaging of PSMA: Registratie en Inventarisatie voor Nederlandse Toepassing) Inleiding Uw arts heeft voorgesteld een aanvraag te doen voor een PSMA-PET-scan.
Procedure # 02 Audits
 Procedure # 02 Audits Versie 4 Datum: 1 november 2017 Goedgekeurd door Bestuursvoorzitter CKZ: 1. DOEL Handtekening Het beschrijven van de wijze waarop, wanneer en door wie er audits worden uitgevoerd
Procedure # 02 Audits Versie 4 Datum: 1 november 2017 Goedgekeurd door Bestuursvoorzitter CKZ: 1. DOEL Handtekening Het beschrijven van de wijze waarop, wanneer en door wie er audits worden uitgevoerd
Procedure monocenter WMO-plichtig klinisch wetenschappelijk onderzoek
 Wetenschappelijk onderzoek in het Elisabeth-TweeSteden Ziekenhuis Procedure monocenter WMO-plichtig klinisch wetenschappelijk onderzoek Bij dit type onderzoek vindt het WMO-plichtig onderzoek enkel plaats
Wetenschappelijk onderzoek in het Elisabeth-TweeSteden Ziekenhuis Procedure monocenter WMO-plichtig klinisch wetenschappelijk onderzoek Bij dit type onderzoek vindt het WMO-plichtig onderzoek enkel plaats
procedure van de procedures
 A.Z. Sint Jan A.V. - apotheek organisatieprocedure procedure van de procedures nummer : ORG-00005 blz 1 van 8 eerste uitgiftedatum : 09.02.2000 datum herziening : 05.07.2006 verantwoordelijke : Wim Renders
A.Z. Sint Jan A.V. - apotheek organisatieprocedure procedure van de procedures nummer : ORG-00005 blz 1 van 8 eerste uitgiftedatum : 09.02.2000 datum herziening : 05.07.2006 verantwoordelijke : Wim Renders
DE MONITOR. Bijlage 1
 DE MONITOR Bijlage 1 legenda procesfase rol voorbereidingsfase v=verantwoordelijk uitvoeringsfase p= partner gerealiseerd evaluatiefase Geen actie agenda werkgroep aandachtslevel regisseur **** direct
DE MONITOR Bijlage 1 legenda procesfase rol voorbereidingsfase v=verantwoordelijk uitvoeringsfase p= partner gerealiseerd evaluatiefase Geen actie agenda werkgroep aandachtslevel regisseur **** direct
Hierbij zend ik u de antwoorden op de vragen van het Kamerlid Kant (SP) over de probioticatrial ( ).
 De Voorzitter van de Tweede Kamer der Staten-Generaal Postbus 20018 2500 EA DEN HAAG Ons kenmerk Inlichtingen bij Doorkiesnummer Den Haag 10 maart 2008 Onderwerp Bijlage(n) Uw brief Kamervragen 1 13 februari
De Voorzitter van de Tweede Kamer der Staten-Generaal Postbus 20018 2500 EA DEN HAAG Ons kenmerk Inlichtingen bij Doorkiesnummer Den Haag 10 maart 2008 Onderwerp Bijlage(n) Uw brief Kamervragen 1 13 februari
Beheer van niet-conformiteiten, preventieve acties en externe klachten. Inhoudstafel
 P. : 1/5 Opsteller: AM Vanherle Verificateur :P. Cliquet, C.Graide Vertaler : AM Vanherle Goedkeuring Naam Functie Handtekening Datum Goedgekeurd door : H. Van Oyen Operationele directeur 29/08/2012 Inhoudstafel
P. : 1/5 Opsteller: AM Vanherle Verificateur :P. Cliquet, C.Graide Vertaler : AM Vanherle Goedkeuring Naam Functie Handtekening Datum Goedgekeurd door : H. Van Oyen Operationele directeur 29/08/2012 Inhoudstafel
