Monitorplan voorbeeld
|
|
|
- Andreas Kuipersё
- 5 jaren geleden
- Aantal bezoeken:
Transcriptie
1 Monitorplan voorbeeld Protocol Er moet in het protocol beschreven worden dat er monitoring plaatsvindt (zie ook CCMO voorbeeld template). Het monitoringplan mag als bijlage worden toegevoegd (in dat geval volstaat verwijzing in het protocol naar het plan) en vormt dus onderdeel van het onderzoeksdossier. PROTOCOL TITEL:. Primary objective Study design Trial timelines Planned number of subjects in the trial Number of sites Sponsor Data entry and query responsibilities DSMB/Safety Review Board Central laboratory Introductie Monitoring van onderzoek is noodzakelijk om te zorgen dat de rechten en het welzijn van de proefpersonen in het onderzoek worden beschermd en te controleren of de gegevens uit het onderzoek die worden gerapporteerd juist en volledig verifieerbaar zijn in brondocumenten. Good Clinical Practice schrijft voor dat de verrichter (sponsor of the study) van een onderzoek een adequate mate en aard van monitoring moet regelen. Doelstelling van monitoring Zorgen dat de uitvoering van het onderzoek in overeenstemming is met het/de op dat moment goedgekeurde protocol/amendement(en), met GCP en met de relevante wettelijke vereisten, identificeren van problemen tijdens het onderzoek en oplossingen zoeken/adviseren.
2 De monitor De monitor moet worden gezien en moet zich gedragen als een verlengstuk van het onderzoeksteam. De monitor dient gekwalificeerd te zijn om deze taak uit te voeren en niet betrokken te zijn bij het onderzoek zelf. Dit betekent dat er aantoonbare parate kennis van GCP, de WMO en andere relevante wet- en regelgeving moet zijn en dat er een relevante training gevolgd is op het gebied van monitoring (certificaat). Definities Source data verification: het controleren of gegevens uit het onderzoek juist worden gerapporteerd in CRFs en volledig verifieerbaar zijn in brondocumenten. Monitoring: het overzien van de voortgang en status van een onderzoek, waarbij wordt gecontroleerd dat het wordt uitgevoerd, opgeschren en gerapporteerd volgens protocol, SOPs, GCP en van toepassing zijnde wet- en regelgeving. Risicoclassificatie On-site monitoring wordt afgestemd op de mate van risico van het onderzoek. Dit betreft het toegevoegde risico van het onderzoek ten opzichte van de standaardbehandeling. De afweging voor de mate van het risico en de daaraan gekoppelde monitoring is de verantwoordelijkheid van de verrichter, is onderdeel van het onderzoeksdossier en moet vooraf worden vastgelegd in het monitoringplan. Uitvoer van monitoring Monitoring zal uitgevoerd worden door een onafhankelijke gekwalificeerde monitor, naam [vul naam in] van Afdeling [vul naam afdeling in]. Of: Bedrijf [vul naam bedrijf in] is verantwoordelijk voor het uitvoeren van monitoring. Bedrijf [vul naam bedrijf in] zal een gekwalificeerde persoon aanwijzen om het onderzoek te monitoren. De monitors worden getrainid op het protocol en zijn bekend met alle onderzoekshandelingen. Frequentie van de monitoring Er zal per centrum minimaal 1 visite per jaar gepland worden. Verder zal er voorafgaand aan de studie een initiatievisite en aan het einde van de studie een close-out visite gepland worden. De initiatie visite zal worden uitgevoerd zodra: Alle benodigde goedkeuringen zijn behaald Het onderzoeksproduct op de locatie is afgeleverd of wordt afgeleverd. CRF en source documenten klaar zijn voor gebruik. Het lab gereed is om bloedsamples te verwerken en op te slaan
3 De eerste monitoring visite zal plaatsvinden zodra de eerste proefpersoon is gerekruteerd, of binnen twee weken daarna. De tabel hieronder geeft een schatting weer van de frequentie van bezoek welke noodzakelijk is voor de monitor. Deze schatting moet continue worden aangescherpt door de monitor en het projectmanagement team. Monitoring frequentie kan moeten worden verhoogd als de rekruteringssnelheid hoger is dan verwacht, bij data entry deadlines. Eventueel kan een andere monitor ondersteunen bij dergelijke drukte. Naam onderzoekslocatie Land Verwacht aantal proefpersonen Startdatum Frequentie van monitoren NB: aantal is afhankelijk van de duur van het onderzoek, aantal proefpersonen, inclusiesnelheid en eerder geobserveerde deviaties. Monitoring procedures Monitoring zal zich richten op de volgende sleutelprocessen in het onderzoek, waarmee zowel de veiligheid en rechten van de proefpersoon als de integriteit van de data wordt gewaarborgd: 1. In- en exclusiecriteria voor alle deelnemers 2. Informed consent formulieren 3. Tijdig invullen van de CRFs. 4. Accurate conclusies op basis van data uit lab formulieren 5. Bloedafnames en verwerking volgens protocol en SOPs 6. Controle van data management processen, zoals data invoer, beantwoorden van onjuiste data en backup van gegevens. 7. Meldingen van adverse events en protocolafwijkingen volgens SOP(s) 8. Drug accountability 9. Follow up handelingen en procedures 10. Inspanningen om proefpersoon in het onderzoek te houden.
4 Source Data Verification Er moet van te voren een gedefinieerde lijst vastgesteld worden van variabelen, inclusief primaire eindpunten, die in duidelijke relatie staan tot de veiligheid en geldigheid van het onderzoek. Specificatie van de te controleren variabelen: In- en exclusiecriteria voor alle deelnemers 100% controle op in- en exclusiecriteria van de 1ste 3 proefpersonen per centrum. Vervolgens zal 10% van de overige proefpersonen worden gecontroleerd op in- en exclusiecriteria. Indien er fout-geïncludeerde proefpersonen in de studie zijn opgenomen zullen mogelijk alle dossiers van dat specifieke centrum gecontroleerd worden. Informed consent. 100% controle op aanwezigheid en juistheid van de ingevulde Informed Consent (IC) formulieren. Tijdig invullen van de CRFs. 10% van alle onderzoeksgegevens zullen gecontroleerd worden met de brondocumenten AEs/SAEs/SUSARs: 100% verificatie geëigende meldingsprocedure van gemelde SAEs, SARs en SUSARs 10% van de proefpersonen worden gecontroleerd op eventuele gemiste SAEs, SARs en SUSARs Drug Accountability: Per centrum zal worden gecontroleerd of er overzichten van ontvangst, uitgifte,retour, opslag, vervaldatum en tijdig bestellen van studiemedicatie of onderzoeksproduct aanwezig zijn en of deze correct en volledig zijn ingevuld (drugaccountability). Ook zal worden gecontroleerd of, indien van toepassing, er een noodenveloppe is voor deblindering. Daarnaast zal worden gecontroleerd welke instructies proefpersonen meekrijgen en of dit correcte instructies zijn. Algemene controle Per centrum en per monitorbezoek zal de inclusiesnelheid en het uitvalpercentage worden gerapporteerd. Per centrum zal de aanwezigheid en volledigheid van de Investigator Site File worden gecontroleerd en bij de verrichter tevens de Study Master File. Per centrum zal worden gecontroleerd of er studieprocedures aanwezig zijn en of deze worden nageleefd en of het studiepersoneel hierop getraind is. Er zal gecontroleerd worden of het laboratorium en/of apotheek GLP/GMP gecertificeerd zijn. (indien van toepassing en indien van toepassing per centrum of centraal)
5 Er zal gecontroleerd worden of biologische monsters correct worden verzameld, gelabeld en opgeslagen. Rapportage De opdrachtgever (origineel) en de onderzoekslocatie (kopie) ontvangen ten eerste het initiatie visite rapport. Indien van toepassing zullen ook overige relevante contacten betreffende het onderzoek schriftelijk vastgelegd worden. De monitor zal een schriftelijk verslag (monitoring visit rapport) bij de opdrachtgever indienen na ieder bezoek aan een onderzoekslocatie (centrum). Deze verslaglegging moet door de opdrachtgever bewaard worden en bij een audit ter inzage beschikbaar zijn. De lokale onderzoeker van een deelnemend centrum ontvangt van ieder bezoek schriftelijk een samenvatting van de controles die er hebben plaatsgevonden en van de bevindingen. Het monitor visite rapport (verslag n.a.v. het monitorbezoek) bevat: Een samenvatting van hetgeen de monitor heeft beoordeeld Een algemene beschrijving van de kwaliteit Een opsomming van belangrijke bevindingen/feiten, afwijkingen en tekortkomingen Een overzicht met te nemen maatregelen en aanbevelingen om naleving van het protocol te garanderen De conclusie Na afloop van het onderzoek ontvangen de opdrachtgever (origineel) en de onderzoekslocatie (kopie) het close-out visite rapport. Bijlagen A. Site initiation visite checklist B. Routine Monitoring Visite checklist C. Routine Monitoring Rapport template D. Investigator Site File checklist E. Close out visite checklist
Toezicht op onderzoeker geïnitieerd klinisch onderzoek (IIT) Team Klinisch Onderzoek
 Toezicht op onderzoeker geïnitieerd klinisch onderzoek (IIT) 2014-2016 Team Klinisch Onderzoek Toezicht op IIT 2014-2016 Aanleiding en werkwijze Bevindingen vanuit de praktijk Conclusies en aandachtspunten
Toezicht op onderzoeker geïnitieerd klinisch onderzoek (IIT) 2014-2016 Team Klinisch Onderzoek Toezicht op IIT 2014-2016 Aanleiding en werkwijze Bevindingen vanuit de praktijk Conclusies en aandachtspunten
Standard Operating Procedure
 Standard Operating Procedure STZ SOP: U9 Monitoren Distributielijst : STZ Datum : 15-10-2012 Revisiedatum : 15-10-2013 Veranderingen ten opzichte van eerdere versies Versiedatum Hoofdstuk Versiedatum Hoofdstuk
Standard Operating Procedure STZ SOP: U9 Monitoren Distributielijst : STZ Datum : 15-10-2012 Revisiedatum : 15-10-2013 Veranderingen ten opzichte van eerdere versies Versiedatum Hoofdstuk Versiedatum Hoofdstuk
Standard Operating Procedure
 Standard Operating Procedure STZ SOP: U10 Audit Distributielijst : STZ Datum : 19-06-2014 Revisiedatum : 19-06-2015 Veranderingen ten opzichte van eerdere versies Versiedatum Opmerkingen Versiedatum Opmerkingen
Standard Operating Procedure STZ SOP: U10 Audit Distributielijst : STZ Datum : 19-06-2014 Revisiedatum : 19-06-2015 Veranderingen ten opzichte van eerdere versies Versiedatum Opmerkingen Versiedatum Opmerkingen
Site selectie visite checklist
 Site selectie visite checklist Informatie sponsor: Naam sponsor: Contactpersoon: Functie: Afdeling: Telefoonnummer : Email : Informatie onderzoekslocatie: Naam onderzoekslocatie : Naam onderzoeker: Functie:
Site selectie visite checklist Informatie sponsor: Naam sponsor: Contactpersoon: Functie: Afdeling: Telefoonnummer : Email : Informatie onderzoekslocatie: Naam onderzoekslocatie : Naam onderzoeker: Functie:
1. Voorafgaand aan de klinische fase van het onderzoek
 Essentiële documenten Bron: Richtsnoer voor good clinical practice (CPMP/ICH/135/95) De verwijzingen in dit document verwijzen naar de artikelen in bovenstaand document. 1. Voorafgaand aan de klinische
Essentiële documenten Bron: Richtsnoer voor good clinical practice (CPMP/ICH/135/95) De verwijzingen in dit document verwijzen naar de artikelen in bovenstaand document. 1. Voorafgaand aan de klinische
Toezicht op IIT: bevindingen vanuit de praktijk
 Toezicht op IIT: bevindingen vanuit de praktijk Elysée Hille, senior inspecteur namens deelteam KO-GCP Teamcoördinator KO-GCP/PhV/GZH Afdeling Farmaceutische Bedrijven Wat doet de IGZ? Toezicht op klinisch
Toezicht op IIT: bevindingen vanuit de praktijk Elysée Hille, senior inspecteur namens deelteam KO-GCP Teamcoördinator KO-GCP/PhV/GZH Afdeling Farmaceutische Bedrijven Wat doet de IGZ? Toezicht op klinisch
RISK BASED MONITORING IIS FROM AN ACADEMIC PERSPECTIVE; SURGICAL SPECIALTIES
 RISK BASED MONITORING IIS FROM AN ACADEMIC PERSPECTIVE; SURGICAL SPECIALTIES 8 Oktober 2014, DCTF Onderzoeksbureau Divisie Heelkundige Specialismen UMC Utrecht Marianne van Es-Gulinck, arts, F.F.P.M. RISK
RISK BASED MONITORING IIS FROM AN ACADEMIC PERSPECTIVE; SURGICAL SPECIALTIES 8 Oktober 2014, DCTF Onderzoeksbureau Divisie Heelkundige Specialismen UMC Utrecht Marianne van Es-Gulinck, arts, F.F.P.M. RISK
Standard Operating Procedure
 Standard Operating Procedure SOP: V9 Initiatievisite Auteur Naam: Functie instelling/afdeling Judie van den Elshout Staffunctionaris Wetenschapsbureau Wetenschapsbureau / Cluster Leerhuis Handtekening:...
Standard Operating Procedure SOP: V9 Initiatievisite Auteur Naam: Functie instelling/afdeling Judie van den Elshout Staffunctionaris Wetenschapsbureau Wetenschapsbureau / Cluster Leerhuis Handtekening:...
Titel: Good Clinical Practice & Monitoring. Initiation Investigator Driven Studies. Versie: 14-jan-2013
 Titel: Good Clinical Practice & Monitoring Initiation Investigator Driven Studies Inhoud Wet- en regelgeving/declaration of Helsinki Good Clinical Practice Patiënteninformatie/ informed consent Basisvereisten
Titel: Good Clinical Practice & Monitoring Initiation Investigator Driven Studies Inhoud Wet- en regelgeving/declaration of Helsinki Good Clinical Practice Patiënteninformatie/ informed consent Basisvereisten
Monitoren vs auditen. CRA dag 21 april 2016
 Monitoren vs auditen CRA dag 21 april 2016 Introductie Freelance consultant, mede oprichter TAPAS Group B.V. Mede oprichter/directeur van CRA B.V. Medical Adviser Yamanouchi Pharma Clinical trial monitor
Monitoren vs auditen CRA dag 21 april 2016 Introductie Freelance consultant, mede oprichter TAPAS Group B.V. Mede oprichter/directeur van CRA B.V. Medical Adviser Yamanouchi Pharma Clinical trial monitor
Standard Operating Procedure
 Standard Operating Procedure STZ SOP: A1 Afsluiting studie Distributielijst : STZ Datum : 03-06-2014 Revisiedatum : 03-06-2015 Veranderingen ten opzichte van eerdere versies Versiedatum Opmerkingen Versiedatum
Standard Operating Procedure STZ SOP: A1 Afsluiting studie Distributielijst : STZ Datum : 03-06-2014 Revisiedatum : 03-06-2015 Veranderingen ten opzichte van eerdere versies Versiedatum Opmerkingen Versiedatum
Standard Operating Procedure
 Standard Operating Procedure STZ SOP: VC9 Proefpersonen- en aansprakelijkheidsverzekering (centraal) Distributielijst : STZ Datum : 10-03-2014 Revisiedatum : 10-03-2015 Veranderingen ten opzichte van eerdere
Standard Operating Procedure STZ SOP: VC9 Proefpersonen- en aansprakelijkheidsverzekering (centraal) Distributielijst : STZ Datum : 10-03-2014 Revisiedatum : 10-03-2015 Veranderingen ten opzichte van eerdere
Standard Operating Procedure
 Standard Operating Procedure STZ SOP: VL5 Protocolamendement (lokaal) Distributielijst : STZ Datum : 03-06-2014 Revisiedatum : 03-06-2015 Veranderingen ten opzichte van eerdere versies Versiedatum Opmerkingen
Standard Operating Procedure STZ SOP: VL5 Protocolamendement (lokaal) Distributielijst : STZ Datum : 03-06-2014 Revisiedatum : 03-06-2015 Veranderingen ten opzichte van eerdere versies Versiedatum Opmerkingen
Standard Operating Procedure
 Standard Operating Procedure STZ SOP: U1 Identificatie, werving en pre-screening proefpersonen Distributielijst : STZ Datum : 19-06-2014 Revisiedatum : 19-06-2015 Veranderingen ten opzichte van eerdere
Standard Operating Procedure STZ SOP: U1 Identificatie, werving en pre-screening proefpersonen Distributielijst : STZ Datum : 19-06-2014 Revisiedatum : 19-06-2015 Veranderingen ten opzichte van eerdere
Standard Operating Procedure
 Standard Operating Procedure STZ SOP: VC8 Beoordeling amendement toetsende commissie (centraal) Distributielijst : STZ Datum : 10-03-2014 Revisiedatum : 10-03-2015 Veranderingen ten opzichte van eerdere
Standard Operating Procedure STZ SOP: VC8 Beoordeling amendement toetsende commissie (centraal) Distributielijst : STZ Datum : 10-03-2014 Revisiedatum : 10-03-2015 Veranderingen ten opzichte van eerdere
Toezicht op klinisch onderzoek - bevindingen vanuit de praktijk
 Toezicht op klinisch onderzoek - bevindingen vanuit de praktijk Namens Deelprogramma Klinisch Onderzoek, IGZ Spreker Dr. ir. J. Eland-Gerritsen Coördinerend/Specialistisch Senior inspecteur Inhoud Toezicht
Toezicht op klinisch onderzoek - bevindingen vanuit de praktijk Namens Deelprogramma Klinisch Onderzoek, IGZ Spreker Dr. ir. J. Eland-Gerritsen Coördinerend/Specialistisch Senior inspecteur Inhoud Toezicht
29 juni Initiatie bijeenkomst PORTEC 4. Kwaliteitsborging WMO GCP richtsnoer. Frank van Leeuwen IKNL
 29 juni 2012 Initiatie bijeenkomst PORTEC 4 Kwaliteitsborging WMO GCP richtsnoer Frank van Leeuwen IKNL Wet en regelgeving Verklaring van Helsinki Richtsnoer voor Good Clinical Practice (CPMP/ICH/135/95)
29 juni 2012 Initiatie bijeenkomst PORTEC 4 Kwaliteitsborging WMO GCP richtsnoer Frank van Leeuwen IKNL Wet en regelgeving Verklaring van Helsinki Richtsnoer voor Good Clinical Practice (CPMP/ICH/135/95)
Aanvraagformulier REGISTRATIE oncologie monitor
 Aanvraagformulier REGISTRATIE oncologie monitor 1. Gegevens aanvrager Naam + Voorletters:... Adres:... Postcode + Woonplaats:.... Geboortedatum:... Geboorteplaats:... Werkzaam bij: Organisatie + Afdeling:...
Aanvraagformulier REGISTRATIE oncologie monitor 1. Gegevens aanvrager Naam + Voorletters:... Adres:... Postcode + Woonplaats:.... Geboortedatum:... Geboorteplaats:... Werkzaam bij: Organisatie + Afdeling:...
Toezicht op klinisch onderzoek bij STZ-ziekenhuizen. Farmaceutische Bedrijven Deelteam Klinisch Onderzoek
 Toezicht op klinisch onderzoek bij STZ-ziekenhuizen Farmaceutische Bedrijven Deelteam Klinisch Onderzoek Toezicht op klinisch onderzoek bij STZ-ziekenhuizen Bevindingen vanuit de praktijk Conclusies en
Toezicht op klinisch onderzoek bij STZ-ziekenhuizen Farmaceutische Bedrijven Deelteam Klinisch Onderzoek Toezicht op klinisch onderzoek bij STZ-ziekenhuizen Bevindingen vanuit de praktijk Conclusies en
Standard Operating Procedure
 Standard Operating Procedure STZ SOP: VL4 Investigator Site File Distributielijst : STZ Datum : 03-06-2014 Revisiedatum : 03-06-2015 Veranderingen ten opzichte van eerdere versies Versiedatum Opmerkingen
Standard Operating Procedure STZ SOP: VL4 Investigator Site File Distributielijst : STZ Datum : 03-06-2014 Revisiedatum : 03-06-2015 Veranderingen ten opzichte van eerdere versies Versiedatum Opmerkingen
Toezicht op klinisch onderzoek: bevindingen uit inspecties bij GGZ instellingen
 Toezicht op klinisch onderzoek: bevindingen uit inspecties bij GGZ instellingen Afdeling Farmaceutische Bedrijven, Klinisch Onderzoek Good Clinical Practice Inhoud Wat doet de IGJ aan toezicht op klinisch
Toezicht op klinisch onderzoek: bevindingen uit inspecties bij GGZ instellingen Afdeling Farmaceutische Bedrijven, Klinisch Onderzoek Good Clinical Practice Inhoud Wat doet de IGJ aan toezicht op klinisch
Standard Operating Procedure
 Standard Operating Procedure STZ SOP: VL2 Aanpassen proefpersoneninformatie / toestemmingsformulier aan lokale situatie Distributielijst : STZ Datum : 20-03-2014 Revisiedatum : 20-03-2015 Veranderingen
Standard Operating Procedure STZ SOP: VL2 Aanpassen proefpersoneninformatie / toestemmingsformulier aan lokale situatie Distributielijst : STZ Datum : 20-03-2014 Revisiedatum : 20-03-2015 Veranderingen
Standard Operating Procedure
 Standard Operating Procedure STZ SOP: U4 Registratie /randomisatie procedure Distributielijst : STZ Datum : 19-06-2014 Revisiedatum : 19-06-2015 Veranderingen ten opzichte van eerdere versies Versiedatum
Standard Operating Procedure STZ SOP: U4 Registratie /randomisatie procedure Distributielijst : STZ Datum : 19-06-2014 Revisiedatum : 19-06-2015 Veranderingen ten opzichte van eerdere versies Versiedatum
1. Beschrijving werkgebieden / thema s
 1. Beschrijving werkgebieden / thema s Nr 1 Thema Wetenschappelijke Achtergrond en Opzet van Onderzoek 2 Ethische en veiligheid overwegingen 3 Ontwikkeling en Regelgeving 4 Clinical Trial Operations (Projectorganisatie)
1. Beschrijving werkgebieden / thema s Nr 1 Thema Wetenschappelijke Achtergrond en Opzet van Onderzoek 2 Ethische en veiligheid overwegingen 3 Ontwikkeling en Regelgeving 4 Clinical Trial Operations (Projectorganisatie)
Standard Operating Procedure
 Standard Operating Procedure STZ SOP: A2 Archiveren studie Distributielijst : STZ Datum : 03-06-2014 Revisiedatum : 03-06-2015 Veranderingen ten opzichte van eerdere versies Versiedatum Opmerkingen Versiedatum
Standard Operating Procedure STZ SOP: A2 Archiveren studie Distributielijst : STZ Datum : 03-06-2014 Revisiedatum : 03-06-2015 Veranderingen ten opzichte van eerdere versies Versiedatum Opmerkingen Versiedatum
Standard Operating Procedure
 Standard Operating Procedure STZ SOP: U5 Datamanagement Distributielijst : STZ Datum : 19-06-2014 Revisiedatum : 19-06-2015 Veranderingen ten opzichte van eerdere versies Versiedatum Opmerkingen Versiedatum
Standard Operating Procedure STZ SOP: U5 Datamanagement Distributielijst : STZ Datum : 19-06-2014 Revisiedatum : 19-06-2015 Veranderingen ten opzichte van eerdere versies Versiedatum Opmerkingen Versiedatum
De rol van de Contract Research Organisatie (CRO) Klinisch onderzoek
 De rol van de Contract Research Organisatie (CRO) in klinisch geneesmiddelenonderzoek Klinisch onderzoek Inhoud Aanleiding CRO project Methode en resultaten» Werkwijze en resultaten foto van het veld vragenlijst»
De rol van de Contract Research Organisatie (CRO) in klinisch geneesmiddelenonderzoek Klinisch onderzoek Inhoud Aanleiding CRO project Methode en resultaten» Werkwijze en resultaten foto van het veld vragenlijst»
STATEC trial praktische uitvoering Hilde Dijcker
 STATEC trial praktische uitvoering 17-04-2018 Hilde Dijcker Inhoud IKNL trialbureau Site activation Datamanagement Monitoring IKNL Trialbureau Site activation: - Ine Leenen en Hilde Dijcker Kwaliteit van
STATEC trial praktische uitvoering 17-04-2018 Hilde Dijcker Inhoud IKNL trialbureau Site activation Datamanagement Monitoring IKNL Trialbureau Site activation: - Ine Leenen en Hilde Dijcker Kwaliteit van
Aanvraagformulier REGISTRATIE centraal oncologie datamanager
 Aanvraagformulier REGISTRATIE centraal oncologie datamanager 1. Gegevens aanvrager Naam + Voorletters:... Adres:... Postcode + Woonplaats:.... Geboortedatum:... Geboorteplaats:... Werkzaam bij: Organisatie
Aanvraagformulier REGISTRATIE centraal oncologie datamanager 1. Gegevens aanvrager Naam + Voorletters:... Adres:... Postcode + Woonplaats:.... Geboortedatum:... Geboorteplaats:... Werkzaam bij: Organisatie
Standard Operating Procedure
 Standard Operating Procedure STZ SOP: U11 Voortgangsrapportage Distributielijst : STZ Datum : 19-06-2014 Revisiedatum : 19-06-2015 Veranderingen ten opzichte van eerdere versies Versiedatum Opmerkingen
Standard Operating Procedure STZ SOP: U11 Voortgangsrapportage Distributielijst : STZ Datum : 19-06-2014 Revisiedatum : 19-06-2015 Veranderingen ten opzichte van eerdere versies Versiedatum Opmerkingen
Formulier Voortgangsrapportage
 Formulier Voortgangsrapportage De METC azm/um wil van al het door haar beoordeelde WMO-onderzoek jaarlijks een voortgangsrapportage zien. Zij heeft deze eis daartoe opgenomen in de tekst van haar eigen
Formulier Voortgangsrapportage De METC azm/um wil van al het door haar beoordeelde WMO-onderzoek jaarlijks een voortgangsrapportage zien. Zij heeft deze eis daartoe opgenomen in de tekst van haar eigen
Kwaliteitsborging onderzoek in het. NVMETC bijeenkomst 23 november UMC Utrecht. Oktober 2016
 1 Kwaliteitsborging onderzoek in het UMC Utrecht NVMETC bijeenkomst 23 november 2016 Eugenie Ram, kwaliteitsmanager Onderzoek - Office Concernstaf Raad van Bestuur Oktober 2016 UMC Utrecht breed kwaliteitssysteem
1 Kwaliteitsborging onderzoek in het UMC Utrecht NVMETC bijeenkomst 23 november 2016 Eugenie Ram, kwaliteitsmanager Onderzoek - Office Concernstaf Raad van Bestuur Oktober 2016 UMC Utrecht breed kwaliteitssysteem
Monitoring van Investigator Initiated onderzoek
 Monitoring van Investigator Initiated onderzoek V1.0 Angela Vlug Clinical Research Bureau VUmc Wat is een IIS (volgens de NFU) Onderzoek waarvoor de raad van bestuur van een (universitair) medisch centrum
Monitoring van Investigator Initiated onderzoek V1.0 Angela Vlug Clinical Research Bureau VUmc Wat is een IIS (volgens de NFU) Onderzoek waarvoor de raad van bestuur van een (universitair) medisch centrum
Standard Operating Procedure
 Standard Operating Procedure STZ SOP: A4 Publicatie Distributielijst : STZ Datum : 20-03-2014 Revisiedatum : 20-03-2015 Veranderingen ten opzichte van eerdere versies Versiedatum Opmerkingen Versiedatum
Standard Operating Procedure STZ SOP: A4 Publicatie Distributielijst : STZ Datum : 20-03-2014 Revisiedatum : 20-03-2015 Veranderingen ten opzichte van eerdere versies Versiedatum Opmerkingen Versiedatum
Standard Operating Procedure
 Standard Operating Procedure STZ SOP: O3 Ontwikkelen, implementeren en beheren van SOP s Distributielijst : STZ Datum : 15-10-2012 Revisiedatum : 15-10-2013 Veranderingen ten opzichte van eerdere versies
Standard Operating Procedure STZ SOP: O3 Ontwikkelen, implementeren en beheren van SOP s Distributielijst : STZ Datum : 15-10-2012 Revisiedatum : 15-10-2013 Veranderingen ten opzichte van eerdere versies
Standard Operating Procedure
 Standard Operating Procedure STZ SOP: U6 Studie medicatie Distributielijst : STZ Datum : 19-06-2014 Revisiedatum : 19-06-2015 Veranderingen ten opzichte van eerdere versies Versiedatum Opmerkingen Versiedatum
Standard Operating Procedure STZ SOP: U6 Studie medicatie Distributielijst : STZ Datum : 19-06-2014 Revisiedatum : 19-06-2015 Veranderingen ten opzichte van eerdere versies Versiedatum Opmerkingen Versiedatum
Toezicht op kwaliteitsborging: ken uw verantwoordelijkheden
 Toezicht op kwaliteitsborging: ken uw verantwoordelijkheden Elysée Hille Karina van Wonderen namens deelteam Klinisch Onderzoek-GCP Afdeling Farmaceutische Bedrijven Workshop Kwaliteitsbewaking door samenwerking
Toezicht op kwaliteitsborging: ken uw verantwoordelijkheden Elysée Hille Karina van Wonderen namens deelteam Klinisch Onderzoek-GCP Afdeling Farmaceutische Bedrijven Workshop Kwaliteitsbewaking door samenwerking
INFORMATIEBLAD. Maart 2011
 INFORMATIEBLAD AANMELDING TRIALBUREAU/DATACENTRUM Maart 2011 Kanker zo snel mogelijk terugdringen en onder controle brengen. We zijn er voor mensen die leven met kanker en de mensen die met hen samenleven.
INFORMATIEBLAD AANMELDING TRIALBUREAU/DATACENTRUM Maart 2011 Kanker zo snel mogelijk terugdringen en onder controle brengen. We zijn er voor mensen die leven met kanker en de mensen die met hen samenleven.
Standard Operating Procedure
 Standard Operating Procedure STZ SOP: U8 Melding van (Serious) Adverse Events en SUSARs Distributielijst : STZ Datum : 19-06-2014 Revisiedatum : 19-06-2015 Veranderingen ten opzichte van eerdere versies
Standard Operating Procedure STZ SOP: U8 Melding van (Serious) Adverse Events en SUSARs Distributielijst : STZ Datum : 19-06-2014 Revisiedatum : 19-06-2015 Veranderingen ten opzichte van eerdere versies
Aanmelden WMO-plichtig onderzoek
 Aanmelden WMO-plichtig onderzoek 1. Doel Het beschrijven van de procedure die gevolgd wordt bij het aanmelden van onderzoek dat onder de WMO valt en waarbij ZGV optreedt als deelnemend centrum. Voordat
Aanmelden WMO-plichtig onderzoek 1. Doel Het beschrijven van de procedure die gevolgd wordt bij het aanmelden van onderzoek dat onder de WMO valt en waarbij ZGV optreedt als deelnemend centrum. Voordat
Kwaliteit borgen wij samen! Monitoren van studies in het ziekenhuis door onderzoekers zelf
 Kwaliteit borgen wij samen! Monitoren van studies in het ziekenhuis door onderzoekers zelf Noortje Koppelman, Adviseur Opleiding & Ontwikkeling Olivier Wegelin, AIOS PhD-student DCTF-congres 5 oktober
Kwaliteit borgen wij samen! Monitoren van studies in het ziekenhuis door onderzoekers zelf Noortje Koppelman, Adviseur Opleiding & Ontwikkeling Olivier Wegelin, AIOS PhD-student DCTF-congres 5 oktober
Het Clinical Research Bureau (CRB) van VUmc
 1 Het Clinical Research Bureau (CRB) van VUmc Angela Vlug Kwaliteitsborging van mensgebonden onderzoek 1 Het Clinical Research Bureau heeft als doel om optimale kwaliteit van de uitvoering van mensgebonden
1 Het Clinical Research Bureau (CRB) van VUmc Angela Vlug Kwaliteitsborging van mensgebonden onderzoek 1 Het Clinical Research Bureau heeft als doel om optimale kwaliteit van de uitvoering van mensgebonden
Aanmelden medischwetenschappelijk
 Aanmelden medischwetenschappelijk onderzoek SOP Aanmelden WMO-plichtig onderzoek_versie juli 2016.doc Pagina 1 van 10 Aanmelden WMO-plichtig onderzoek 1. Doel Het beschrijven van de procedure die gevolgd
Aanmelden medischwetenschappelijk onderzoek SOP Aanmelden WMO-plichtig onderzoek_versie juli 2016.doc Pagina 1 van 10 Aanmelden WMO-plichtig onderzoek 1. Doel Het beschrijven van de procedure die gevolgd
Handleiding Goedkeuringsprocedure Raad van Bestuur Zuyderland wetenschappelijk onderzoek
 Handleiding Goedkeuringsprocedure Raad van Bestuur Zuyderland wetenschappelijk onderzoek INLEIDING oor al het onderzoek dat binnen Zuyderland wordt uitgevoerd moet goedkeuring worden verkregen van de Raad
Handleiding Goedkeuringsprocedure Raad van Bestuur Zuyderland wetenschappelijk onderzoek INLEIDING oor al het onderzoek dat binnen Zuyderland wordt uitgevoerd moet goedkeuring worden verkregen van de Raad
IC ICF ICH ISF. Lijst met afkortingen, definities en termen STZ-Kwaliteitshandboek SOP s
 Lijst met afkortingen, definities en termen STZ-Kwaliteitshandboek SOP s ABR ADR AE AR BROK CCMO CRF CTA CV DSMB EMEA EU EudraCT FU brief GCP GMP IB IC ICF ICH IMPD ISF MEB METC EU RCT SAE SOP SPC SUSAR
Lijst met afkortingen, definities en termen STZ-Kwaliteitshandboek SOP s ABR ADR AE AR BROK CCMO CRF CTA CV DSMB EMEA EU EudraCT FU brief GCP GMP IB IC ICF ICH IMPD ISF MEB METC EU RCT SAE SOP SPC SUSAR
Gedigitaliseerd onderzoek..
 Gedigitaliseerd onderzoek.. ITC Validation Consultants an extra measure of Quality Frans Leijse Managing Director GSK Global QA-eCompliance Manager Adviseurs voor.. GxP compliance van ICT Systemen Computer
Gedigitaliseerd onderzoek.. ITC Validation Consultants an extra measure of Quality Frans Leijse Managing Director GSK Global QA-eCompliance Manager Adviseurs voor.. GxP compliance van ICT Systemen Computer
Standard Operating Procedure
 Standard Operating Procedure STZ SOP: U7 Ondersteunende diensten Distributielijst : STZ Datum : 19-06-2014 Revisiedatum : 19-06-2015 Veranderingen ten opzichte van eerdere versies Versiedatum Opmerkingen
Standard Operating Procedure STZ SOP: U7 Ondersteunende diensten Distributielijst : STZ Datum : 19-06-2014 Revisiedatum : 19-06-2015 Veranderingen ten opzichte van eerdere versies Versiedatum Opmerkingen
Ervaringen met document X
 Martini Ziekenhuis Groningen Ervaringen met document X Ellen Rusch, wetenschappelijk medewerker Wetenschappelijk Instituut Wat gaan we doen? Structuur lokale haalbaarheid Martini Ziekenhuis Het werken
Martini Ziekenhuis Groningen Ervaringen met document X Ellen Rusch, wetenschappelijk medewerker Wetenschappelijk Instituut Wat gaan we doen? Structuur lokale haalbaarheid Martini Ziekenhuis Het werken
Antwoorden CRO-vragenlijst - foto van het veld
 Antwoorden CRO-vragenlijst - foto van het veld In samenwerking met het RIVM heeft de Inspectie voor de Gezondheidszorg (IGZ) een digitale vragenlijst ontwikkeld die bestond uit drie delen (zie Vragenlijst
Antwoorden CRO-vragenlijst - foto van het veld In samenwerking met het RIVM heeft de Inspectie voor de Gezondheidszorg (IGZ) een digitale vragenlijst ontwikkeld die bestond uit drie delen (zie Vragenlijst
Aanvraagformulier REGISTRATIE CENTRAAL ONCOLOGIE DATAMANAGER GEGEVENS AANVRAGER
 GEGEVENS AANVRAGER Naam + Voorletters Voorna(a)m(en) Adres Postcode + Woonplaats Geboortedatum Geboorteplaats E-mailadres/telefoon Lidmaatschapsnummer NVvOD geen lid Datum preregistratie CDM Werkervaring
GEGEVENS AANVRAGER Naam + Voorletters Voorna(a)m(en) Adres Postcode + Woonplaats Geboortedatum Geboorteplaats E-mailadres/telefoon Lidmaatschapsnummer NVvOD geen lid Datum preregistratie CDM Werkervaring
Kwaliteitsborging mensgebonden onderzoek 2.0 Nederlandse Federatie van Universitair Medische Centra
 Kwaliteitsborging mensgebonden onderzoek 2.0 Nederlandse Federatie van Universitair Medische Centra 12.6053 1/34 Voorwoord Voor de universitair medische centra (umc s) is onderzoek met proefpersonen een
Kwaliteitsborging mensgebonden onderzoek 2.0 Nederlandse Federatie van Universitair Medische Centra 12.6053 1/34 Voorwoord Voor de universitair medische centra (umc s) is onderzoek met proefpersonen een
Handleiding Goedkeuringsprocedure Raad van Bestuur Zuyderland voor wetenschappelijk onderzoek
 Handleiding Goedkeuringsprocedure Raad van Bestuur Zuyderland voor wetenschappelijk onderzoek Deze handleiding wordt voortdurend geupdate naar aanleiding van de meest recente wet- en regelgeving en wijzigingen
Handleiding Goedkeuringsprocedure Raad van Bestuur Zuyderland voor wetenschappelijk onderzoek Deze handleiding wordt voortdurend geupdate naar aanleiding van de meest recente wet- en regelgeving en wijzigingen
CCMO Structuur documenten Technische Toetsing (ass.secr.) Inhoudelijke Toetsing (secretaris)
 CHECKLIST WMO Primaire indieningsproces WMO in METC Management, screening door Assistent Secretaris. Hieronder staan de generieke uitgangspunten en is toegelicht hoe de primaire toetsing indiening WMO
CHECKLIST WMO Primaire indieningsproces WMO in METC Management, screening door Assistent Secretaris. Hieronder staan de generieke uitgangspunten en is toegelicht hoe de primaire toetsing indiening WMO
Jouw GCP up-to-date in 45 minuten. Marieke Meulemans, oprichter GCP Central
 Jouw GCP up-to-date in 45 minuten Marieke Meulemans, oprichter GCP Central Waarom een GCP update tijdens de CRA dag? Gedreven Meesterschap. Meesterschap is vakmanschap. Vakmanschap is beheersing van het
Jouw GCP up-to-date in 45 minuten Marieke Meulemans, oprichter GCP Central Waarom een GCP update tijdens de CRA dag? Gedreven Meesterschap. Meesterschap is vakmanschap. Vakmanschap is beheersing van het
Standard Operating Procedure
 Standard Operating Procedure STZ SOP: U2 Informed consent Distributielijst : STZ Datum : 19-06-2014 Revisiedatum : 19-06-2015 Veranderingen ten opzichte van eerdere versies Versiedatum Opmerkingen Versiedatum
Standard Operating Procedure STZ SOP: U2 Informed consent Distributielijst : STZ Datum : 19-06-2014 Revisiedatum : 19-06-2015 Veranderingen ten opzichte van eerdere versies Versiedatum Opmerkingen Versiedatum
Gelijkwaardigheid van niet-geaccrediteerde laboratoria (conform NEN-EN ISO/IEC 17025)
 Gelijkwaardigheid van niet-geaccrediteerde laboratoria (conform NEN-EN ISO/IEC 17025) NEa, 20-07-2012, versie 1.0 INTRODUCTIE In artikel 34 van de Monitoring en Rapportage Verordening (MRV) is beschreven
Gelijkwaardigheid van niet-geaccrediteerde laboratoria (conform NEN-EN ISO/IEC 17025) NEa, 20-07-2012, versie 1.0 INTRODUCTIE In artikel 34 van de Monitoring en Rapportage Verordening (MRV) is beschreven
Handleiding Study Management voor onderzoeker
 Handleiding Study Management voor onderzoeker Onderdeel van Research Manager Handleiding Research Manager onderdeel Study Management 21-07-2017 1 Inhoudsopgave Hoofdstuk: Pagina: 1. Gebruik Study Management
Handleiding Study Management voor onderzoeker Onderdeel van Research Manager Handleiding Research Manager onderdeel Study Management 21-07-2017 1 Inhoudsopgave Hoofdstuk: Pagina: 1. Gebruik Study Management
EU verordening no 536/2014 betreffende klinische proeven met geneesmiddelen voor menselijk gebruik
 EU verordening no 536/2014 betreffende klinische proeven met geneesmiddelen voor menselijk gebruik -Implicaties voor onderzoekers- Paula Vossebeld Symposium van de V&VN RP 10 november 2015 Verordening
EU verordening no 536/2014 betreffende klinische proeven met geneesmiddelen voor menselijk gebruik -Implicaties voor onderzoekers- Paula Vossebeld Symposium van de V&VN RP 10 november 2015 Verordening
Hoofdlijnen van beleid management onderzoeksdata Universiteit voor Humanistiek
 1 november 2016 Hoofdlijnen van beleid management onderzoeksdata Universiteit voor Humanistiek Preambule In deze notitie wordt op hoofdlijnen vastgelegd hoe onderzoeksdata moet worden beheerd. Het is van
1 november 2016 Hoofdlijnen van beleid management onderzoeksdata Universiteit voor Humanistiek Preambule In deze notitie wordt op hoofdlijnen vastgelegd hoe onderzoeksdata moet worden beheerd. Het is van
Veel gestelde vragen Melden voorvallen/bijwerkingen bij geneesmiddelenonderzoek
 Veel gestelde vragen Melden voorvallen/bijwerkingen bij geneesmiddelenonderzoek Wat is een SUSAR? SUSAR is de afkorting van Suspected Unexpected Serious Adverse Reaction. In het Nederlands betekent dit
Veel gestelde vragen Melden voorvallen/bijwerkingen bij geneesmiddelenonderzoek Wat is een SUSAR? SUSAR is de afkorting van Suspected Unexpected Serious Adverse Reaction. In het Nederlands betekent dit
Kwaliteitsborging Geneesmiddelenonderzoek UMC Utrecht Jaarverslag 2007 Bureau Kwaliteitsborging Onderzoek
 Kwaliteitsborging Geneesmiddelenonderzoek UMC Utrecht Jaarverslag 2007 Bureau Kwaliteitsborging Onderzoek UMC Utrecht Julius Centrum voor Gezondheidswetenschappen en Eerstelijns Geneeskunde Clinical Trial
Kwaliteitsborging Geneesmiddelenonderzoek UMC Utrecht Jaarverslag 2007 Bureau Kwaliteitsborging Onderzoek UMC Utrecht Julius Centrum voor Gezondheidswetenschappen en Eerstelijns Geneeskunde Clinical Trial
Clinical Trials in Nederland: op weg naar topkwaliteit DCTF Congres 3 oktober 2012 Lunteren. M.P.W. Lamberti, BA Algemeen Directeur
 Clinical Trials in Nederland: op weg naar topkwaliteit DCTF Congres 3 oktober 2012 Lunteren M.P.W. Lamberti, BA Algemeen Directeur Maastricht UMC-Holding MUMC-Holding CTCM BPCM MI Groningen Utrecht Nijmegen
Clinical Trials in Nederland: op weg naar topkwaliteit DCTF Congres 3 oktober 2012 Lunteren M.P.W. Lamberti, BA Algemeen Directeur Maastricht UMC-Holding MUMC-Holding CTCM BPCM MI Groningen Utrecht Nijmegen
Handleiding Goedkeuringsprocedure Raad van Bestuur Zuyderland voor wetenschappelijk onderzoek - Handleiding voor externe onderzoekers -
 Handleiding Goedkeuringsprocedure Raad van Bestuur Zuyderland voor wetenschappelijk onderzoek - Handleiding voor externe onderzoekers - Deze handleiding wordt voortdurend geupdate naar aanleiding van de
Handleiding Goedkeuringsprocedure Raad van Bestuur Zuyderland voor wetenschappelijk onderzoek - Handleiding voor externe onderzoekers - Deze handleiding wordt voortdurend geupdate naar aanleiding van de
 ------------------------------------------------------------------------------------------------------------------------------------------- Concept Procedure Lokale Haalbaarheid klinisch geneesmiddelenonderzoek
------------------------------------------------------------------------------------------------------------------------------------------- Concept Procedure Lokale Haalbaarheid klinisch geneesmiddelenonderzoek
Klinische studies. Veel meer dan een extra tube
 Klinische studies Veel meer dan een extra tube Good Clinical Practice Het geheel van kwaliteitseisen op ethisch en wetenschappelijk gebied, die internationaal zijn erkend en moeten worden gerespecteerd
Klinische studies Veel meer dan een extra tube Good Clinical Practice Het geheel van kwaliteitseisen op ethisch en wetenschappelijk gebied, die internationaal zijn erkend en moeten worden gerespecteerd
Inhoud onderzoeksdossier
 Inhoud onderzoeksdossier (documenten in de witte box zijn nodig voor de primaire beoordeling) A. Brieven B. Formulieren C. Onderzoeksprotocol en protocolamendementen D. Productinformatie E. Informatie
Inhoud onderzoeksdossier (documenten in de witte box zijn nodig voor de primaire beoordeling) A. Brieven B. Formulieren C. Onderzoeksprotocol en protocolamendementen D. Productinformatie E. Informatie
De laatste versie van dit document is te downloaden op: www.umcutrecht.nl/metc. Indienen documenten bij de METC UMC Utrecht
 Indienen documenten bij de METC UMC Utrecht Begin hier Bekijk in onderstaande tabel wat u wilt indienen. Kijk daarna welke methode van indiening en welke documenten bij uw indiening horen. Volg bij het
Indienen documenten bij de METC UMC Utrecht Begin hier Bekijk in onderstaande tabel wat u wilt indienen. Kijk daarna welke methode van indiening en welke documenten bij uw indiening horen. Volg bij het
Algemene informatie ISO 9001
 Certificeren zoals het hoort! Algemene informatie ISO 9001 Algemene informatie ISO 9001 086 versie 01.2 26-04-2019 Inleiding In deze algemene informatie leggen we u uit wat de ISO 9001 norm inhoudt en
Certificeren zoals het hoort! Algemene informatie ISO 9001 Algemene informatie ISO 9001 086 versie 01.2 26-04-2019 Inleiding In deze algemene informatie leggen we u uit wat de ISO 9001 norm inhoudt en
Veiligheid en methodologie of Waarom voortijdig stoppen? Job van der Palen METC Twente
 Veiligheid en methodologie of Waarom voortijdig stoppen? Job van der Palen METC Twente Waarom voortijdig stoppen? Veiligheid Effectiviteit Futiliteit Andere redenen Veiligheid (1) Data and Safety Monitoring
Veiligheid en methodologie of Waarom voortijdig stoppen? Job van der Palen METC Twente Waarom voortijdig stoppen? Veiligheid Effectiviteit Futiliteit Andere redenen Veiligheid (1) Data and Safety Monitoring
Voortgangsrapportage
 Rechtmatigheid Wat hebben we bereikt? Voortgangsrapportage Rechtmatigheid Stand van zaken per 1 juli Behoort bij brief met kenmerk - 50651 Voortgangsrapportage Rechtmatigheid, juli 1 FASE 1 WET EN REGELGEVING
Rechtmatigheid Wat hebben we bereikt? Voortgangsrapportage Rechtmatigheid Stand van zaken per 1 juli Behoort bij brief met kenmerk - 50651 Voortgangsrapportage Rechtmatigheid, juli 1 FASE 1 WET EN REGELGEVING
nee nee nee Wordt proefpersoon aan handelingen onderworpen of gedragswijze opgelegd?
 Medischwetenschappelijk onderzoek en deelname proefpersonen? Wordt proefpersoon aan handelingen onderworpen of gedragswijze opgelegd? Worden behandelingen met elkaar via randomisatie vergeleken? Vallen
Medischwetenschappelijk onderzoek en deelname proefpersonen? Wordt proefpersoon aan handelingen onderworpen of gedragswijze opgelegd? Worden behandelingen met elkaar via randomisatie vergeleken? Vallen
Aanvraagformulier REGISTRATIE oncologie datamanager
 Aanvraagformulier REGISTRATIE oncologie datamanager 1. Gegevens aanvrager Naam + Voorletters:... Adres:... Postcode + Woonplaats:.... Geboortedatum:.... Geboorteplaats:.... Werkzaam bij: Organisatie +
Aanvraagformulier REGISTRATIE oncologie datamanager 1. Gegevens aanvrager Naam + Voorletters:... Adres:... Postcode + Woonplaats:.... Geboortedatum:.... Geboorteplaats:.... Werkzaam bij: Organisatie +
Waarom studies voortijdig stoppen. Job van der Palen METC Twente
 Waarom studies voortijdig stoppen Job van der Palen METC Twente Waarom studies voortijdig stoppen? Veiligheid Effectiviteit Futiliteit Andere redenen Veiligheid (1) Data and Safety Monitoring Board (DSMB)
Waarom studies voortijdig stoppen Job van der Palen METC Twente Waarom studies voortijdig stoppen? Veiligheid Effectiviteit Futiliteit Andere redenen Veiligheid (1) Data and Safety Monitoring Board (DSMB)
Checklist Lokale Uitvoerbaarheid
 Primaire indieningsproces Lokale Uitvoerbaarheid in METC Management, screening door Assistent Secretaris. Hieronder staan de generieke uitgangspunten en is toegelicht hoe de toetsing indiening Lokale Uitvoerbaarheid
Primaire indieningsproces Lokale Uitvoerbaarheid in METC Management, screening door Assistent Secretaris. Hieronder staan de generieke uitgangspunten en is toegelicht hoe de toetsing indiening Lokale Uitvoerbaarheid
Kwaliteitsborging vanuit academisch perspectief DCTF jaarcongres 2016
 Kwaliteitsborging vanuit academisch perspectief DCTF jaarcongres 2016 Gemma Voss 5 oktober 2016 Mensgebonden onderzoek (WMO) in Nederland 2015 CCMO-jaarverslag 2015 CCMO-jaarverslag 2015 Mensgebonden onderzoek
Kwaliteitsborging vanuit academisch perspectief DCTF jaarcongres 2016 Gemma Voss 5 oktober 2016 Mensgebonden onderzoek (WMO) in Nederland 2015 CCMO-jaarverslag 2015 CCMO-jaarverslag 2015 Mensgebonden onderzoek
SOP aanleveren en afhandelen WMO onderzoek METC Onze Lieve Vrouwe Gasthuis, versie 1, juli
 Aanmelden en afhandelen medisch-wetenschappelijk onderzoek met mensen (WMO-onderzoek) Medisch-ethische toetsingscommissie (METC) Onze Lieve Vrouwe Gasthuis Hieronder treft u aan de procedure van aanmelding
Aanmelden en afhandelen medisch-wetenschappelijk onderzoek met mensen (WMO-onderzoek) Medisch-ethische toetsingscommissie (METC) Onze Lieve Vrouwe Gasthuis Hieronder treft u aan de procedure van aanmelding
Klinisch onderzoek beter mogelijk met een EPD. Prof. Dr. H. Pieterse Profess Medical Consultancy Voorzitter NVMA 3 juni 2010
 1 Klinisch onderzoek beter mogelijk met een EPD Prof. Dr. H. Pieterse Profess Medical Consultancy Voorzitter NVMA 3 juni 2010 Agenda 2 Aan welke wettelijke eisen moet mensgebonden onderzoek in Nederland
1 Klinisch onderzoek beter mogelijk met een EPD Prof. Dr. H. Pieterse Profess Medical Consultancy Voorzitter NVMA 3 juni 2010 Agenda 2 Aan welke wettelijke eisen moet mensgebonden onderzoek in Nederland
Resultaten CRO-vragenlijst - foto van het veld
 Resultaten CRO-vragenlijst - foto van het veld Dee1: Algemene kenmerken van de organisatie Dit hoofdstuk beschrijft de kenmerken, werkzaamheden en de kwaliteit van 9 CRO s waaraan verrrichters taken en
Resultaten CRO-vragenlijst - foto van het veld Dee1: Algemene kenmerken van de organisatie Dit hoofdstuk beschrijft de kenmerken, werkzaamheden en de kwaliteit van 9 CRO s waaraan verrrichters taken en
Ongewenste voorvallen flow AE SAE SAR SUSAR SADE voor onderzoeker geïnitieerd WMO-plichtig onderzoek
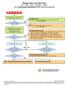 Ongewenste voorvallen flow AE SAE SAR SUSAR SADE voor onderzoeker geïnitieerd WMO-plichtig onderzoek Melding voorval proefpersoon aan onderzoeker/arts 1 Rapportage voorval door onderzoeker/arts in patiëntenstatus
Ongewenste voorvallen flow AE SAE SAR SUSAR SADE voor onderzoeker geïnitieerd WMO-plichtig onderzoek Melding voorval proefpersoon aan onderzoeker/arts 1 Rapportage voorval door onderzoeker/arts in patiëntenstatus
Vragen en antwoorden over de gegevenssectie van de model-pif
 Vragen en antwoorden over de gegevenssectie van de model-pif Algemene informatie over de Algemene Verordening Gegevensbescherming Waar vind ik algemene informatie over de gevolgen van de Algemene Verordening
Vragen en antwoorden over de gegevenssectie van de model-pif Algemene informatie over de Algemene Verordening Gegevensbescherming Waar vind ik algemene informatie over de gevolgen van de Algemene Verordening
Aanvraagformulier REGISTRATIE LOKAAL ONCOLOGIE DATAMANAGER GEGEVENS AANVRAGER
 GEGEVENS AANVRAGER Naam + Voorletters Voorna(a)m(en) Adres Postcode + Woonplaats Geboortedatum Geboorteplaats E-mailadres/telefoon Lidmaatschapsnummer NVvOD geen lid Datum preregistratie LDM Werkervaring
GEGEVENS AANVRAGER Naam + Voorletters Voorna(a)m(en) Adres Postcode + Woonplaats Geboortedatum Geboorteplaats E-mailadres/telefoon Lidmaatschapsnummer NVvOD geen lid Datum preregistratie LDM Werkervaring
GEMEENTELIJKE TELECOMMUNICATIE MOBIELE COMMUNICATIE. Bijlage 04 Kwaliteitsborging en auditing
 GEMEENTELIJKE TELECOMMUNICATIE MOBIELE COMMUNICATIE Bijlage 04 Kwaliteitsborging en auditing Inhoud 1 Inleiding 3 2 Aantonen kwaliteitsborging van de dienstverlening 4 3 Auditing 5 3.1 Wanneer toepassen
GEMEENTELIJKE TELECOMMUNICATIE MOBIELE COMMUNICATIE Bijlage 04 Kwaliteitsborging en auditing Inhoud 1 Inleiding 3 2 Aantonen kwaliteitsborging van de dienstverlening 4 3 Auditing 5 3.1 Wanneer toepassen
Voorschriften Moneycard
 Voorschriften Moneycard Voorschriften Moneycard Rabobank. Een bank met ideeën. Deze voorschriften zijn een onderdeel van de Algemene Voorwaarden Verstrekken en opladen Moneycards 2013. 1. Starten met de
Voorschriften Moneycard Voorschriften Moneycard Rabobank. Een bank met ideeën. Deze voorschriften zijn een onderdeel van de Algemene Voorwaarden Verstrekken en opladen Moneycards 2013. 1. Starten met de
VOORBEEL. De expert is verbonden aan mijn vakgroep/instituut. Ik heb samen met een datamanagement expert intern het DMP opgesteld.
 DMP title Project Name Voorbeeld ingevuld DMP 'Analgosedation after cardiac surgery in infants: A "model-based" nation-wide randomized controlled trial' - DMP title Principal Investigator / Researcher
DMP title Project Name Voorbeeld ingevuld DMP 'Analgosedation after cardiac surgery in infants: A "model-based" nation-wide randomized controlled trial' - DMP title Principal Investigator / Researcher
DIFFERENT STEPS IN DRUG DEVELOPMENT: FROM THEORETICAL CONCEPT TO ACCESS FOR PATIENTS ROLE OF THE ETHICAL COMMITTEES
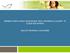 DIFFERENT STEPS IN DRUG DEVELOPMENT: FROM THEORETICAL CONCEPT TO ACCESS FOR PATIENTS ROLE OF THE ETHICAL COMMITTEES Klinische trials Verplicht vooraleer een geneesmiddel een marketing autorisatie kan krijgen
DIFFERENT STEPS IN DRUG DEVELOPMENT: FROM THEORETICAL CONCEPT TO ACCESS FOR PATIENTS ROLE OF THE ETHICAL COMMITTEES Klinische trials Verplicht vooraleer een geneesmiddel een marketing autorisatie kan krijgen
Risk Based Monitoring:
 Risk Based Monitoring: Sharing best practices Tine Horsten, MSc Manager Quality Control Unit / Risk Counselor Clinical Trial Center Maastricht (CTCM) Dianne Neppelenbroek, MSc Sr CRA AstraZeneca, Zoetermeer
Risk Based Monitoring: Sharing best practices Tine Horsten, MSc Manager Quality Control Unit / Risk Counselor Clinical Trial Center Maastricht (CTCM) Dianne Neppelenbroek, MSc Sr CRA AstraZeneca, Zoetermeer
HOVON 141 CLL. Instructies voor de deelnemende site: ICF studie template aanpassen naar een lokaal biobank ICF
 Instructies voor de deelnemende site: ICF studie template aanpassen naar een lokaal biobank ICF Doel van deze studie template Deze studie template is bestemd voor de deelnemende sites in Nederland van
Instructies voor de deelnemende site: ICF studie template aanpassen naar een lokaal biobank ICF Doel van deze studie template Deze studie template is bestemd voor de deelnemende sites in Nederland van
Eindrapport van het GDP-API inspectiebezoek aan Euro-Chemicals B.V. te Denekamp, op 15 februari Utrecht, 2017
 Eindrapport van het GDP-API inspectiebezoek aan Euro-Chemicals B.. te Denekamp, op 15 februari 2017 Utrecht, 2017 1. Geïnspecteerde locatie(s): Euro-Chemicals B.. Knik 10 7591 PZ DENEKAMP 2. Activiteiten:
Eindrapport van het GDP-API inspectiebezoek aan Euro-Chemicals B.. te Denekamp, op 15 februari 2017 Utrecht, 2017 1. Geïnspecteerde locatie(s): Euro-Chemicals B.. Knik 10 7591 PZ DENEKAMP 2. Activiteiten:
AMC Uitvoeringsrichtlijnen: Goedkeuring medisch-wetenschappelijk onderzoek door de Raad van Bestuur
 AMC Uitvoeringsrichtlijnen: Goedkeuring medisch-wetenschappelijk onderzoek door de Raad van Bestuur en Deelname van personeelsleden en studenten aan medisch-wetenschappelijk onderzoek Versie 1.1 Dit document
AMC Uitvoeringsrichtlijnen: Goedkeuring medisch-wetenschappelijk onderzoek door de Raad van Bestuur en Deelname van personeelsleden en studenten aan medisch-wetenschappelijk onderzoek Versie 1.1 Dit document
Kwaliteit: Minder is meer
 Kwaliteit: Minder is meer Kwaliteit in klinisch onderzoek met medische hulpmiddelen Jako Pranger QA Manager Cardialysis 9 Nov 2012 Kwaliteit en integriteit Mensgebonden onderzoek Trends in kwaliteitsbeleving
Kwaliteit: Minder is meer Kwaliteit in klinisch onderzoek met medische hulpmiddelen Jako Pranger QA Manager Cardialysis 9 Nov 2012 Kwaliteit en integriteit Mensgebonden onderzoek Trends in kwaliteitsbeleving
EU verordening geneesmiddelenonderzoek
 EU verordening geneesmiddelenonderzoek Beoordelingen Europese s/jl mul/na/onaal vs. na/onale aanvraag Let op: de beoordeling wordt niet bij u ingediend maar in Europa via een Europese portal De beoordeling
EU verordening geneesmiddelenonderzoek Beoordelingen Europese s/jl mul/na/onaal vs. na/onale aanvraag Let op: de beoordeling wordt niet bij u ingediend maar in Europa via een Europese portal De beoordeling
Geneesmiddelenonderzoek en de ziekenhuisapotheek
 Geneesmiddelenonderzoek en de ziekenhuisapotheek Pierre Bet ziekenhuisapotheker Klinische Farmacologie & Apotheek VU medisch centrum feb 2011 Inhoud Verantwoordelijkheden Bereiding van IMP Voortraject
Geneesmiddelenonderzoek en de ziekenhuisapotheek Pierre Bet ziekenhuisapotheker Klinische Farmacologie & Apotheek VU medisch centrum feb 2011 Inhoud Verantwoordelijkheden Bereiding van IMP Voortraject
HANDLEIDING LOKALE UITVOERBAARHEID VOOR EEN INTERNE INDIENER. Werken in het METC Management-Systeem METC Erasmus MC
 HANDLEIDING LOKALE UITVOERBAARHEID VOOR EEN INTERNE INDIENER Werken in het METC Management-Systeem METC Erasmus MC METC Erasmus MC versie 1 augustus 2018 Inhoud 1. Inleiding... 2 2. Toegang tot het METC
HANDLEIDING LOKALE UITVOERBAARHEID VOOR EEN INTERNE INDIENER Werken in het METC Management-Systeem METC Erasmus MC METC Erasmus MC versie 1 augustus 2018 Inhoud 1. Inleiding... 2 2. Toegang tot het METC
Informatie Researchcursus
 Informatie Researchcursus Cursus research professional gevorderden Tijdens deze cursus zal er dieper worden ingegaan op allerlei facetten van een researchafdeling. Er zal kort het protocol worden behandeld,
Informatie Researchcursus Cursus research professional gevorderden Tijdens deze cursus zal er dieper worden ingegaan op allerlei facetten van een researchafdeling. Er zal kort het protocol worden behandeld,
KLINISCH GENEESMIDDELEN- ONDERZOEK
 KLINISCH GENEESMIDDELEN- ONDERZOEK HET PROCES VAN HET OPSTARTEN VAN KLINISCH ONDERZOEK MET GENEESMIDDELEN GAAT VERANDEREN De ECTR verandert het klinisch onderzoek met geneesmiddelen in Europa. Dit heeft
KLINISCH GENEESMIDDELEN- ONDERZOEK HET PROCES VAN HET OPSTARTEN VAN KLINISCH ONDERZOEK MET GENEESMIDDELEN GAAT VERANDEREN De ECTR verandert het klinisch onderzoek met geneesmiddelen in Europa. Dit heeft
In de bijlage heb ik de tekortkomingen en de correcties daarop puntsgewijs beschreven.
 Academisch Ziekenhuis Maastricht t.a.v. Raad van Bestuur Postbus 5800 6202 AZ MAASTRICHT Betreft bezoek afdeling Urologie Geneesmiddelen En Medische Technologie Wilh. van Pruisenweg 52 Den Haag Postbus
Academisch Ziekenhuis Maastricht t.a.v. Raad van Bestuur Postbus 5800 6202 AZ MAASTRICHT Betreft bezoek afdeling Urologie Geneesmiddelen En Medische Technologie Wilh. van Pruisenweg 52 Den Haag Postbus
Kwaliteitssysteem datamanagement. Meetbaar Beter
 Kwaliteitssysteem datamanagement Meetbaar Beter Datum: 20 juli 2017 Versie : 0.10 Kwaliteitssysteem Meetbaar Beter versie 0.10.docx Pagina 1 van 8 Voorwoord Het aantal centra dat is aangesloten bij Meetbaar
Kwaliteitssysteem datamanagement Meetbaar Beter Datum: 20 juli 2017 Versie : 0.10 Kwaliteitssysteem Meetbaar Beter versie 0.10.docx Pagina 1 van 8 Voorwoord Het aantal centra dat is aangesloten bij Meetbaar
NFU NEDERLANDSE FEDERATIE VAN UNIVERSITAIR MEDISCHE CENTRA
 Kwaliteitsborging van mensgebonden onderzoek NFU NEDERLANDSE FEDERATIE VAN UNIVERSITAIR MEDISCHE CENTRA Kwaliteitsborging van mensgebonden onderzoek Nederlandse Federatie van Universitair Medische Centra
Kwaliteitsborging van mensgebonden onderzoek NFU NEDERLANDSE FEDERATIE VAN UNIVERSITAIR MEDISCHE CENTRA Kwaliteitsborging van mensgebonden onderzoek Nederlandse Federatie van Universitair Medische Centra
HOE INCLUDEER/REGISTREER IK EEN PATIËNT/DATA?
 HOE INCLUDEER/REGISTREER IK EEN PATIËNT/DATA? Instructies over de MR PROPER website en Open Clinica. Inclusie van een patiënt: Stap 1: bezoek in uw webbrowser (Internet Explorer, Google Chrome, Mozilla
HOE INCLUDEER/REGISTREER IK EEN PATIËNT/DATA? Instructies over de MR PROPER website en Open Clinica. Inclusie van een patiënt: Stap 1: bezoek in uw webbrowser (Internet Explorer, Google Chrome, Mozilla
1. Inloggen. 1.1 Eerste keer inloggen
 . Inloggen LET OP: Deze handleiding beschrijft data invoer voor de RACOST studie in de studie-database. Deze database is niet geschikt voor testdoeleinden. Als u de handelingen uit deze handleiding wilt
. Inloggen LET OP: Deze handleiding beschrijft data invoer voor de RACOST studie in de studie-database. Deze database is niet geschikt voor testdoeleinden. Als u de handelingen uit deze handleiding wilt
