Standard Operating Procedure
|
|
|
- Andreas Willemsen
- 7 jaren geleden
- Aantal bezoeken:
Transcriptie
1 Standard Operating Procedure STZ SOP: A1 Afsluiting studie Distributielijst : STZ Datum : Revisiedatum : Veranderingen ten opzichte van eerdere versies Versiedatum Opmerkingen Versiedatum Opmerkingen Jaarlijkse revisie, administratieve wijzigingen en wijzigingen n.a.v. commentaar MST Versiedatum Pagina 1 van 6
2 1. Doel Het beschrijven van de procedure voor het afsluiten van een studie. 2. Afkortingen, definities en termen CCMO CRF GCP ISF METC SAE SOP WMO Centrale Commissie Mensgebonden Onderzoek Case Report Form Good Clinical Practice Investigator Site File Medisch Ethische Toetsingscommissie Serious Adverse Event Standard Operating Procedure Wet Medisch-wetenschappelijk Onderzoek met mensen Case Report Form: Een gedrukt, optisch of elektronisch document dat ontworpen is om alle volgens het protocol vereiste informatie die per proefpersoon aan de sponsor moet worden gerapporteerd in vast te leggen. CCMO: De CCMO is het overkoepelende orgaan van alle Medisch Ethische Toetsingscommissies in Nederland en de bevoegde instantie (competent authority) voor geneesmiddelenonderzoek. De CCMO waarborgt de bescherming van proefpersonen betrokken bij medisch-wetenschappelijk onderzoek, middels toetsing aan de daarvoor vastgestelde wettelijke bepalingen en met inachtneming van de voortgang van de medische wetenschap. Tevens fungeren zij als centraal toetsende commissie in specifieke gevallen. Documentation / verslaglegging: Alle vastgelegde gegevens, in welke vorm dan ook (waaronder, maar niet uitsluitend, schriftelijke, elektronische, magnetische en optische data en scans, röntgenfoto s en electrocardiogrammen) waarin de methoden, de uitvoering en/of de resultaten van onderzoek, de factoren die het onderzoek beïnvloeden en de genomen maatregelen worden beschreven. Essential Documents / Essentiële documenten: Documenten die het elk afzonderlijk en als geheel mogelijk maken de uitvoering van een klinisch onderzoek en de kwaliteit van de verkregen gegevens te evalueren. Investigator / onderzoeker: De persoon die verantwoordelijk is voor de uitvoering van een klinisch onderzoek op één onderzoekslocatie. De onderzoeker die landelijk verantwoordelijk is voor de studie wordt de CCI (country co-ordinating investigator) genoemd. Als een klinisch onderzoek op één onderzoekslocatie door één team van personen wordt uitgevoerd dan is de onderzoeker de verantwoordelijke teamleider en kan deze als hoofdonderzoeker (principal investigator; PI) worden aangeduid. Serious Adverse Event (SAE) of Serious Adverse Drug Reaction (ADR) / Ernstig ongewenst voorval of ernstige bijwerking: Elk ongewenst medisch voorval dat (bij ongeacht welke dosis): - de dood tot gevolg heeft; - levensbedreigend is; - ziekenhuisopname of verlenging van opname noodzakelijk maakt; - tot blijvende of ernstige invaliditeit/arbeidsongeschiktheid leidt. Of andere belangrijke medische voorvallen die niet hierboven worden genoemd maar die de proefpersoon in gevaar kunnen brengen of interventie vereisen om één van bovengenoemde voorvallen te voorkomen. Standard Operating Procedure (SOP): Dit zijn gedetailleerde schriftelijke instructies om uniformiteit te bereiken in de uitvoering van een bepaalde taak. Sponsor/verrichter: Een persoon, bedrijf, instelling of organisatie die de verantwoordelijkheid neemt voor het initiëren, organiseren en/of financieren van een Versiedatum Pagina 2 van 6
3 klinisch onderzoek. In de WMO spreekt men van verrichter als zijnde diegene die opdracht heeft gegeven voor de organisatie en/of uitvoering van een klinisch onderzoek. 3. Verantwoordelijkheden Hieronder worden de verantwoordelijkheden van de verschillende partijen met betrekking tot deze STZ SOP A1 Afsluiting studie benoemd. Investigator is eindverantwoordelijk voor: Informeren van de deelnemende proefpersonen en zorg dragen voor de juiste nazorg in geval van voortijdige beëindiging van de studie; Inlichten van eventuele sponsor, METC, de bevoegde autoriteiten en de raad van bestuur in geval van voortijdige beëindiging door onderzoeker zelf; Informeren van de sponsor en instelling bij voortijdig staken/opschorten van een studie door besluit van de METC; Eindrapportage overleggen bij afsluiten van de studie aan de METC en bevoegde autoriteiten; Archiveren essentiële onderzoeksdocumenten zoals gespecificeerd in de ICH-GCP richtlijn en zoals vereist door de relevante wettelijke regels; Maatregelen treffen om te voorkomen dat documenten onopzettelijk of voortijdig worden vernietigd; Op verzoek van de monitor beschikbaar zijn voor afsluitend bezoek; Informeren van alle bij de studie betrokken afdelingen en raad van bestuur over afsluiting van de studie en aantal geïncludeerde patiënten; Financiële afhandeling. Sponsor / verrichter is eindverantwoordelijk voor: Informeren van de instelling bij voortijdig staken/opschorten van een studie door besluit van de METC; Inlichten van METC, de bevoegde autoriteiten en de instelling in geval van voortijdige beëindiging door sponsor zelf; Archiveren van de essentiële onderzoeksdocumenten zoals gespecificeerd in de ICH-GCP richtlijn en zoals vereist door de relevante wettelijke regels; Archiveren van alle sponsor-specifieke essentiële documenten die behoren tot het onderzoek in overeenstemming met de relevante wettelijke eisen; Correcte en complete afsluiting van een onderzoekscentrum. Monitor is eindverantwoordelijk voor: Afsluitend bezoek aan het onderzoekscentrum; Informeren van de onderzoeker/researchverpleegkundige welke zaken geregeld moeten worden voor een afsluitende visite; Monitoren, aftekenen en verzamelen van alle CRFs; Afhandelen van alle SAE/SUSAR rapportages; Terughalen en/of vernietigen van alle onderzoeksproducten; Controleren of alle documentatie compleet aanwezig is; Indiening van een schriftelijk verslag bij de sponsor na afsluiting van de studie. METC is eindverantwoordelijk voor: Controle op indiening van eindrapportage. Versiedatum Pagina 3 van 6
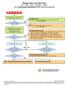
4 4. Stroomdiagram 5.1 Studie gestopt 5.2 Informeer betrokkenen 5.3 Afsluitend bezoek? ja 5.4 regel afsluitend bezoek Plannen van afsluitende visite op initiaf sponsor Nee Voorbereiding afsluitende visite 5.5 Archiveer studie volgens STZ SOP A Afsluitende visite Bespreking afsluitende visite 5. Werkwijze 5.1. Een studie kan vanwege verschillende redenen afgesloten worden. Voor alle gevallen van afronding van de studie, staken van de gehele studie in alle deelnemende centra of staken van de studie alleen in het eigen ziekenhuis geldt onderstaande In alle gevallen van voortijdig stoppen of opschorten van de studie heeft de onderzoeker de verplichting de deelnemende proefpersonen over de beëindiging/opschorting van de studie en de vervolg procedure en/of nazorg te informeren. Ook moet altijd de METC en raad van bestuur op de hoogte gebracht worden. Voortijdig stoppen of opschorten van een studie door de sponsor: Een studie kan voortijdig gestopt of opgeschort worden door de sponsor, dan informeert de onderzoeker of sponsor direct de instelling, de METC (binnen 15 dagen) en de bevoegde autoriteiten met een gedetailleerde schriftelijke verklaring van de beëindiging/opschorting. De sponsor stelt een klinisch onderzoeksrapport/eindrapportage op. De onderzoeker informeert de deelnemende proefpersonen en de raad van bestuur en zorgt voor voldoende nazorg. Versiedatum Pagina 4 van 6
5 Voortijdig stoppen of opschorten van een studie door de onderzoeker: Indien de onderzoeker de studie voortijdig stopt/opschort zonder overleg met de eventuele sponsor moet de onderzoeker naast de proefpersonen en de raad van bestuur ook de eventuele sponsor en de METC direct informeren (binnen 15 dagen). De onderzoeker stelt een eindrapportage op. Voortijdig stoppen of opschorten van een studie door de METC: De METC kan haar positief oordeel wijzigen/opschorten. In dat geval wordt de sponsor/verrichter/investigator door de METC geïnformeerd. Geplande afloop van de studie: Als een studie volgens plan het eind bereikt heeft, dient de onderzoeker hier de raad van bestuur en METC (binnen 56 dagen voor nietgeneesmiddelenonderzoek en binnen 90 dagen voor geneesmiddelenonderzoek) van op de hoogte te brengen met indien beschikbaar het klinisch onderzoeksrapport van de sponsor. De betrokken afdelingen van het ziekenhuis krijgen een bevestiging van het definitief aantal patiënten dat in het ziekenhuis heeft deelgenomen aan de studie. Indien van toepassing zal het definitief aantal patiënten dat heeft deelgenomen aan de studie ook aan de proefpersonenverzekering worden doorgegeven. De investigator zal op basis van die gegevens de financiën definitief afwerken met desbetreffende betrokken afdelingen (of laten afwerken door de financiële afdeling) Ga na of er een afsluitend bezoek zal plaatsvinden. Een extern geïnitieerde studie zal over het algemeen gepaard gaan met een afsluitend bezoek. Zie 5.4. Indien dit bezoek niet gepland wordt dan dient de onderzoeker zelf zorg te dragen voor correcte afhandeling van de studie. D.w.z. alle documenten compleet in de Investigator Site File, betrokkenen informeren zoals beschreven onder verantwoordelijkheden en alle studiedocumentatie bewaren voor tenminste 15 jaar na afloop van de studie. Zie STZ SOP VL4 Investigator Site File en STZ SOP A2 Archiveren studie Een afsluitende visite moet gepland worden door de sponsor, onderzoeker of research verpleegkundige / medewerker Plannen van de afsluitende visite: Monitor neemt op initiatief van de sponsor contact op met PI of functionaris welke binnen delegation of duties is afgesproken (b.v. datamanager/ researchverpleegkundige /apotheker /laborant) om een afsluitende visite te plannen. Monitor geeft aan wat de reden van de visite is, hoeveel tijd er nodig zal zijn en welke gegevens beschikbaar moeten zijn. Monitor bevestigt datum en tijd aan alle betrokkenen Voorbereiden van de afsluitende visite: PI of functionaris aan wie dit gedelegeerd is regelt een rustige ruimte voor de visite en zorgt dat alle benodigdheden aanwezig zijn. De monitor heeft aangegeven wat dit dient te zijn. Meestal zijn dit alle restmaterialen, onderzoeksproduct, labmateriaal en een correct complete investigator file. Documenten die nog missen moeten voor de visite opgezocht worden Afsluitende visite: Gedurende de afsluitende visite wordt de agenda besproken en eventuele documenten ondertekend. Alle restmaterialen worden met de monitor meegegeven en er wordt bewijs achtergelaten welke spullen zijn meegenomen door de monitor : Bespreking afsluitende visite: Aan het einde van de visite worden de laatste bevindingen besproken met de direct betrokkenen en worden eventuele correcties direct doorgevoerd. 5.5 Na bezoek van de monitor en ontvangst van de relevante te archiveren documenten (CD met ecrf en ontvangstbevestiging hiervan, klinisch studie rapport en eventuele follow-up brief van de close-out visite kan de studie gearchiveerd worden. Zie STZ SOP A2 Archiveren studie. Versiedatum Pagina 5 van 6
6 6. Archivering De volgende documenten dienen gearchiveerd te worden in de Investigator site file (zie STZ SOP VL4 Investigator Site File ): rapport van de afsluitende visite of follow-up brief van de close-out visite 7. Referenties Richtsnoer voor Good Clinical Practice (CPMP/ICH/135/95), officiële Nederlandse vertaling Wet Medisch-wetenschappelijk Onderzoek met mensen STZ SOP VL4: Investigator Site File STZ SOP A2: Archiveren studie 8. Literatuur Richtsnoer voor Good Clinical Practice (CPMP/ICH/135/95), officiële Nederlandse vertaling Website van CCMO ( 9. Bijlage(n) N.v.t. 10. MGG specifieke procedure De MGG onderzoeker dient de Raad van Bestuur te informeren over de afsluiting van de studie, het aantal geïncludeerde patiënten en de financiële afhandeling. Dit gebeurt via het Wetenschapsbureau. De voortgang kan ingevuld worden via het onderzoeksbeheersysteem Panama. Inloggegevens en instructie is aan te vragen bij het Wetenschapsbureau. Indien de METC of de RvB vragen heeft met betrekking tot de rapportage worden deze naar de onderzoeker gestuurd. De verrichter en/of onderzoeker dienen de vragen de beantwoorden. Als er geen vragen zijn of de vragen zijn afdoende beantwoord dan krijgt de onderzoeker en/of verrichter een ontvangstbevestiging van de rapportage. Indien er geen afsluitende visite gepland is door de verrichter of monitor, maar wel wenselijk geacht door de onderzoeker moet een afspraak gemaakt worden door de onderzoeker of researchverpleegkundige. Versiedatum Pagina 6 van 6
Standard Operating Procedure
 Standard Operating Procedure STZ SOP: U11 Voortgangsrapportage Distributielijst : STZ Datum : 19-06-2014 Revisiedatum : 19-06-2015 Veranderingen ten opzichte van eerdere versies Versiedatum Opmerkingen
Standard Operating Procedure STZ SOP: U11 Voortgangsrapportage Distributielijst : STZ Datum : 19-06-2014 Revisiedatum : 19-06-2015 Veranderingen ten opzichte van eerdere versies Versiedatum Opmerkingen
Standard Operating Procedure
 Standard Operating Procedure STZ SOP: U9 Monitoren Distributielijst : STZ Datum : 15-10-2012 Revisiedatum : 15-10-2013 Veranderingen ten opzichte van eerdere versies Versiedatum Hoofdstuk Versiedatum Hoofdstuk
Standard Operating Procedure STZ SOP: U9 Monitoren Distributielijst : STZ Datum : 15-10-2012 Revisiedatum : 15-10-2013 Veranderingen ten opzichte van eerdere versies Versiedatum Hoofdstuk Versiedatum Hoofdstuk
Standard Operating Procedure
 Standard Operating Procedure STZ SOP: VL5 Protocolamendement (lokaal) Distributielijst : STZ Datum : 03-06-2014 Revisiedatum : 03-06-2015 Veranderingen ten opzichte van eerdere versies Versiedatum Opmerkingen
Standard Operating Procedure STZ SOP: VL5 Protocolamendement (lokaal) Distributielijst : STZ Datum : 03-06-2014 Revisiedatum : 03-06-2015 Veranderingen ten opzichte van eerdere versies Versiedatum Opmerkingen
Standard Operating Procedure
 Standard Operating Procedure STZ SOP: VC8 Beoordeling amendement toetsende commissie (centraal) Distributielijst : STZ Datum : 10-03-2014 Revisiedatum : 10-03-2015 Veranderingen ten opzichte van eerdere
Standard Operating Procedure STZ SOP: VC8 Beoordeling amendement toetsende commissie (centraal) Distributielijst : STZ Datum : 10-03-2014 Revisiedatum : 10-03-2015 Veranderingen ten opzichte van eerdere
Standard Operating Procedure
 Standard Operating Procedure STZ SOP: U10 Audit Distributielijst : STZ Datum : 19-06-2014 Revisiedatum : 19-06-2015 Veranderingen ten opzichte van eerdere versies Versiedatum Opmerkingen Versiedatum Opmerkingen
Standard Operating Procedure STZ SOP: U10 Audit Distributielijst : STZ Datum : 19-06-2014 Revisiedatum : 19-06-2015 Veranderingen ten opzichte van eerdere versies Versiedatum Opmerkingen Versiedatum Opmerkingen
Standard Operating Procedure
 Standard Operating Procedure STZ SOP: VL2 Aanpassen proefpersoneninformatie / toestemmingsformulier aan lokale situatie Distributielijst : STZ Datum : 20-03-2014 Revisiedatum : 20-03-2015 Veranderingen
Standard Operating Procedure STZ SOP: VL2 Aanpassen proefpersoneninformatie / toestemmingsformulier aan lokale situatie Distributielijst : STZ Datum : 20-03-2014 Revisiedatum : 20-03-2015 Veranderingen
Standard Operating Procedure
 Standard Operating Procedure STZ SOP: VC9 Proefpersonen- en aansprakelijkheidsverzekering (centraal) Distributielijst : STZ Datum : 10-03-2014 Revisiedatum : 10-03-2015 Veranderingen ten opzichte van eerdere
Standard Operating Procedure STZ SOP: VC9 Proefpersonen- en aansprakelijkheidsverzekering (centraal) Distributielijst : STZ Datum : 10-03-2014 Revisiedatum : 10-03-2015 Veranderingen ten opzichte van eerdere
Standard Operating Procedure
 Standard Operating Procedure STZ SOP: A2 Archiveren studie Distributielijst : STZ Datum : 03-06-2014 Revisiedatum : 03-06-2015 Veranderingen ten opzichte van eerdere versies Versiedatum Opmerkingen Versiedatum
Standard Operating Procedure STZ SOP: A2 Archiveren studie Distributielijst : STZ Datum : 03-06-2014 Revisiedatum : 03-06-2015 Veranderingen ten opzichte van eerdere versies Versiedatum Opmerkingen Versiedatum
Standard Operating Procedure
 Standard Operating Procedure SOP: V9 Initiatievisite Auteur Naam: Functie instelling/afdeling Judie van den Elshout Staffunctionaris Wetenschapsbureau Wetenschapsbureau / Cluster Leerhuis Handtekening:...
Standard Operating Procedure SOP: V9 Initiatievisite Auteur Naam: Functie instelling/afdeling Judie van den Elshout Staffunctionaris Wetenschapsbureau Wetenschapsbureau / Cluster Leerhuis Handtekening:...
Standard Operating Procedure
 Standard Operating Procedure STZ SOP: O3 Ontwikkelen, implementeren en beheren van SOP s Distributielijst : STZ Datum : 15-10-2012 Revisiedatum : 15-10-2013 Veranderingen ten opzichte van eerdere versies
Standard Operating Procedure STZ SOP: O3 Ontwikkelen, implementeren en beheren van SOP s Distributielijst : STZ Datum : 15-10-2012 Revisiedatum : 15-10-2013 Veranderingen ten opzichte van eerdere versies
Standard Operating Procedure
 Standard Operating Procedure STZ SOP: U1 Identificatie, werving en pre-screening proefpersonen Distributielijst : STZ Datum : 19-06-2014 Revisiedatum : 19-06-2015 Veranderingen ten opzichte van eerdere
Standard Operating Procedure STZ SOP: U1 Identificatie, werving en pre-screening proefpersonen Distributielijst : STZ Datum : 19-06-2014 Revisiedatum : 19-06-2015 Veranderingen ten opzichte van eerdere
Standard Operating Procedure
 Standard Operating Procedure STZ SOP: U4 Registratie /randomisatie procedure Distributielijst : STZ Datum : 19-06-2014 Revisiedatum : 19-06-2015 Veranderingen ten opzichte van eerdere versies Versiedatum
Standard Operating Procedure STZ SOP: U4 Registratie /randomisatie procedure Distributielijst : STZ Datum : 19-06-2014 Revisiedatum : 19-06-2015 Veranderingen ten opzichte van eerdere versies Versiedatum
Standard Operating Procedure
 Standard Operating Procedure STZ SOP: U8 Melding van (Serious) Adverse Events en SUSARs Distributielijst : STZ Datum : 19-06-2014 Revisiedatum : 19-06-2015 Veranderingen ten opzichte van eerdere versies
Standard Operating Procedure STZ SOP: U8 Melding van (Serious) Adverse Events en SUSARs Distributielijst : STZ Datum : 19-06-2014 Revisiedatum : 19-06-2015 Veranderingen ten opzichte van eerdere versies
Standard Operating Procedure
 Standard Operating Procedure STZ SOP: U5 Datamanagement Distributielijst : STZ Datum : 19-06-2014 Revisiedatum : 19-06-2015 Veranderingen ten opzichte van eerdere versies Versiedatum Opmerkingen Versiedatum
Standard Operating Procedure STZ SOP: U5 Datamanagement Distributielijst : STZ Datum : 19-06-2014 Revisiedatum : 19-06-2015 Veranderingen ten opzichte van eerdere versies Versiedatum Opmerkingen Versiedatum
Standard Operating Procedure
 Standard Operating Procedure STZ SOP: A4 Publicatie Distributielijst : STZ Datum : 20-03-2014 Revisiedatum : 20-03-2015 Veranderingen ten opzichte van eerdere versies Versiedatum Opmerkingen Versiedatum
Standard Operating Procedure STZ SOP: A4 Publicatie Distributielijst : STZ Datum : 20-03-2014 Revisiedatum : 20-03-2015 Veranderingen ten opzichte van eerdere versies Versiedatum Opmerkingen Versiedatum
Standard Operating Procedure
 Standard Operating Procedure STZ SOP: U7 Ondersteunende diensten Distributielijst : STZ Datum : 19-06-2014 Revisiedatum : 19-06-2015 Veranderingen ten opzichte van eerdere versies Versiedatum Opmerkingen
Standard Operating Procedure STZ SOP: U7 Ondersteunende diensten Distributielijst : STZ Datum : 19-06-2014 Revisiedatum : 19-06-2015 Veranderingen ten opzichte van eerdere versies Versiedatum Opmerkingen
Standard Operating Procedure
 Standard Operating Procedure STZ SOP: VL4 Investigator Site File Distributielijst : STZ Datum : 03-06-2014 Revisiedatum : 03-06-2015 Veranderingen ten opzichte van eerdere versies Versiedatum Opmerkingen
Standard Operating Procedure STZ SOP: VL4 Investigator Site File Distributielijst : STZ Datum : 03-06-2014 Revisiedatum : 03-06-2015 Veranderingen ten opzichte van eerdere versies Versiedatum Opmerkingen
Standard Operating Procedure
 Standard Operating Procedure STZ SOP: U6 Studie medicatie Distributielijst : STZ Datum : 19-06-2014 Revisiedatum : 19-06-2015 Veranderingen ten opzichte van eerdere versies Versiedatum Opmerkingen Versiedatum
Standard Operating Procedure STZ SOP: U6 Studie medicatie Distributielijst : STZ Datum : 19-06-2014 Revisiedatum : 19-06-2015 Veranderingen ten opzichte van eerdere versies Versiedatum Opmerkingen Versiedatum
Standard Operating Procedure
 Standard Operating Procedure STZ SOP: U2 Informed consent Distributielijst : STZ Datum : 19-06-2014 Revisiedatum : 19-06-2015 Veranderingen ten opzichte van eerdere versies Versiedatum Opmerkingen Versiedatum
Standard Operating Procedure STZ SOP: U2 Informed consent Distributielijst : STZ Datum : 19-06-2014 Revisiedatum : 19-06-2015 Veranderingen ten opzichte van eerdere versies Versiedatum Opmerkingen Versiedatum
Aanmelden medischwetenschappelijk
 Aanmelden medischwetenschappelijk onderzoek SOP Aanmelden WMO-plichtig onderzoek_versie juli 2016.doc Pagina 1 van 10 Aanmelden WMO-plichtig onderzoek 1. Doel Het beschrijven van de procedure die gevolgd
Aanmelden medischwetenschappelijk onderzoek SOP Aanmelden WMO-plichtig onderzoek_versie juli 2016.doc Pagina 1 van 10 Aanmelden WMO-plichtig onderzoek 1. Doel Het beschrijven van de procedure die gevolgd
Aanmelden WMO-plichtig onderzoek
 Aanmelden WMO-plichtig onderzoek 1. Doel Het beschrijven van de procedure die gevolgd wordt bij het aanmelden van onderzoek dat onder de WMO valt en waarbij ZGV optreedt als deelnemend centrum. Voordat
Aanmelden WMO-plichtig onderzoek 1. Doel Het beschrijven van de procedure die gevolgd wordt bij het aanmelden van onderzoek dat onder de WMO valt en waarbij ZGV optreedt als deelnemend centrum. Voordat
IC ICF ICH ISF. Lijst met afkortingen, definities en termen STZ-Kwaliteitshandboek SOP s
 Lijst met afkortingen, definities en termen STZ-Kwaliteitshandboek SOP s ABR ADR AE AR BROK CCMO CRF CTA CV DSMB EMEA EU EudraCT FU brief GCP GMP IB IC ICF ICH IMPD ISF MEB METC EU RCT SAE SOP SPC SUSAR
Lijst met afkortingen, definities en termen STZ-Kwaliteitshandboek SOP s ABR ADR AE AR BROK CCMO CRF CTA CV DSMB EMEA EU EudraCT FU brief GCP GMP IB IC ICF ICH IMPD ISF MEB METC EU RCT SAE SOP SPC SUSAR
Veel gestelde vragen Melden voorvallen/bijwerkingen bij geneesmiddelenonderzoek
 Veel gestelde vragen Melden voorvallen/bijwerkingen bij geneesmiddelenonderzoek Wat is een SUSAR? SUSAR is de afkorting van Suspected Unexpected Serious Adverse Reaction. In het Nederlands betekent dit
Veel gestelde vragen Melden voorvallen/bijwerkingen bij geneesmiddelenonderzoek Wat is een SUSAR? SUSAR is de afkorting van Suspected Unexpected Serious Adverse Reaction. In het Nederlands betekent dit
Titel: Good Clinical Practice & Monitoring. Initiation Investigator Driven Studies. Versie: 14-jan-2013
 Titel: Good Clinical Practice & Monitoring Initiation Investigator Driven Studies Inhoud Wet- en regelgeving/declaration of Helsinki Good Clinical Practice Patiënteninformatie/ informed consent Basisvereisten
Titel: Good Clinical Practice & Monitoring Initiation Investigator Driven Studies Inhoud Wet- en regelgeving/declaration of Helsinki Good Clinical Practice Patiënteninformatie/ informed consent Basisvereisten
Toezicht op klinisch onderzoek: bevindingen uit inspecties bij GGZ instellingen
 Toezicht op klinisch onderzoek: bevindingen uit inspecties bij GGZ instellingen Afdeling Farmaceutische Bedrijven, Klinisch Onderzoek Good Clinical Practice Inhoud Wat doet de IGJ aan toezicht op klinisch
Toezicht op klinisch onderzoek: bevindingen uit inspecties bij GGZ instellingen Afdeling Farmaceutische Bedrijven, Klinisch Onderzoek Good Clinical Practice Inhoud Wat doet de IGJ aan toezicht op klinisch
1. Voorafgaand aan de klinische fase van het onderzoek
 Essentiële documenten Bron: Richtsnoer voor good clinical practice (CPMP/ICH/135/95) De verwijzingen in dit document verwijzen naar de artikelen in bovenstaand document. 1. Voorafgaand aan de klinische
Essentiële documenten Bron: Richtsnoer voor good clinical practice (CPMP/ICH/135/95) De verwijzingen in dit document verwijzen naar de artikelen in bovenstaand document. 1. Voorafgaand aan de klinische
Monitorplan voorbeeld
 Monitorplan voorbeeld Protocol Er moet in het protocol beschreven worden dat er monitoring plaatsvindt (zie ook CCMO voorbeeld template). Het monitoringplan mag als bijlage worden toegevoegd (in dat geval
Monitorplan voorbeeld Protocol Er moet in het protocol beschreven worden dat er monitoring plaatsvindt (zie ook CCMO voorbeeld template). Het monitoringplan mag als bijlage worden toegevoegd (in dat geval
29 juni Initiatie bijeenkomst PORTEC 4. Kwaliteitsborging WMO GCP richtsnoer. Frank van Leeuwen IKNL
 29 juni 2012 Initiatie bijeenkomst PORTEC 4 Kwaliteitsborging WMO GCP richtsnoer Frank van Leeuwen IKNL Wet en regelgeving Verklaring van Helsinki Richtsnoer voor Good Clinical Practice (CPMP/ICH/135/95)
29 juni 2012 Initiatie bijeenkomst PORTEC 4 Kwaliteitsborging WMO GCP richtsnoer Frank van Leeuwen IKNL Wet en regelgeving Verklaring van Helsinki Richtsnoer voor Good Clinical Practice (CPMP/ICH/135/95)
Standard Operating Procedure
 Standard Operating Procedure STZ SOP: VC2 Ontwikkelen proefpersoneninformatie / toestemmingsformulier (centraal) Distributielijst : STZ Datum : 18-02-2014 Revisiedatum : 18-02-2015 Veranderingen ten opzichte
Standard Operating Procedure STZ SOP: VC2 Ontwikkelen proefpersoneninformatie / toestemmingsformulier (centraal) Distributielijst : STZ Datum : 18-02-2014 Revisiedatum : 18-02-2015 Veranderingen ten opzichte
Ongewenste voorvallen flow AE SAE SAR SUSAR SADE voor onderzoeker geïnitieerd WMO-plichtig onderzoek
 Ongewenste voorvallen flow AE SAE SAR SUSAR SADE voor onderzoeker geïnitieerd WMO-plichtig onderzoek Melding voorval proefpersoon aan onderzoeker/arts 1 Rapportage voorval door onderzoeker/arts in patiëntenstatus
Ongewenste voorvallen flow AE SAE SAR SUSAR SADE voor onderzoeker geïnitieerd WMO-plichtig onderzoek Melding voorval proefpersoon aan onderzoeker/arts 1 Rapportage voorval door onderzoeker/arts in patiëntenstatus
Site selectie visite checklist
 Site selectie visite checklist Informatie sponsor: Naam sponsor: Contactpersoon: Functie: Afdeling: Telefoonnummer : Email : Informatie onderzoekslocatie: Naam onderzoekslocatie : Naam onderzoeker: Functie:
Site selectie visite checklist Informatie sponsor: Naam sponsor: Contactpersoon: Functie: Afdeling: Telefoonnummer : Email : Informatie onderzoekslocatie: Naam onderzoekslocatie : Naam onderzoeker: Functie:
Toezicht op klinisch onderzoek bij STZ-ziekenhuizen. Farmaceutische Bedrijven Deelteam Klinisch Onderzoek
 Toezicht op klinisch onderzoek bij STZ-ziekenhuizen Farmaceutische Bedrijven Deelteam Klinisch Onderzoek Toezicht op klinisch onderzoek bij STZ-ziekenhuizen Bevindingen vanuit de praktijk Conclusies en
Toezicht op klinisch onderzoek bij STZ-ziekenhuizen Farmaceutische Bedrijven Deelteam Klinisch Onderzoek Toezicht op klinisch onderzoek bij STZ-ziekenhuizen Bevindingen vanuit de praktijk Conclusies en
SOP aanleveren en afhandelen WMO onderzoek METC Onze Lieve Vrouwe Gasthuis, versie 1, juli
 Aanmelden en afhandelen medisch-wetenschappelijk onderzoek met mensen (WMO-onderzoek) Medisch-ethische toetsingscommissie (METC) Onze Lieve Vrouwe Gasthuis Hieronder treft u aan de procedure van aanmelding
Aanmelden en afhandelen medisch-wetenschappelijk onderzoek met mensen (WMO-onderzoek) Medisch-ethische toetsingscommissie (METC) Onze Lieve Vrouwe Gasthuis Hieronder treft u aan de procedure van aanmelding
Aanvraagformulier REGISTRATIE oncologie monitor
 Aanvraagformulier REGISTRATIE oncologie monitor 1. Gegevens aanvrager Naam + Voorletters:... Adres:... Postcode + Woonplaats:.... Geboortedatum:... Geboorteplaats:... Werkzaam bij: Organisatie + Afdeling:...
Aanvraagformulier REGISTRATIE oncologie monitor 1. Gegevens aanvrager Naam + Voorletters:... Adres:... Postcode + Woonplaats:.... Geboortedatum:... Geboorteplaats:... Werkzaam bij: Organisatie + Afdeling:...
Antwoorden CRO-vragenlijst - foto van het veld
 Antwoorden CRO-vragenlijst - foto van het veld In samenwerking met het RIVM heeft de Inspectie voor de Gezondheidszorg (IGZ) een digitale vragenlijst ontwikkeld die bestond uit drie delen (zie Vragenlijst
Antwoorden CRO-vragenlijst - foto van het veld In samenwerking met het RIVM heeft de Inspectie voor de Gezondheidszorg (IGZ) een digitale vragenlijst ontwikkeld die bestond uit drie delen (zie Vragenlijst
De rol van de verpleegkundige binnen Medischwetenschappelijk
 De rol van de verpleegkundige binnen Medischwetenschappelijk onderzoek Moderator Mevr. R.C.A. Veldhoen-Tijben 1st author / speaker Miriam Gelderloos Co-author Erna Helmantel Belangenverklaring In overeenstemming
De rol van de verpleegkundige binnen Medischwetenschappelijk onderzoek Moderator Mevr. R.C.A. Veldhoen-Tijben 1st author / speaker Miriam Gelderloos Co-author Erna Helmantel Belangenverklaring In overeenstemming
Ervaringen met document X
 Martini Ziekenhuis Groningen Ervaringen met document X Ellen Rusch, wetenschappelijk medewerker Wetenschappelijk Instituut Wat gaan we doen? Structuur lokale haalbaarheid Martini Ziekenhuis Het werken
Martini Ziekenhuis Groningen Ervaringen met document X Ellen Rusch, wetenschappelijk medewerker Wetenschappelijk Instituut Wat gaan we doen? Structuur lokale haalbaarheid Martini Ziekenhuis Het werken
INCLUSIE SET PLAATS HIER DE PATIENTSTICKER VAN DE GEINCLUDEERDE PATIENT. ULTRA STUDIE INCLUSIE SET VERSIE 9 Pagina 1 van 9
 INCLUSIE SET Als de patiënt geïncludeerd kan worden in de studie, voert de arts in het behandelcentrum de randomisatieprocedure uit na telefonische aanmelding van de patiënt(e) PLAATS HIER DE PATIENTSTICKER
INCLUSIE SET Als de patiënt geïncludeerd kan worden in de studie, voert de arts in het behandelcentrum de randomisatieprocedure uit na telefonische aanmelding van de patiënt(e) PLAATS HIER DE PATIENTSTICKER
De rol van de Contract Research Organisatie (CRO) Klinisch onderzoek
 De rol van de Contract Research Organisatie (CRO) in klinisch geneesmiddelenonderzoek Klinisch onderzoek Inhoud Aanleiding CRO project Methode en resultaten» Werkwijze en resultaten foto van het veld vragenlijst»
De rol van de Contract Research Organisatie (CRO) in klinisch geneesmiddelenonderzoek Klinisch onderzoek Inhoud Aanleiding CRO project Methode en resultaten» Werkwijze en resultaten foto van het veld vragenlijst»
Monitoring van Investigator Initiated onderzoek
 Monitoring van Investigator Initiated onderzoek V1.0 Angela Vlug Clinical Research Bureau VUmc Wat is een IIS (volgens de NFU) Onderzoek waarvoor de raad van bestuur van een (universitair) medisch centrum
Monitoring van Investigator Initiated onderzoek V1.0 Angela Vlug Clinical Research Bureau VUmc Wat is een IIS (volgens de NFU) Onderzoek waarvoor de raad van bestuur van een (universitair) medisch centrum
Jouw GCP up-to-date in 45 minuten. Marieke Meulemans, oprichter GCP Central
 Jouw GCP up-to-date in 45 minuten Marieke Meulemans, oprichter GCP Central Waarom een GCP update tijdens de CRA dag? Gedreven Meesterschap. Meesterschap is vakmanschap. Vakmanschap is beheersing van het
Jouw GCP up-to-date in 45 minuten Marieke Meulemans, oprichter GCP Central Waarom een GCP update tijdens de CRA dag? Gedreven Meesterschap. Meesterschap is vakmanschap. Vakmanschap is beheersing van het
Werkinstructies adverse events rapportage STOP-BPD studie
 Werkinstructies adverse events rapportage STOP-BPD studie De STOP-BPD studie wordt uitgevoerd bij extreem prematuur geboren kinderen die los van deelname aan de studie een continu verhoogd risico hebben
Werkinstructies adverse events rapportage STOP-BPD studie De STOP-BPD studie wordt uitgevoerd bij extreem prematuur geboren kinderen die los van deelname aan de studie een continu verhoogd risico hebben
Formulier Voortgangsrapportage
 Formulier Voortgangsrapportage De METC azm/um wil van al het door haar beoordeelde WMO-onderzoek jaarlijks een voortgangsrapportage zien. Zij heeft deze eis daartoe opgenomen in de tekst van haar eigen
Formulier Voortgangsrapportage De METC azm/um wil van al het door haar beoordeelde WMO-onderzoek jaarlijks een voortgangsrapportage zien. Zij heeft deze eis daartoe opgenomen in de tekst van haar eigen
1. Inloggen. 1.1 Eerste keer inloggen
 . Inloggen LET OP: Deze handleiding beschrijft data invoer voor de RACOST studie in de studie-database. Deze database is niet geschikt voor testdoeleinden. Als u de handelingen uit deze handleiding wilt
. Inloggen LET OP: Deze handleiding beschrijft data invoer voor de RACOST studie in de studie-database. Deze database is niet geschikt voor testdoeleinden. Als u de handelingen uit deze handleiding wilt
SEMINAR 4 NOVEMBER 2014
 SEMINAR 4 NOVEMBER 2014 Professioneel opzetten en uitvoeren van klinisch onderzoek www.deresearchmanager.nl Striksteeg 7 7411 KR Deventer 0570 594 789 info@deresearchmanager.nl Ontwikkeling Afdeling Innovatie
SEMINAR 4 NOVEMBER 2014 Professioneel opzetten en uitvoeren van klinisch onderzoek www.deresearchmanager.nl Striksteeg 7 7411 KR Deventer 0570 594 789 info@deresearchmanager.nl Ontwikkeling Afdeling Innovatie
Vragen en antwoorden over de gegevenssectie van de model-pif
 Vragen en antwoorden over de gegevenssectie van de model-pif Algemene informatie over de Algemene Verordening Gegevensbescherming Waar vind ik algemene informatie over de gevolgen van de Algemene Verordening
Vragen en antwoorden over de gegevenssectie van de model-pif Algemene informatie over de Algemene Verordening Gegevensbescherming Waar vind ik algemene informatie over de gevolgen van de Algemene Verordening
INFORMATIEBLAD. Maart 2011
 INFORMATIEBLAD AANMELDING TRIALBUREAU/DATACENTRUM Maart 2011 Kanker zo snel mogelijk terugdringen en onder controle brengen. We zijn er voor mensen die leven met kanker en de mensen die met hen samenleven.
INFORMATIEBLAD AANMELDING TRIALBUREAU/DATACENTRUM Maart 2011 Kanker zo snel mogelijk terugdringen en onder controle brengen. We zijn er voor mensen die leven met kanker en de mensen die met hen samenleven.
Op naar het snel opstarten van klinisch onderzoek in Nederland!
 Op naar het snel opstarten van klinisch onderzoek in Nederland! Marika Trieling Voorzitter DCRF werkgroep Lokale uitvoerbaarheid 12 februari 2019 Wat is er in Nederland nodig? Verkorten tijdslijnen van
Op naar het snel opstarten van klinisch onderzoek in Nederland! Marika Trieling Voorzitter DCRF werkgroep Lokale uitvoerbaarheid 12 februari 2019 Wat is er in Nederland nodig? Verkorten tijdslijnen van
Monitoren vs auditen. CRA dag 21 april 2016
 Monitoren vs auditen CRA dag 21 april 2016 Introductie Freelance consultant, mede oprichter TAPAS Group B.V. Mede oprichter/directeur van CRA B.V. Medical Adviser Yamanouchi Pharma Clinical trial monitor
Monitoren vs auditen CRA dag 21 april 2016 Introductie Freelance consultant, mede oprichter TAPAS Group B.V. Mede oprichter/directeur van CRA B.V. Medical Adviser Yamanouchi Pharma Clinical trial monitor
Toezicht op onderzoeker geïnitieerd klinisch onderzoek (IIT) Team Klinisch Onderzoek
 Toezicht op onderzoeker geïnitieerd klinisch onderzoek (IIT) 2014-2016 Team Klinisch Onderzoek Toezicht op IIT 2014-2016 Aanleiding en werkwijze Bevindingen vanuit de praktijk Conclusies en aandachtspunten
Toezicht op onderzoeker geïnitieerd klinisch onderzoek (IIT) 2014-2016 Team Klinisch Onderzoek Toezicht op IIT 2014-2016 Aanleiding en werkwijze Bevindingen vanuit de praktijk Conclusies en aandachtspunten
Praktisch: Wetenschappelijk onderzoek in het Elisabeth-TweeSteden Ziekenhuis. Procedure niet-wmo-plichtig klinisch wetenschappelijk onderzoek
 Wetenschappelijk onderzoek in het Elisabeth-TweeSteden Ziekenhuis Procedure niet-wmo-plichtig klinisch wetenschappelijk onderzoek Deze procedure geldt voor niet-wmo-plichtig onderzoek dat of: a) enkel
Wetenschappelijk onderzoek in het Elisabeth-TweeSteden Ziekenhuis Procedure niet-wmo-plichtig klinisch wetenschappelijk onderzoek Deze procedure geldt voor niet-wmo-plichtig onderzoek dat of: a) enkel
5. Goedkeuring deelname door de toetsende METC 6. Start- en einddatum onderzoek 7. Rekening
 Aanleveren documenten voor het uitbrengen van advies over lokale uitvoerbaarheid bij de Medisch-ethische toetsingscommissie (METC) in het Onze Lieve Vrouwe Gasthuis Mocht u nog vragen hebben naar aanleiding
Aanleveren documenten voor het uitbrengen van advies over lokale uitvoerbaarheid bij de Medisch-ethische toetsingscommissie (METC) in het Onze Lieve Vrouwe Gasthuis Mocht u nog vragen hebben naar aanleiding
Kwaliteitsborging onderzoek in het. NVMETC bijeenkomst 23 november UMC Utrecht. Oktober 2016
 1 Kwaliteitsborging onderzoek in het UMC Utrecht NVMETC bijeenkomst 23 november 2016 Eugenie Ram, kwaliteitsmanager Onderzoek - Office Concernstaf Raad van Bestuur Oktober 2016 UMC Utrecht breed kwaliteitssysteem
1 Kwaliteitsborging onderzoek in het UMC Utrecht NVMETC bijeenkomst 23 november 2016 Eugenie Ram, kwaliteitsmanager Onderzoek - Office Concernstaf Raad van Bestuur Oktober 2016 UMC Utrecht breed kwaliteitssysteem
Procedure multicenter WMO-plichtig klinisch wetenschappelijk onderzoek geïnitieerd vanuit het Elisabeth-TweeSteden Ziekenhuis
 Wetenschappelijk onderzoek in het Elisabeth-TweeSteden Ziekenhuis Procedure multicenter WMO-plichtig klinisch wetenschappelijk onderzoek geïnitieerd vanuit het Elisabeth-TweeSteden Ziekenhuis Bij dit type
Wetenschappelijk onderzoek in het Elisabeth-TweeSteden Ziekenhuis Procedure multicenter WMO-plichtig klinisch wetenschappelijk onderzoek geïnitieerd vanuit het Elisabeth-TweeSteden Ziekenhuis Bij dit type
Procedure deelnemend aan multicenter WMO-plichtig klinisch wetenschappelijk onderzoek
 Wetenschappelijk onderzoek in het Elisabeth-TweeSteden Ziekenhuis Procedure deelnemend aan multicenter WMO-plichtig klinisch wetenschappelijk onderzoek Bij dit type onderzoek neemt de onderzoeker van het
Wetenschappelijk onderzoek in het Elisabeth-TweeSteden Ziekenhuis Procedure deelnemend aan multicenter WMO-plichtig klinisch wetenschappelijk onderzoek Bij dit type onderzoek neemt de onderzoeker van het
Standard Operating Procedure
 Standard Operating Procedure SOP: V1 Ontwikkelen Onderzoeksprotocol Auteur Naam: Functie instelling/afdeling Judie van den Elshout Staffunctionaris Wetenschapsbureau Wetenschapsbureau / Cluster Leerhuis
Standard Operating Procedure SOP: V1 Ontwikkelen Onderzoeksprotocol Auteur Naam: Functie instelling/afdeling Judie van den Elshout Staffunctionaris Wetenschapsbureau Wetenschapsbureau / Cluster Leerhuis
Concept procedure Lokale Haalbaarheid
 -------------------------------------------------------------------------------------------------------------------------------------------- Opzet pilot Stap 2 Lokale Haalbaarheid ter voorbereiding op
-------------------------------------------------------------------------------------------------------------------------------------------- Opzet pilot Stap 2 Lokale Haalbaarheid ter voorbereiding op
Procedure aanvraag voor het verrichten van wetenschappelijk onderzoek in Meander Medisch Centrum
 Procedure aanvraag voor het verrichten van wetenschappelijk onderzoek in Meander Medisch Centrum Commissie Toetsing Wetenschappelijk Onderzoek (TWO) I II Algemeen 1. Alvorens onderzoek in Meander MC van
Procedure aanvraag voor het verrichten van wetenschappelijk onderzoek in Meander Medisch Centrum Commissie Toetsing Wetenschappelijk Onderzoek (TWO) I II Algemeen 1. Alvorens onderzoek in Meander MC van
KWALITEITSHANDBOEK WETENSCHAPSBELEID KENNEMER GASTHUIS EN SPAARNE ZIEKENHUIS. Organisatie en richtlijnen medisch-wetenschappelijk onderzoek
 KWALITEITSHANDBOEK WETENSCHAPSBELEID KENNEMER GASTHUIS EN SPAARNE ZIEKENHUIS Organisatie en richtlijnen medisch-wetenschappelijk onderzoek april 2014 Inhoudsopgave 1. INLEIDING 1.1. Organisatie wetenschap
KWALITEITSHANDBOEK WETENSCHAPSBELEID KENNEMER GASTHUIS EN SPAARNE ZIEKENHUIS Organisatie en richtlijnen medisch-wetenschappelijk onderzoek april 2014 Inhoudsopgave 1. INLEIDING 1.1. Organisatie wetenschap
Handleiding Goedkeuringsprocedure Raad van Bestuur Zuyderland wetenschappelijk onderzoek
 Handleiding Goedkeuringsprocedure Raad van Bestuur Zuyderland wetenschappelijk onderzoek INLEIDING oor al het onderzoek dat binnen Zuyderland wordt uitgevoerd moet goedkeuring worden verkregen van de Raad
Handleiding Goedkeuringsprocedure Raad van Bestuur Zuyderland wetenschappelijk onderzoek INLEIDING oor al het onderzoek dat binnen Zuyderland wordt uitgevoerd moet goedkeuring worden verkregen van de Raad
Veel gestelde vragen Medisch-wetenschappelijk onderzoek met medische hulpmiddelen 1
 Veel gestelde vragen Medisch-wetenschappelijk onderzoek met medische hulpmiddelen 1 1. Wat is een medisch hulpmiddel? De wettelijke definitie 2 van een medisch hulpmiddel luidt: Een medisch hulpmiddel
Veel gestelde vragen Medisch-wetenschappelijk onderzoek met medische hulpmiddelen 1 1. Wat is een medisch hulpmiddel? De wettelijke definitie 2 van een medisch hulpmiddel luidt: Een medisch hulpmiddel
Informatie inzake de bijlage proefpersonenverzekering bij de proefpersoneninformatie Toelichting voor de onderzoeker
 Versie 08 d.d. 14-02-2014 Informatie inzake de bijlage proefpersonenverzekering bij de proefpersoneninformatie Toelichting voor de onderzoeker Wettelijke verplichtingen Op grond van artikel 9 van het Besluit
Versie 08 d.d. 14-02-2014 Informatie inzake de bijlage proefpersonenverzekering bij de proefpersoneninformatie Toelichting voor de onderzoeker Wettelijke verplichtingen Op grond van artikel 9 van het Besluit
Inhoud onderzoeksdossier
 Inhoud onderzoeksdossier (documenten in de witte box zijn nodig voor de primaire beoordeling) A. Brieven B. Formulieren C. Onderzoeksprotocol en protocolamendementen D. Productinformatie E. Informatie
Inhoud onderzoeksdossier (documenten in de witte box zijn nodig voor de primaire beoordeling) A. Brieven B. Formulieren C. Onderzoeksprotocol en protocolamendementen D. Productinformatie E. Informatie
Toezicht op kwaliteitsborging: ken uw verantwoordelijkheden
 Toezicht op kwaliteitsborging: ken uw verantwoordelijkheden Elysée Hille Karina van Wonderen namens deelteam Klinisch Onderzoek-GCP Afdeling Farmaceutische Bedrijven Workshop Kwaliteitsbewaking door samenwerking
Toezicht op kwaliteitsborging: ken uw verantwoordelijkheden Elysée Hille Karina van Wonderen namens deelteam Klinisch Onderzoek-GCP Afdeling Farmaceutische Bedrijven Workshop Kwaliteitsbewaking door samenwerking
Toezicht op IIT: bevindingen vanuit de praktijk
 Toezicht op IIT: bevindingen vanuit de praktijk Elysée Hille, senior inspecteur namens deelteam KO-GCP Teamcoördinator KO-GCP/PhV/GZH Afdeling Farmaceutische Bedrijven Wat doet de IGZ? Toezicht op klinisch
Toezicht op IIT: bevindingen vanuit de praktijk Elysée Hille, senior inspecteur namens deelteam KO-GCP Teamcoördinator KO-GCP/PhV/GZH Afdeling Farmaceutische Bedrijven Wat doet de IGZ? Toezicht op klinisch
Wetenschappelijk onderzoek in het Elisabeth-TweeSteden Ziekenhuis. Procedure niet-wmo-plichtig klinisch wetenschappelijk onderzoek
 Wetenschappelijk onderzoek in het Elisabeth-TweeSteden Ziekenhuis Procedure niet-wmo-plichtig klinisch wetenschappelijk onderzoek Deze procedure geldt voor niet-wmo-plichtig onderzoek dat of: a) enkel
Wetenschappelijk onderzoek in het Elisabeth-TweeSteden Ziekenhuis Procedure niet-wmo-plichtig klinisch wetenschappelijk onderzoek Deze procedure geldt voor niet-wmo-plichtig onderzoek dat of: a) enkel
SOP: Voorlichtingsgesprek en uitgesteld informed consent CONTRAST trials
 SOP: Voorlichtingsgesprek en uitgesteld informed consent CONTRAST trials SOP: IC1 Versie Nr.: 1.1 Geldig m.i.v.: 03-04-2018 Auteur: S.A. van den Berg, arts-onderzoeker AMC Autorisator: Dr. H.B. van der
SOP: Voorlichtingsgesprek en uitgesteld informed consent CONTRAST trials SOP: IC1 Versie Nr.: 1.1 Geldig m.i.v.: 03-04-2018 Auteur: S.A. van den Berg, arts-onderzoeker AMC Autorisator: Dr. H.B. van der
Standard Operating Procedure
 Standard Operating Procedure STZ SOP: VC1 Ontwikkelen onderzoeksprotocol Distributielijst : STZ Datum : 03-02-2014 Revisiedatum : 03-02-2015 Veranderingen ten opzichte van eerdere versies Versiedatum Opmerkingen
Standard Operating Procedure STZ SOP: VC1 Ontwikkelen onderzoeksprotocol Distributielijst : STZ Datum : 03-02-2014 Revisiedatum : 03-02-2015 Veranderingen ten opzichte van eerdere versies Versiedatum Opmerkingen
WMO-GCP opfriscursus Nederlandse Vereniging voor Oncologie Datamanagers 27 februari 2019
 WMO-GCP opfriscursus Nederlandse Vereniging voor Oncologie Datamanagers 27 februari 2019 Agenda Introductie ICH-GCP R2 AVG Kwaliteitssyteem Informed Consent ISF e-tmf Monitoren SAE rapportage Waarom wetgeving?
WMO-GCP opfriscursus Nederlandse Vereniging voor Oncologie Datamanagers 27 februari 2019 Agenda Introductie ICH-GCP R2 AVG Kwaliteitssyteem Informed Consent ISF e-tmf Monitoren SAE rapportage Waarom wetgeving?
BROK staat voor Basiscursus Regelgeving en Organisatie voor Klinisch onderzoekers.
 VEELGESTELDE VRAGEN OVER DE BROK CURSUS Wat is de BROK cursus? BROK staat voor Basiscursus Regelgeving en Organisatie voor Klinisch onderzoekers. Aan de uitvoering van mensgebonden onderzoek worden door
VEELGESTELDE VRAGEN OVER DE BROK CURSUS Wat is de BROK cursus? BROK staat voor Basiscursus Regelgeving en Organisatie voor Klinisch onderzoekers. Aan de uitvoering van mensgebonden onderzoek worden door
Procedure monocenter WMO-plichtig klinisch wetenschappelijk onderzoek
 Wetenschappelijk onderzoek in het Elisabeth-TweeSteden Ziekenhuis Procedure monocenter WMO-plichtig klinisch wetenschappelijk onderzoek Bij dit type onderzoek vindt het WMO-plichtig onderzoek enkel plaats
Wetenschappelijk onderzoek in het Elisabeth-TweeSteden Ziekenhuis Procedure monocenter WMO-plichtig klinisch wetenschappelijk onderzoek Bij dit type onderzoek vindt het WMO-plichtig onderzoek enkel plaats
Voorzitter, vice-voorzitter en secretaris(sen) van de METC Erasmus MC.
 REGLEMENT MEDISCH ETHISCHE TOETSINGS COMMISSIE ERASMUS MC Inleiding Dit reglement geeft, in aanmerking nemende het bepaalde in artikel 16, lid 2, onder b tot en met d van de WMO, voorschriften betreffende
REGLEMENT MEDISCH ETHISCHE TOETSINGS COMMISSIE ERASMUS MC Inleiding Dit reglement geeft, in aanmerking nemende het bepaalde in artikel 16, lid 2, onder b tot en met d van de WMO, voorschriften betreffende
INHOUDSOPGAVE. Basis Selectie Document METC s van algemene ziekenhuizen en zelfstandige stichtingen in Nederland, en VU medisch centrum in Amsterdam
 Basisselectiedocument voor Medische Ethische Toetsingscommissies (METC s) van algemene ziekenhuizen en zelfstandige stichtingen in Nederland en VU medisch centrum in Amsterdam Periode 1999 - Versie vastgesteld
Basisselectiedocument voor Medische Ethische Toetsingscommissies (METC s) van algemene ziekenhuizen en zelfstandige stichtingen in Nederland en VU medisch centrum in Amsterdam Periode 1999 - Versie vastgesteld
Handleiding Goedkeuringsprocedure Raad van Bestuur Zuyderland voor wetenschappelijk onderzoek
 Handleiding Goedkeuringsprocedure Raad van Bestuur Zuyderland voor wetenschappelijk onderzoek Deze handleiding wordt voortdurend geupdate naar aanleiding van de meest recente wet- en regelgeving en wijzigingen
Handleiding Goedkeuringsprocedure Raad van Bestuur Zuyderland voor wetenschappelijk onderzoek Deze handleiding wordt voortdurend geupdate naar aanleiding van de meest recente wet- en regelgeving en wijzigingen
Kwaliteitsborging vanuit academisch perspectief DCTF jaarcongres 2016
 Kwaliteitsborging vanuit academisch perspectief DCTF jaarcongres 2016 Gemma Voss 5 oktober 2016 Mensgebonden onderzoek (WMO) in Nederland 2015 CCMO-jaarverslag 2015 CCMO-jaarverslag 2015 Mensgebonden onderzoek
Kwaliteitsborging vanuit academisch perspectief DCTF jaarcongres 2016 Gemma Voss 5 oktober 2016 Mensgebonden onderzoek (WMO) in Nederland 2015 CCMO-jaarverslag 2015 CCMO-jaarverslag 2015 Mensgebonden onderzoek
AMC Uitvoeringsrichtlijnen: Goedkeuring medisch-wetenschappelijk onderzoek door de Raad van Bestuur
 AMC Uitvoeringsrichtlijnen: Goedkeuring medisch-wetenschappelijk onderzoek door de Raad van Bestuur en Deelname van personeelsleden en studenten aan medisch-wetenschappelijk onderzoek Versie 1.1 Dit document
AMC Uitvoeringsrichtlijnen: Goedkeuring medisch-wetenschappelijk onderzoek door de Raad van Bestuur en Deelname van personeelsleden en studenten aan medisch-wetenschappelijk onderzoek Versie 1.1 Dit document
ALGEMENE INFORMATIE Versie 1.8
 ALGEMENE INFORMATIE Donders Centre for Cognition In deze folder komen zaken aan de orde die u beslist moet weten alvorens u kunt deelnemen aan een onderzoek in het Donders Centre for Cognition van het
ALGEMENE INFORMATIE Donders Centre for Cognition In deze folder komen zaken aan de orde die u beslist moet weten alvorens u kunt deelnemen aan een onderzoek in het Donders Centre for Cognition van het
Checklist Lokale Uitvoerbaarheid
 Primaire indieningsproces Lokale Uitvoerbaarheid in METC Management, screening door Assistent Secretaris. Hieronder staan de generieke uitgangspunten en is toegelicht hoe de toetsing indiening Lokale Uitvoerbaarheid
Primaire indieningsproces Lokale Uitvoerbaarheid in METC Management, screening door Assistent Secretaris. Hieronder staan de generieke uitgangspunten en is toegelicht hoe de toetsing indiening Lokale Uitvoerbaarheid
Procedure multicenter WMO-plichtig klinisch wetenschappelijk onderzoek geïnitieerd vanuit het Elisabeth-TweeSteden Ziekenhuis
 Wetenschappelijk onderzoek in het Elisabeth-TweeSteden Ziekenhuis Procedure multicenter WMO-plichtig klinisch wetenschappelijk onderzoek geïnitieerd vanuit het Elisabeth-TweeSteden Ziekenhuis Bij dit type
Wetenschappelijk onderzoek in het Elisabeth-TweeSteden Ziekenhuis Procedure multicenter WMO-plichtig klinisch wetenschappelijk onderzoek geïnitieerd vanuit het Elisabeth-TweeSteden Ziekenhuis Bij dit type
 ------------------------------------------------------------------------------------------------------------------------------------------- Concept Procedure Lokale Haalbaarheid klinisch geneesmiddelenonderzoek
------------------------------------------------------------------------------------------------------------------------------------------- Concept Procedure Lokale Haalbaarheid klinisch geneesmiddelenonderzoek
Titel van het onderzoek: Bepaling van Zink en het Ontstekingseiwit PTX3 bij Patiënten met Sikkelcelziekte (ZIP studie)
 INFORMATIEBRIEF EN TOESTEMMINGSFORMULIER VOOR PATIËNTEN Titel van het onderzoek: Bepaling van Zink en het Ontstekingseiwit PTX3 bij Patiënten met Sikkelcelziekte () Geachte heer/mevrouw, Wij vragen u om
INFORMATIEBRIEF EN TOESTEMMINGSFORMULIER VOOR PATIËNTEN Titel van het onderzoek: Bepaling van Zink en het Ontstekingseiwit PTX3 bij Patiënten met Sikkelcelziekte () Geachte heer/mevrouw, Wij vragen u om
De laatste versie van dit document is te downloaden op: www.umcutrecht.nl/metc. Indienen documenten bij de METC UMC Utrecht
 Indienen documenten bij de METC UMC Utrecht Begin hier Bekijk in onderstaande tabel wat u wilt indienen. Kijk daarna welke methode van indiening en welke documenten bij uw indiening horen. Volg bij het
Indienen documenten bij de METC UMC Utrecht Begin hier Bekijk in onderstaande tabel wat u wilt indienen. Kijk daarna welke methode van indiening en welke documenten bij uw indiening horen. Volg bij het
Officiële uitgave van het Koninkrijk der Nederlanden sinds 1814.
 STAATSCOURANT Officiële uitgave van het Koninkrijk der Nederlanden sinds 1814. Nr. 20221 17 juli 2015 Regeling van de Minister van Volksgezondheid, Welzijn en Sport van 9 juli 2015, houdende regels voor
STAATSCOURANT Officiële uitgave van het Koninkrijk der Nederlanden sinds 1814. Nr. 20221 17 juli 2015 Regeling van de Minister van Volksgezondheid, Welzijn en Sport van 9 juli 2015, houdende regels voor
Handleiding Goedkeuringsprocedure Raad van Bestuur Zuyderland voor wetenschappelijk onderzoek - Handleiding voor externe onderzoekers -
 Handleiding Goedkeuringsprocedure Raad van Bestuur Zuyderland voor wetenschappelijk onderzoek - Handleiding voor externe onderzoekers - Deze handleiding wordt voortdurend geupdate naar aanleiding van de
Handleiding Goedkeuringsprocedure Raad van Bestuur Zuyderland voor wetenschappelijk onderzoek - Handleiding voor externe onderzoekers - Deze handleiding wordt voortdurend geupdate naar aanleiding van de
Clinical Trials in Nederland: op weg naar topkwaliteit DCTF Congres 3 oktober 2012 Lunteren. M.P.W. Lamberti, BA Algemeen Directeur
 Clinical Trials in Nederland: op weg naar topkwaliteit DCTF Congres 3 oktober 2012 Lunteren M.P.W. Lamberti, BA Algemeen Directeur Maastricht UMC-Holding MUMC-Holding CTCM BPCM MI Groningen Utrecht Nijmegen
Clinical Trials in Nederland: op weg naar topkwaliteit DCTF Congres 3 oktober 2012 Lunteren M.P.W. Lamberti, BA Algemeen Directeur Maastricht UMC-Holding MUMC-Holding CTCM BPCM MI Groningen Utrecht Nijmegen
Doel Het beschrijven van het opstellen, classificeren en beheren van SOP s en het beschrijven van de verantwoordelijkheden hieromtrent.
 Titel Schrijven en beheren van SOP s Doel Het beschrijven van het opstellen, classificeren en beheren van SOP s en het beschrijven van de verantwoordelijkheden hieromtrent. Begrippen, definities en afkortingen
Titel Schrijven en beheren van SOP s Doel Het beschrijven van het opstellen, classificeren en beheren van SOP s en het beschrijven van de verantwoordelijkheden hieromtrent. Begrippen, definities en afkortingen
Handleiding. Investigational Medicinal Product Dossier (IMPD)
 Handleiding Investigational Medicinal Product Dossier (IMPD) Inhoudsopgave Afkortingen... - 3 - Wat is het IMPD?... - 4 - Beslisschema inhoud IMPD... - 5 - Beschrijving inhoud IMPD... - 6 - Overzicht hoofdstukken
Handleiding Investigational Medicinal Product Dossier (IMPD) Inhoudsopgave Afkortingen... - 3 - Wat is het IMPD?... - 4 - Beslisschema inhoud IMPD... - 5 - Beschrijving inhoud IMPD... - 6 - Overzicht hoofdstukken
Verdiepende sessie Klinisch onderzoek MHM
 Verdiepende sessie Klinisch onderzoek MHM Opbrengsten en actiepunten Woensdag 14 februari 2018 Sufficient clinical evidence Wat is voldoende klinisch bewijs (voor medische hulpmiddelen zonder directe relatie
Verdiepende sessie Klinisch onderzoek MHM Opbrengsten en actiepunten Woensdag 14 februari 2018 Sufficient clinical evidence Wat is voldoende klinisch bewijs (voor medische hulpmiddelen zonder directe relatie
Aanvraagformulier REGISTRATIE oncologie datamanager
 Aanvraagformulier REGISTRATIE oncologie datamanager 1. Gegevens aanvrager Naam + Voorletters:... Adres:... Postcode + Woonplaats:.... Geboortedatum:.... Geboorteplaats:.... Werkzaam bij: Organisatie +
Aanvraagformulier REGISTRATIE oncologie datamanager 1. Gegevens aanvrager Naam + Voorletters:... Adres:... Postcode + Woonplaats:.... Geboortedatum:.... Geboorteplaats:.... Werkzaam bij: Organisatie +
ccmo-richtlijn Externe Toetsing
 Richtlijn van de centrale commissie medisch-wetenschappelijk onderzoek krachtens artikel 24 van de Wet medisch-wetenschappelijk onderzoek met mensen, inzake de toetsingsprocedure multicenter-onderzoek
Richtlijn van de centrale commissie medisch-wetenschappelijk onderzoek krachtens artikel 24 van de Wet medisch-wetenschappelijk onderzoek met mensen, inzake de toetsingsprocedure multicenter-onderzoek
Kwaliteitshandboek wetenschapsbeleid Kennemer Gasthuis en Spaarne Ziekenhuis
 Kwaliteitshandboek wetenschapsbeleid Kennemer Gasthuis en Spaarne Ziekenhuis maart 2011 INLEIDING INHOUD WETENSCHAPSBELEID 1. Inleiding 3 2. Afkortingen en begrippen 4 3. Typen klinisch-wetenschappelijk
Kwaliteitshandboek wetenschapsbeleid Kennemer Gasthuis en Spaarne Ziekenhuis maart 2011 INLEIDING INHOUD WETENSCHAPSBELEID 1. Inleiding 3 2. Afkortingen en begrippen 4 3. Typen klinisch-wetenschappelijk
Checklist en toelichting indienen Lokale Uitvoerbaarheid
 Checklist en toelichting indienen Lokale Uitvoerbaarheid In onderstaande tabel staan de documenten die u moet indienen als u toestemming wilt van de Raad van Bestuur VUmc voor uitvoering van uw onderzoek
Checklist en toelichting indienen Lokale Uitvoerbaarheid In onderstaande tabel staan de documenten die u moet indienen als u toestemming wilt van de Raad van Bestuur VUmc voor uitvoering van uw onderzoek
Aanvraagformulier REGISTRATIE CENTRAAL ONCOLOGIE DATAMANAGER GEGEVENS AANVRAGER
 GEGEVENS AANVRAGER Naam + Voorletters Voorna(a)m(en) Adres Postcode + Woonplaats Geboortedatum Geboorteplaats E-mailadres/telefoon Lidmaatschapsnummer NVvOD geen lid Datum preregistratie CDM Werkervaring
GEGEVENS AANVRAGER Naam + Voorletters Voorna(a)m(en) Adres Postcode + Woonplaats Geboortedatum Geboorteplaats E-mailadres/telefoon Lidmaatschapsnummer NVvOD geen lid Datum preregistratie CDM Werkervaring
STANDARD OPERATING PROCEDURE (SOP) van de MEDISCH ETHISCHE TOETSINGSCOMMISSIE
 STANDARD OPERATING PROCEDURE (SOP) van de MEDISCH ETHISCHE TOETSINGSCOMMISSIE (erkend door Centrale Commissie Mensgebonden Onderzoek) (geaccrediteerd door Nederlandse Vereniging van Medisch-Ethische Toetsingscommissies)
STANDARD OPERATING PROCEDURE (SOP) van de MEDISCH ETHISCHE TOETSINGSCOMMISSIE (erkend door Centrale Commissie Mensgebonden Onderzoek) (geaccrediteerd door Nederlandse Vereniging van Medisch-Ethische Toetsingscommissies)
Checklist en toelichting indienen Lokale Uitvoerbaarheid
 Checklist en toelichting indienen Lokale Uitvoerbaarheid In onderstaande tabel staan de documenten die u moet indienen als u toestemming wilt van de Raad van Bestuur VUmc voor uitvoering van uw onderzoek
Checklist en toelichting indienen Lokale Uitvoerbaarheid In onderstaande tabel staan de documenten die u moet indienen als u toestemming wilt van de Raad van Bestuur VUmc voor uitvoering van uw onderzoek
Reglement Wetenschapscommissie Medisch Centrum Haaglanden
 Reglement Wetenschapscommissie Medisch Centrum Haaglanden 1 Inhoudsopgave 1. Begripsbepalingen 2. Taakopdracht 3. Samenstelling commissie, benoeming en zittingduur 4. Werkwijze en besluitvorming 5. Taken
Reglement Wetenschapscommissie Medisch Centrum Haaglanden 1 Inhoudsopgave 1. Begripsbepalingen 2. Taakopdracht 3. Samenstelling commissie, benoeming en zittingduur 4. Werkwijze en besluitvorming 5. Taken
Tweede Kamer der Staten-Generaal
 Tweede Kamer der Staten-Generaal 2 Vergaderjaar 2012 2013 33 646 Wijziging van de Wet medisch-wetenschappelijk onderzoek met mensen in verband met een uitbreiding van de meldingsplicht van ernstige ongewenste
Tweede Kamer der Staten-Generaal 2 Vergaderjaar 2012 2013 33 646 Wijziging van de Wet medisch-wetenschappelijk onderzoek met mensen in verband met een uitbreiding van de meldingsplicht van ernstige ongewenste
 ------------------------------------------------------------------------------------------------------------------------------------------- Tweede concept van de Procedure Lokale Haalbaarheid klinisch
------------------------------------------------------------------------------------------------------------------------------------------- Tweede concept van de Procedure Lokale Haalbaarheid klinisch
1. Beschrijving werkgebieden / thema s
 1. Beschrijving werkgebieden / thema s Nr 1 Thema Wetenschappelijke Achtergrond en Opzet van Onderzoek 2 Ethische en veiligheid overwegingen 3 Ontwikkeling en Regelgeving 4 Clinical Trial Operations (Projectorganisatie)
1. Beschrijving werkgebieden / thema s Nr 1 Thema Wetenschappelijke Achtergrond en Opzet van Onderzoek 2 Ethische en veiligheid overwegingen 3 Ontwikkeling en Regelgeving 4 Clinical Trial Operations (Projectorganisatie)
Henk Jan Out, Paul van Meurs en Rudolf van Olden. Van eerste humane toediening tot algemeen gebruik
 VII 1 Introductie tot de farmaceutische geneeskunde................................ 1 Henk Jan Out, Paul van Meurs en Rudolf van Olden I Van eerste humane toediening tot algemeen gebruik 2 Exploratory
VII 1 Introductie tot de farmaceutische geneeskunde................................ 1 Henk Jan Out, Paul van Meurs en Rudolf van Olden I Van eerste humane toediening tot algemeen gebruik 2 Exploratory
