Nieuwe ontwikkelingen in regelgeving
|
|
|
- Johanna van der Wal
- 7 jaren geleden
- Aantal bezoeken:
Transcriptie
1 Nieuwe ontwikkelingen in regelgeving klinisch i onderzoek Monique Al NVMETC scholingsdagen 2015 Zwolle/Amsterdam
2 Nieuwe en toekomstige wijzigingen WMO 1. Verzekeringsbesluit en CCMO richtlijn externe toetsing 2. Melden ernstig ongewenste voorvallen 3. Onderzoek met minderjarige en wilsonbekwame volwassen proefpersonen 4. EU-Verordening geneesmiddelenonderzoek
3 Nieuwe en toekomstige wijzigingen WMO 1. Verzekeringsbesluit en CCMO richtlijn externe toetsing 2. Melden ernstig ongewenste voorvallen 3. Onderzoek met minderjarige en wilsonbekwame volwassen proefpersonen 4. EU-Verordening geneesmiddelenonderzoek
4 Verzekeringsbesluit, dd 1juli2015 schrappen van uitsluitingen die de dekking onnodig beperken (schade die het gevolg was van uitblijven verbetering of van verslechtering van gezondheidsproblemen) marktconforme aanpassing van de bedragen waarvoor de verzekering dekking dient te bieden dekking voor alle proefpersonen binnen multicenter onderzoek in één verzekering wijziging niet van toepassing op onderzoek dat vóór 1 juli 2015 positief is beoordeeld
5 CCMO-Richtlijn Externe Toetsing 1 juli 2015 niet meer mogelijk om voor ieder deelnemend centrum afzonderlijk een proefpersonenverzekering af te sluiten gewijzigde onderzoeksverklaring nieuw: verklaring proefpersonenverzekering (verklaring verrichter dat alle proefpersonen zijn verzekerd) aanpassing model verzekeringstekst bij PIF
6 Nieuwe en toekomstige wijzigingen WMO 1. Verzekeringsbesluit en CCMO richtlijn externe toetsing 2. Melden ernstig ongewenste voorvallen 3. Onderzoek met minderjarige en wilsonbekwame volwassen proefpersonen 4. EU-Verordening geneesmiddelenonderzoek
7 Wijzigingen WMO (artikelen 1,10, en 13a) 1 oktober 2015 Definitie ernstig ongewenst voorval (SAE) (art 1, art 10- lid 6) Melden SAE s aan verrichter (art 10, lid 1) wijziging artikel 13a Rapporteren SAE s aan METC (art 10, lid 2 en 3) Opschorten onderzoek door verrichter (art 10, lid 4 en 5) vervallen van het huidige artikel 10, lid 1 Jaarlijks overzicht aantal SAE meldingen door CCMO (artikel 10, lid 7) Informeren proefpersoon over artikel 10, lid 4 (art 11)
8 Regeling medisch wetenschappelijk onderzoek 1 oktober 2015 Artikel 10: Rapportage van SAE als bedoeld in artikel 10, tweede lid, van de WMO wordt uitsluitend gedaan via de webportal ToetsingOnline
9 Leidraad voor METC s bij de beoordeling van de meldingsprocedure Uitgangspunt, alle SAE s worden gemeld bij de METC, tenzij anders in het protocol is vastgelegd Vier categorieën onderzoek geneesmiddelenonderzoek onderzoek naar medische hulpmiddelen met notificatieplicht IGZ observationeel onderzoek waarbij proefpersonen alleen aan extra standaard diagnostiek worden onderworpen overig onderzoek
10 Wijze van rapporteren aan METC Individuele SAE rapporten binnen 7 of 15 dagen via webportal ToetsingOnline Periodieke overzichtsrapportages Jaarlijkse veiligheidsrapportage (bijv. DSUR met cumulatieve samenvattende tabel) Geen rapportage
11 Wijziging WMO en regeling Med. Wet. Onderz. 1 oktober 2015 Geldig voor al het WMO-plichtig onderzoek Onderzoek beoordeeld vóór 1 oktober 2015: protocol aanpassen, indien nodig, middels amendement of addendum (memo/note to file) uiterlijk 31 december 2015
12 Nieuwe en toekomstige wijzigingen WMO 1. Verzekeringsbesluit en CCMO richtlijn externe toetsing 2. Melden ernstig ongewenste voorvallen 3. Onderzoek met minderjarige en wilsonbekwame volwassen proefpersonen 4. EU-Verordening geneesmiddelenonderzoek
13 Onderzoek met minderjarige en wilsonbekwame meerderjarige proefpersonen Tweede Kamer: akkoord met wetsvoorstel Niet-therapeutisch therapeutisch interventie onderzoek: absolute bovengrens van minimale belasting en risico wordt gerelateerd aan de standaard behandeling van de aandoening Standaardbehandeling mag ook gericht op symptoombestrijding Geen standaardbehandeling: minimale risico s s en belasting gezien de aard en de ernst van de aandoening
14 Onderzoek met minderjarige en wilsonbekwame meerderjarige proefpersonen Tweede Kamer: akkoord met wetsvoorstel CCMO commissie: uitbreiding met verplichte discipline kinderarts METC: aanwezigheid kinderarts alleen verplicht bij beoordeling onderzoek met minderjarige proefpersonen Geen aanvullende eisen samenstelling commissie bij beoordeling onderzoek met wilsonbekwame volwassen proefpersonen
15 Onderzoek met minderjarige en wilsonbekwame meerderjarige proefpersonen Tweede Kamer: akkoord met wetsvoorstel Leeftijdsgrens voor geven zelfstandig toestemming deelname onderzoek verlaagd naar 16 jaar Nieuw toetsingscriterium: de hoogte van de vergoeding voor proefpersonen jonger dan 18 jaar mag niet van invloed zijn op beslissing tot deelname Aanpassing toetsingskader CCMO/NVMETC
16 Nieuwe en toekomstige wijzigingen WMO 1. Verzekeringsbesluit en CCMO richtlijn externe toetsing 2. Melden ernstig ongewenste voorvallen 3. Onderzoek met minderjarige en wilsonbekwame volwassen proefpersonen 4. EU-Verordening geneesmiddelenonderzoek
17 Reikwijdte EU Verordening 536/2014 klinische proeven die in de Unie worden uitgevoerd teneinde de werking en veiligheid van geneesmiddelen bij de mens vast te stellen industry-driven en investigator-initiated onderzoek nationaal en multinationaal geneesmiddelenonderzoek niet van toepassing op studies zonder interventie, dwz studies die geen klinische proef zijn! wel van toepassing op klinische proef met beperkte interventie ( low-intervention trial ) (geregistreerd geneesmiddel; geregistreerd geneesmiddel gebruikt binnen toepassingsgebied of gebruik evidence based in één of meer lidstaten; aanvullende diagnostische of monitoring procedures minimaal risico en belasting tov normale klinische praktijk)
18 Deel I Deel II - centraal nationaal Eén onderzoeksdossier EU-portal relevantie klinische proef risico s en ongemakken proefpersoon betrouwbaarheid/robuustheid data IMPD:kwaliteit, productie, veiligheid, import IMPs/AMPs etikettering Investigator s Brochure low-intervention trial? PIF en informed consent wervingsprocedure vergoedingen proefpersoon/ onderzoeker geschiktheid onderzoeker/ faciliteiten privacy verzekering afname, opslag en nader gebruik lichaamsmateriaal EU portal
19 D l I t l D l II ti l Deel I centraal Oordeel : rapp. lid t t Eén onderzoeksdossier oeksdossier EU-portal Deel II nationaal Oordeel: betrokken lid t t lidstaat lidstaat validatie door rapporterend lidstaat (max 25 dgn) beoordelingsrapport, afstemming betrokken MS, conclusie (45 dgn) ethische toets positief deel I/II negatief conclusie deel II (45 dgn) (+/- ov) aspecten EU portal: één besluit (+/- ov) per betrokken lidstaat (5 dgn)
20 Validatiefase keuze rms, volledigheid dossier en reikwijdte 10 5 dag 3 dag 6 dag 7 dag 10 dag 20 dag 25 pms*=rms? andere rms? Notificatie rms Comm. cms naar rms Comm. rms naar sponsor Reactie sponsor naar rms rms p naar rms Beslissing validatie rms naar sponsor indiening vervallen stilzwijgende goedkeuring *pms= rms op voordracht sponsor
21 Beoordelingsfase beoordeling deel 1, deel 2, ethische aspecten beoordeling g() (r)ms reaktie sponsor eind- beoordeling deel beoordelingsrapport deel conclusie ethische toets parallel aan deel 1 en deel 2 beoordeling advies ATMP: termijn + 50 dagen bij extern adviesaanvraag MS > max termijn: geen besluit reactie sponsor > max termijn: indiening vervallen
22 Beoordelingsfase Beoordeling deel 1: nationaal of multinationaal beoordeling g() (r)ms reaktie sponsor beoordeling deel 1 nationaal deel 1 multinat initiële fase coördinatie fase consolidatie fase coördinatie fase consolidatie fase
23 Toetsingsproces: wat is anders? Indiening onderzoeksdossier: 1 onderzoeksdossier via EU-portal Beoordelingsrapport deel 1 (Engelstalig) De Europese samenwerking bij multinationale studies -Validatiefase(keuze rapporterend lidstaat en volledigheid dossier) - Deel 1 beoordeling (primaire indiening/subst. amend.) Strikte beoordelingstermijnen Centrale indiening en gecoördineerde beoordeling veiligheidsrapportages Corrigerende i d maatregelen (intrekken besluit, opschorten studie en verzoek substantiële wijziging) CCMO/IGZ EU database: openbaar tenzij.
24 Openbaarmaking in EU database Uitgangspunt van Verordening is dat de EU database openbaar toegankelijk is (artikel 81, lid 4), tenzij geheimhouding gerechtvaardigd is op pg grond van bescherming gp persoonsgegevens g en de bescherming van commercieel vertrouwelijke informatie 3 categoriën onderzoek 1. fase 0/I 2. fase II/III 3. fase IV en low-intervention trials Openbaarmaking na besluit van de belangrijkste kenmerken (titel, studie opzet, wetenschappelijk en therapeutisch doel, IMP, behandelarmen, populatie, inclusie en exclusiecriteria, doel van het onderzoek en eindpunten) en gehele onderzoeksdossier met uitzondering IMPD-Q, beoordelingsrapport, vragen, antwoorden indiener. Openbaarmaking inspectierapporten, veiligheidsinformatie, corrigerende maatregelen, samenvatting resultaten, studie eindrapport
25 Openbaarmaking in EU database Uitstel voor openbaarmaking categorie 1 onderzoek : - aantal kerngegevens tot t 1 jaar na einde studie in EU - protocol, PIF, IMPD (not Q-section), IB, antwoordbrieven indiener: tot registratie of max 7 jaar na einde studie - resultaten studie: max 18 maanden na datum upload samenvatting resultaten (12 maanden na einde studie of later om wetenschappelijke redenen) Uitstel voor openbaarmaking categorie 2 onderzoek - protocol, PIF, IMPD (not Q-section), IB, antwoordbrieven indiener: tot registratie of max 5 jaar na einde studie Uitstel voor openbaarmaking categorie 3 onderzoek - protocol, IMPD (not Q-section), IB, antwoordbrieven indiener: tot max 1 jaar na einde studie Overige documenten (bijv beoordelingsrapport): met rechtvaardiging op basis bescherming persoonsgegevens, bescherming van commercieel vertrouwelijke informatie
26 Stand van zaken implementatie in NL de huidige geïntegreerde toets van wetenschap en ethiek door een en dezelfde commissie wordt behouden Nederland behoudt decentrale toetsing; coördinatie en ondersteuning bij multinationaal onderzoek door een landelijk bureau Nederland d ambieert een actieve rol als "rapporterend lidstaat Voor het overige onderzoek blijft de WMO van kracht. Aanpassing WMO
27 Stand van zaken implementatie in NL feb 2015: Rapport Driebergen (input van CCMO, NVMETC, IGZ, CBG en VWS) -voorstel: scenario decentrale t l concentratie ti decentraal: toetsing wordt uitgevoerd door decentrale METC s en CCMO en niet door een landelijke commissie concentratie: aantal toetsende METC s beperken met een centraal coördinatiepunt voor optimale kwaliteit en efficiëntie juni 2015: conceptwetsvoorstel op basis van advies Driebergen -taken centraal coördinatiepunt ondergebracht bij de CCMO (artikel 17a) -sturingsinstrument erkenning en concentratie METC s, toewijzing dossiers (artikelen 16 en 17) -waarborgen scheiding toezicht / taken centraal coördinatiepunt t (artikel 24, lid 2) juli 2015: definitief concept wetsvoorstel -verduidelijking taken van het centraal coördinatiepunt - bepaling dat Minister nationaal contactpunt aanwijst nov 2015: Ministerraad
28 Taken: CCMO wordt verantwoordelijk voor: 1. validatie onderzoeksdossier (volledigheid dossier en reikwijdte Verordening) primair en amendementen 2. communicatie over keuze rapporterend lidstaat (inclusief bereidheid NL als rapporterend lidstaat) 3. toewijzing onderzoeksdossiers aan erkende METC/CCMO 4. de administratieve ondersteuning van commissie bij multinationaal onderzoek (opstellen beoordelingsrapport deel I en communicatie met indiener en andere lidstaten) 5. nationaal beheer EU-portal 6. (coördinatie beoordeling veiligheidsinformatie/ernstige inbreuken) 7. (inning en verdeling tarieven)
29 EU-portal validatie en verdeling dossiers door landelijk bureau (CCMO) nationale geneesmiddelenstudies multinationale geneesmiddelenstudies toewijzingscriteria/specialisatie TC-1 TC-2 TC-3 TC-4 TC-5 TC-.. CCMO TC-1 TC-2 TC-3 TC-4 TC-5 TC-.. CCMO secr-1 secr-2 secr-3 secr-4 secr-5 secr-.. secr- CCMO landelijk bureau nationaal beoordelingsrapport, toets deel 2 en Engels beoordelingsrapport (samen met LS) door ethische toets landelijk bureau, toets deel 2 en ethische toets EU portal: één besluit per betrokken lidstaat
30 Verordening no 536/2014 EU portal functioneel juni 2017 (publicatie EC op basis van resultaten onafhankelijke audit) Datum inwerkingtreding g december 2017 Intrekking van de Europese Richtlijn 2001/20 EG Voorstel voor transitieperiode i 1-3 jaar: - 1e jaar: primaire indieningen volgens oude of nieuwe wetgeving - 2 e jaar: alle primaire indieningen volgens Verordening - 3 e jaar: alle indieningen (prim./amend.) volgens Verordening
31 contact information
32 Disclaimer No rights can be derived form this presentation. Although the CCMO takes every effort to ensue the information contained in this presentation is accurate, it cannot accept any liability for the accuracy of this information. The views and opinions expressed in this presentation are those of the author and do not necessarily represent those of the CCMO. The CCMO accepts no responsibility for the consequences of using this presentation ti contained therein. The information in this presentation may be used if the source is quoted.
EU verordening no 536/2014 betreffende klinische proeven met geneesmiddelen voor menselijk gebruik
 EU verordening no 536/2014 betreffende klinische proeven met geneesmiddelen voor menselijk gebruik -Implicaties voor CCMO, METC s en onderzoekers- Paula Vossebeld DCTF jaarcongres 7 oktober 2015 Verordening
EU verordening no 536/2014 betreffende klinische proeven met geneesmiddelen voor menselijk gebruik -Implicaties voor CCMO, METC s en onderzoekers- Paula Vossebeld DCTF jaarcongres 7 oktober 2015 Verordening
EU verordening no 536/2014 betreffende klinische proeven met geneesmiddelen voor menselijk gebruik
 EU verordening no 536/2014 betreffende klinische proeven met geneesmiddelen voor menselijk gebruik -Implicaties voor onderzoekers- Paula Vossebeld Symposium van de V&VN RP 10 november 2015 Verordening
EU verordening no 536/2014 betreffende klinische proeven met geneesmiddelen voor menselijk gebruik -Implicaties voor onderzoekers- Paula Vossebeld Symposium van de V&VN RP 10 november 2015 Verordening
Europese verordening klinische proeven. Harrie Storms (VWS)
 Europese verordening klinische proeven Harrie Storms (VWS) 1 Veranderingen EU verordening Indiening via EU-portal (nationale studies en multinationale studies) Centrale beoordeling van multinationaal onderzoek
Europese verordening klinische proeven Harrie Storms (VWS) 1 Veranderingen EU verordening Indiening via EU-portal (nationale studies en multinationale studies) Centrale beoordeling van multinationaal onderzoek
Actuele ontwikkelingen ten aanzien van toetsen van medisch-wetenschappelijk onderzoek met mensen
 Actuele ontwikkelingen ten aanzien van toetsen van medisch-wetenschappelijk onderzoek met mensen NVMETC scholingsdagen 2017 Monique Al Sr wetenschappelijk stafmedewerker CCMO Ontwikkelingen wetgeving 1.
Actuele ontwikkelingen ten aanzien van toetsen van medisch-wetenschappelijk onderzoek met mensen NVMETC scholingsdagen 2017 Monique Al Sr wetenschappelijk stafmedewerker CCMO Ontwikkelingen wetgeving 1.
MDR (2017/745) en klinisch onderzoek - Implementatie in Nederland -
 MDR (2017/745) en klinisch onderzoek - Implementatie in Nederland - DCRF 26 september 2018 Monique Al Teamcoördinator Landelijk Bureau CCMO MDR: Drie hoofdcategoriën klinisch onderzoek I II III Klinisch
MDR (2017/745) en klinisch onderzoek - Implementatie in Nederland - DCRF 26 september 2018 Monique Al Teamcoördinator Landelijk Bureau CCMO MDR: Drie hoofdcategoriën klinisch onderzoek I II III Klinisch
Actuele ontwikkelingen ten aanzien van toetsen van medisch-wetenschappelijk
 Actuele ontwikkelingen ten aanzien van toetsen van medisch-wetenschappelijk onderzoek met mensen NVMETC scholingsdagen 2016 Monique Al Sr wetenschappelijk stafmedewerker CCMO Ontwikkelingen wetgeving 1.
Actuele ontwikkelingen ten aanzien van toetsen van medisch-wetenschappelijk onderzoek met mensen NVMETC scholingsdagen 2016 Monique Al Sr wetenschappelijk stafmedewerker CCMO Ontwikkelingen wetgeving 1.
KLINISCH GENEESMIDDELEN- ONDERZOEK
 KLINISCH GENEESMIDDELEN- ONDERZOEK HET PROCES VAN HET OPSTARTEN VAN KLINISCH ONDERZOEK MET GENEESMIDDELEN GAAT VERANDEREN De ECTR verandert het klinisch onderzoek met geneesmiddelen in Europa. Dit heeft
KLINISCH GENEESMIDDELEN- ONDERZOEK HET PROCES VAN HET OPSTARTEN VAN KLINISCH ONDERZOEK MET GENEESMIDDELEN GAAT VERANDEREN De ECTR verandert het klinisch onderzoek met geneesmiddelen in Europa. Dit heeft
Update implementatie bepalingen klinisch onderzoek MDR in Nederland
 Update implementatie bepalingen klinisch onderzoek MDR in Nederland Sabina Hoekstra-van den Bosch Verdiepende sessie Klinisch Onderzoek VWS, Den Haag, 23 mei 2019 Samenvatting 1. Inleiding 2. Nieuwe EU
Update implementatie bepalingen klinisch onderzoek MDR in Nederland Sabina Hoekstra-van den Bosch Verdiepende sessie Klinisch Onderzoek VWS, Den Haag, 23 mei 2019 Samenvatting 1. Inleiding 2. Nieuwe EU
Jouw GCP up-to-date in 45 minuten. Marieke Meulemans, oprichter GCP Central
 Jouw GCP up-to-date in 45 minuten Marieke Meulemans, oprichter GCP Central Waarom een GCP update tijdens de CRA dag? Gedreven Meesterschap. Meesterschap is vakmanschap. Vakmanschap is beheersing van het
Jouw GCP up-to-date in 45 minuten Marieke Meulemans, oprichter GCP Central Waarom een GCP update tijdens de CRA dag? Gedreven Meesterschap. Meesterschap is vakmanschap. Vakmanschap is beheersing van het
Op naar het snel opstarten van klinisch onderzoek in Nederland!
 Op naar het snel opstarten van klinisch onderzoek in Nederland! Marika Trieling Voorzitter DCRF werkgroep Lokale uitvoerbaarheid 12 februari 2019 Wat is er in Nederland nodig? Verkorten tijdslijnen van
Op naar het snel opstarten van klinisch onderzoek in Nederland! Marika Trieling Voorzitter DCRF werkgroep Lokale uitvoerbaarheid 12 februari 2019 Wat is er in Nederland nodig? Verkorten tijdslijnen van
Praktische implementatie Europese verordening Geneesmiddelen onderzoek
 Praktische implementatie Europese verordening Geneesmiddelen onderzoek Dr. Joost Keers Hoofd Wetenschappelijk Instituut j.keers@mzh.nl 050 524 5826 http://www.ccmo.nl/nl/europese-verordening Belangrijke
Praktische implementatie Europese verordening Geneesmiddelen onderzoek Dr. Joost Keers Hoofd Wetenschappelijk Instituut j.keers@mzh.nl 050 524 5826 http://www.ccmo.nl/nl/europese-verordening Belangrijke
Klinisch onderzoek met medische hulpmiddelen: de rol van de METC
 Klinisch onderzoek met medische hulpmiddelen: de rol van de METC Invitational conference KO met MH Utrecht, 15 december 2016 Monique Al Wetenschappelijk stafmedewerker CCMO Beoordeling klinisch onderzoek
Klinisch onderzoek met medische hulpmiddelen: de rol van de METC Invitational conference KO met MH Utrecht, 15 december 2016 Monique Al Wetenschappelijk stafmedewerker CCMO Beoordeling klinisch onderzoek
EU verordening geneesmiddelenonderzoek
 EU verordening geneesmiddelenonderzoek Beoordelingen Europese s/jl mul/na/onaal vs. na/onale aanvraag Let op: de beoordeling wordt niet bij u ingediend maar in Europa via een Europese portal De beoordeling
EU verordening geneesmiddelenonderzoek Beoordelingen Europese s/jl mul/na/onaal vs. na/onale aanvraag Let op: de beoordeling wordt niet bij u ingediend maar in Europa via een Europese portal De beoordeling
Veel gestelde vragen Melden voorvallen/bijwerkingen bij geneesmiddelenonderzoek
 Veel gestelde vragen Melden voorvallen/bijwerkingen bij geneesmiddelenonderzoek Wat is een SUSAR? SUSAR is de afkorting van Suspected Unexpected Serious Adverse Reaction. In het Nederlands betekent dit
Veel gestelde vragen Melden voorvallen/bijwerkingen bij geneesmiddelenonderzoek Wat is een SUSAR? SUSAR is de afkorting van Suspected Unexpected Serious Adverse Reaction. In het Nederlands betekent dit
Standard Operating Procedure
 Standard Operating Procedure STZ SOP: VC9 Proefpersonen- en aansprakelijkheidsverzekering (centraal) Distributielijst : STZ Datum : 10-03-2014 Revisiedatum : 10-03-2015 Veranderingen ten opzichte van eerdere
Standard Operating Procedure STZ SOP: VC9 Proefpersonen- en aansprakelijkheidsverzekering (centraal) Distributielijst : STZ Datum : 10-03-2014 Revisiedatum : 10-03-2015 Veranderingen ten opzichte van eerdere
Inhoud onderzoeksdossier
 Inhoud onderzoeksdossier (documenten in de witte box zijn nodig voor de primaire beoordeling) A. Brieven B. Formulieren C. Onderzoeksprotocol en protocolamendementen D. Productinformatie E. Informatie
Inhoud onderzoeksdossier (documenten in de witte box zijn nodig voor de primaire beoordeling) A. Brieven B. Formulieren C. Onderzoeksprotocol en protocolamendementen D. Productinformatie E. Informatie
De laatste versie van dit document is te downloaden op: www.umcutrecht.nl/metc. Indienen documenten bij de METC UMC Utrecht
 Indienen documenten bij de METC UMC Utrecht Begin hier Bekijk in onderstaande tabel wat u wilt indienen. Kijk daarna welke methode van indiening en welke documenten bij uw indiening horen. Volg bij het
Indienen documenten bij de METC UMC Utrecht Begin hier Bekijk in onderstaande tabel wat u wilt indienen. Kijk daarna welke methode van indiening en welke documenten bij uw indiening horen. Volg bij het
Standard Operating Procedure
 Standard Operating Procedure STZ SOP: VC8 Beoordeling amendement toetsende commissie (centraal) Distributielijst : STZ Datum : 10-03-2014 Revisiedatum : 10-03-2015 Veranderingen ten opzichte van eerdere
Standard Operating Procedure STZ SOP: VC8 Beoordeling amendement toetsende commissie (centraal) Distributielijst : STZ Datum : 10-03-2014 Revisiedatum : 10-03-2015 Veranderingen ten opzichte van eerdere
Link naar het filmpje: https://www.youtube.com/watch?v =PLIVVDmDjDI. Eerst even dit:
 Link naar het filmpje: https://www.youtube.com/watch?v =PLIVVDmDjDI Eerst even dit: 1 ECTR: Keep calm and get organised! Marieke Meulemans, GCP Central Annelies van Woudenberg, DCRF Workshop ECTR DCRF
Link naar het filmpje: https://www.youtube.com/watch?v =PLIVVDmDjDI Eerst even dit: 1 ECTR: Keep calm and get organised! Marieke Meulemans, GCP Central Annelies van Woudenberg, DCRF Workshop ECTR DCRF
Toezicht op uitvoering kan beter. Aanbevelingen uit rapport Toezicht op Medisch Wetenschappelijk Onderzoek met mensen
 Toezicht op uitvoering kan beter Aanbevelingen uit rapport Toezicht op Medisch Wetenschappelijk Onderzoek met mensen Najaarsbijeenkomst NVMETC 25 november 2015 Kor Grit, Jacqueline van Oijen 2 Inhoud presentatie
Toezicht op uitvoering kan beter Aanbevelingen uit rapport Toezicht op Medisch Wetenschappelijk Onderzoek met mensen Najaarsbijeenkomst NVMETC 25 november 2015 Kor Grit, Jacqueline van Oijen 2 Inhoud presentatie
Tweede Kamer der Staten-Generaal
 Tweede Kamer der Staten-Generaal 2 Vergaderjaar 2015 2016 34 429 Wijziging van de Wet medisch-wetenschappelijk onderzoek met mensen en de Geneesmiddelenwet in verband met de uitvoering van verordening
Tweede Kamer der Staten-Generaal 2 Vergaderjaar 2015 2016 34 429 Wijziging van de Wet medisch-wetenschappelijk onderzoek met mensen en de Geneesmiddelenwet in verband met de uitvoering van verordening
 ------------------------------------------------------------------------------------------------------------------------------------------- Tweede concept van de Procedure Lokale Haalbaarheid klinisch
------------------------------------------------------------------------------------------------------------------------------------------- Tweede concept van de Procedure Lokale Haalbaarheid klinisch
Therapeutisch versus niet-therapeutisch onderzoek bij minderjarige en wilsonbekwame proefpersonen
 Therapeutisch versus niet-therapeutisch onderzoek bij minderjarige en wilsonbekwame proefpersonen In de Wet medisch-wetenschappelijk onderzoek met mensen (WMO) staat: Het is verboden wetenschappelijk onderzoek
Therapeutisch versus niet-therapeutisch onderzoek bij minderjarige en wilsonbekwame proefpersonen In de Wet medisch-wetenschappelijk onderzoek met mensen (WMO) staat: Het is verboden wetenschappelijk onderzoek
website www.nvmetc.nl
 Verslag NVMETC secretarissenoverleg 19 juni 2014 1. Opening en vaststelling agenda Dhr. Davids geeft aan, dat een belangrijke reden van dit secretarissenoverleg is, dat we van elkaar horen wat er speelt
Verslag NVMETC secretarissenoverleg 19 juni 2014 1. Opening en vaststelling agenda Dhr. Davids geeft aan, dat een belangrijke reden van dit secretarissenoverleg is, dat we van elkaar horen wat er speelt
CCMO Structuur documenten Technische Toetsing (ass.secr.) Inhoudelijke Toetsing (secretaris)
 CHECKLIST WMO Primaire indieningsproces WMO in METC Management, screening door Assistent Secretaris. Hieronder staan de generieke uitgangspunten en is toegelicht hoe de primaire toetsing indiening WMO
CHECKLIST WMO Primaire indieningsproces WMO in METC Management, screening door Assistent Secretaris. Hieronder staan de generieke uitgangspunten en is toegelicht hoe de primaire toetsing indiening WMO
Toezicht op klinisch onderzoek bij STZ-ziekenhuizen. Farmaceutische Bedrijven Deelteam Klinisch Onderzoek
 Toezicht op klinisch onderzoek bij STZ-ziekenhuizen Farmaceutische Bedrijven Deelteam Klinisch Onderzoek Toezicht op klinisch onderzoek bij STZ-ziekenhuizen Bevindingen vanuit de praktijk Conclusies en
Toezicht op klinisch onderzoek bij STZ-ziekenhuizen Farmaceutische Bedrijven Deelteam Klinisch Onderzoek Toezicht op klinisch onderzoek bij STZ-ziekenhuizen Bevindingen vanuit de praktijk Conclusies en
European Clinical Trial Regulation: Kans voor Nederland
 European Clinical Trial Regulation: Kans voor Nederland Annelies van Woudenberg, 13 november 2017 European Clinical Trial Regulation 536/ 2014 EU Verordening betreffende klinische proeven met geneesmiddelen
European Clinical Trial Regulation: Kans voor Nederland Annelies van Woudenberg, 13 november 2017 European Clinical Trial Regulation 536/ 2014 EU Verordening betreffende klinische proeven met geneesmiddelen
Checklist Lokale Uitvoerbaarheid
 Primaire indieningsproces Lokale Uitvoerbaarheid in METC Management, screening door Assistent Secretaris. Hieronder staan de generieke uitgangspunten en is toegelicht hoe de toetsing indiening Lokale Uitvoerbaarheid
Primaire indieningsproces Lokale Uitvoerbaarheid in METC Management, screening door Assistent Secretaris. Hieronder staan de generieke uitgangspunten en is toegelicht hoe de toetsing indiening Lokale Uitvoerbaarheid
Standard Operating Procedure
 Standard Operating Procedure STZ SOP: U11 Voortgangsrapportage Distributielijst : STZ Datum : 19-06-2014 Revisiedatum : 19-06-2015 Veranderingen ten opzichte van eerdere versies Versiedatum Opmerkingen
Standard Operating Procedure STZ SOP: U11 Voortgangsrapportage Distributielijst : STZ Datum : 19-06-2014 Revisiedatum : 19-06-2015 Veranderingen ten opzichte van eerdere versies Versiedatum Opmerkingen
Impact van de ECTR en hoe zorgen we dat NL als beste uit de bus komt. Annelies van Woudenberg, ACRON Najaarsvergadering, 2 november 2016
 Impact van de ECTR en hoe zorgen we dat NL als beste uit de bus komt Annelies van Woudenberg, ACRON Najaarsvergadering, 2 november 2016 2 Dutch Clinical Research Foundation (DCRF) European Clinical Trial
Impact van de ECTR en hoe zorgen we dat NL als beste uit de bus komt Annelies van Woudenberg, ACRON Najaarsvergadering, 2 november 2016 2 Dutch Clinical Research Foundation (DCRF) European Clinical Trial
Standard Operating Procedure
 Standard Operating Procedure STZ SOP: VL5 Protocolamendement (lokaal) Distributielijst : STZ Datum : 03-06-2014 Revisiedatum : 03-06-2015 Veranderingen ten opzichte van eerdere versies Versiedatum Opmerkingen
Standard Operating Procedure STZ SOP: VL5 Protocolamendement (lokaal) Distributielijst : STZ Datum : 03-06-2014 Revisiedatum : 03-06-2015 Veranderingen ten opzichte van eerdere versies Versiedatum Opmerkingen
De ECTR: een kans voor Nederland! Annelies van Woudenberg, DCRF congres, 5 oktober 2016
 De ECTR: een kans voor Nederland! Annelies van Woudenberg, DCRF congres, 5 oktober 2016 European Clinical Trial Regulation 536/ 2014 European Clinical Trial Regulation (ECTR): EU Verordening betreffende
De ECTR: een kans voor Nederland! Annelies van Woudenberg, DCRF congres, 5 oktober 2016 European Clinical Trial Regulation 536/ 2014 European Clinical Trial Regulation (ECTR): EU Verordening betreffende
Standard Operating Procedure
 Standard Operating Procedure STZ SOP: VL2 Aanpassen proefpersoneninformatie / toestemmingsformulier aan lokale situatie Distributielijst : STZ Datum : 20-03-2014 Revisiedatum : 20-03-2015 Veranderingen
Standard Operating Procedure STZ SOP: VL2 Aanpassen proefpersoneninformatie / toestemmingsformulier aan lokale situatie Distributielijst : STZ Datum : 20-03-2014 Revisiedatum : 20-03-2015 Veranderingen
DE MONITOR. Bijlage 1
 DE MONITOR Bijlage 1 legenda procesfase rol voorbereidingsfase v=verantwoordelijk uitvoeringsfase p= partner gerealiseerd evaluatiefase Geen actie agenda werkgroep aandachtslevel regisseur **** direct
DE MONITOR Bijlage 1 legenda procesfase rol voorbereidingsfase v=verantwoordelijk uitvoeringsfase p= partner gerealiseerd evaluatiefase Geen actie agenda werkgroep aandachtslevel regisseur **** direct
Toetsingskader niet-wmo plichtig onderzoek
 Toetsingskader niet-wmo plichtig onderzoek Mieke D Trip, internist Voorzitter METC, AMC te Amsterdam Voorzitter BROK commissie, NFU 22 september 2011 Toetsingskader niet-wmo plichtig onderzoek Huidige
Toetsingskader niet-wmo plichtig onderzoek Mieke D Trip, internist Voorzitter METC, AMC te Amsterdam Voorzitter BROK commissie, NFU 22 september 2011 Toetsingskader niet-wmo plichtig onderzoek Huidige
Toezicht op onderzoeker geïnitieerd klinisch onderzoek (IIT) Team Klinisch Onderzoek
 Toezicht op onderzoeker geïnitieerd klinisch onderzoek (IIT) 2014-2016 Team Klinisch Onderzoek Toezicht op IIT 2014-2016 Aanleiding en werkwijze Bevindingen vanuit de praktijk Conclusies en aandachtspunten
Toezicht op onderzoeker geïnitieerd klinisch onderzoek (IIT) 2014-2016 Team Klinisch Onderzoek Toezicht op IIT 2014-2016 Aanleiding en werkwijze Bevindingen vanuit de praktijk Conclusies en aandachtspunten
Tweede Kamer der Staten-Generaal
 Tweede Kamer der Staten-Generaal 2 Vergaderjaar 2015 2016 34 429 Wijziging van de Wet medisch-wetenschappelijk onderzoek met mensen en de Geneesmiddelenwet in verband met de uitvoering van verordening
Tweede Kamer der Staten-Generaal 2 Vergaderjaar 2015 2016 34 429 Wijziging van de Wet medisch-wetenschappelijk onderzoek met mensen en de Geneesmiddelenwet in verband met de uitvoering van verordening
Financiering METC s. Harrie Storms 20 april 2016
 Financiering METC s Harrie Storms 20 april 2016 Welke keuzes zijn gemaakt? Nederland kent een model van decentrale concentratie met een beperkt aantal decentrale commissies en centraal georganiseerde ondersteuning.
Financiering METC s Harrie Storms 20 april 2016 Welke keuzes zijn gemaakt? Nederland kent een model van decentrale concentratie met een beperkt aantal decentrale commissies en centraal georganiseerde ondersteuning.
Toezicht op IIT: bevindingen vanuit de praktijk
 Toezicht op IIT: bevindingen vanuit de praktijk Elysée Hille, senior inspecteur namens deelteam KO-GCP Teamcoördinator KO-GCP/PhV/GZH Afdeling Farmaceutische Bedrijven Wat doet de IGZ? Toezicht op klinisch
Toezicht op IIT: bevindingen vanuit de praktijk Elysée Hille, senior inspecteur namens deelteam KO-GCP Teamcoördinator KO-GCP/PhV/GZH Afdeling Farmaceutische Bedrijven Wat doet de IGZ? Toezicht op klinisch
European Clinical Trial Regulation: Kans voor Nederland
 European Clinical Trial Regulation: Kans voor Nederland Annelies van Woudenberg, 9 juni 2017 ECTR biedt kans ambitie NL waar te maken Eenduidige toestemmingsprocedures Europa interessant voor internationale
European Clinical Trial Regulation: Kans voor Nederland Annelies van Woudenberg, 9 juni 2017 ECTR biedt kans ambitie NL waar te maken Eenduidige toestemmingsprocedures Europa interessant voor internationale
Formulier Voortgangsrapportage
 Formulier Voortgangsrapportage De METC azm/um wil van al het door haar beoordeelde WMO-onderzoek jaarlijks een voortgangsrapportage zien. Zij heeft deze eis daartoe opgenomen in de tekst van haar eigen
Formulier Voortgangsrapportage De METC azm/um wil van al het door haar beoordeelde WMO-onderzoek jaarlijks een voortgangsrapportage zien. Zij heeft deze eis daartoe opgenomen in de tekst van haar eigen
Toezicht op klinisch onderzoek: bevindingen uit inspecties bij GGZ instellingen
 Toezicht op klinisch onderzoek: bevindingen uit inspecties bij GGZ instellingen Afdeling Farmaceutische Bedrijven, Klinisch Onderzoek Good Clinical Practice Inhoud Wat doet de IGJ aan toezicht op klinisch
Toezicht op klinisch onderzoek: bevindingen uit inspecties bij GGZ instellingen Afdeling Farmaceutische Bedrijven, Klinisch Onderzoek Good Clinical Practice Inhoud Wat doet de IGJ aan toezicht op klinisch
Veel gestelde vragen Medisch-wetenschappelijk onderzoek met medische hulpmiddelen 1
 Veel gestelde vragen Medisch-wetenschappelijk onderzoek met medische hulpmiddelen 1 1. Wat is een medisch hulpmiddel? De wettelijke definitie 2 van een medisch hulpmiddel luidt: Een medisch hulpmiddel
Veel gestelde vragen Medisch-wetenschappelijk onderzoek met medische hulpmiddelen 1 1. Wat is een medisch hulpmiddel? De wettelijke definitie 2 van een medisch hulpmiddel luidt: Een medisch hulpmiddel
Ongewenste voorvallen flow AE SAE SAR SUSAR SADE voor onderzoeker geïnitieerd WMO-plichtig onderzoek
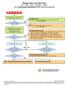 Ongewenste voorvallen flow AE SAE SAR SUSAR SADE voor onderzoeker geïnitieerd WMO-plichtig onderzoek Melding voorval proefpersoon aan onderzoeker/arts 1 Rapportage voorval door onderzoeker/arts in patiëntenstatus
Ongewenste voorvallen flow AE SAE SAR SUSAR SADE voor onderzoeker geïnitieerd WMO-plichtig onderzoek Melding voorval proefpersoon aan onderzoeker/arts 1 Rapportage voorval door onderzoeker/arts in patiëntenstatus
European Clinical Trial Regulation: Kans voor Nederland
 European Clinical Trial Regulation: Kans voor Nederland Annelies van Woudenberg, 14 november 2018 ECTR-project NL CCMO, DCRF en VWS: samenwerking bij implementatie ECTR Doel: als verordening van kracht
European Clinical Trial Regulation: Kans voor Nederland Annelies van Woudenberg, 14 november 2018 ECTR-project NL CCMO, DCRF en VWS: samenwerking bij implementatie ECTR Doel: als verordening van kracht
AMC Uitvoeringsrichtlijnen: Goedkeuring medisch-wetenschappelijk onderzoek door de Raad van Bestuur
 AMC Uitvoeringsrichtlijnen: Goedkeuring medisch-wetenschappelijk onderzoek door de Raad van Bestuur en Deelname van personeelsleden en studenten aan medisch-wetenschappelijk onderzoek Versie 1.1 Dit document
AMC Uitvoeringsrichtlijnen: Goedkeuring medisch-wetenschappelijk onderzoek door de Raad van Bestuur en Deelname van personeelsleden en studenten aan medisch-wetenschappelijk onderzoek Versie 1.1 Dit document
Procedure aanvraag voor het verrichten van wetenschappelijk onderzoek in Meander Medisch Centrum
 Procedure aanvraag voor het verrichten van wetenschappelijk onderzoek in Meander Medisch Centrum Commissie Toetsing Wetenschappelijk Onderzoek (TWO) I II Algemeen 1. Alvorens onderzoek in Meander MC van
Procedure aanvraag voor het verrichten van wetenschappelijk onderzoek in Meander Medisch Centrum Commissie Toetsing Wetenschappelijk Onderzoek (TWO) I II Algemeen 1. Alvorens onderzoek in Meander MC van
Officiële uitgave van het Koninkrijk der Nederlanden sinds 1814.
 STAATSCOURANT Officiële uitgave van het Koninkrijk der Nederlanden sinds 1814. Nr. 20221 17 juli 2015 Regeling van de Minister van Volksgezondheid, Welzijn en Sport van 9 juli 2015, houdende regels voor
STAATSCOURANT Officiële uitgave van het Koninkrijk der Nederlanden sinds 1814. Nr. 20221 17 juli 2015 Regeling van de Minister van Volksgezondheid, Welzijn en Sport van 9 juli 2015, houdende regels voor
Toenemende vraag naar nwmo studies Kwaliteit en transparantie voorop
 Beterdan Toenemende vraag naar nwmo studies Kwaliteit en transparantie voorop Joke Eggermont, Medisch Directeur Bristol-Myers Squibb Voorzitter Nefarma projectgroep niet-wmo plichtig onderzoek 1 Waarom?
Beterdan Toenemende vraag naar nwmo studies Kwaliteit en transparantie voorop Joke Eggermont, Medisch Directeur Bristol-Myers Squibb Voorzitter Nefarma projectgroep niet-wmo plichtig onderzoek 1 Waarom?
Ethiek van onderzoek met kinderen. Dr. Rieke van der Graaf DCRF Jaarcongres 26 september 2018, Ede
 Ethiek van onderzoek met kinderen Dr. Rieke van der Graaf DCRF Jaarcongres 26 september 2018, Ede Disclosure Slides geven mijn mening weer en niet die van het UMC Utrecht of het Julius Centrum Ethische
Ethiek van onderzoek met kinderen Dr. Rieke van der Graaf DCRF Jaarcongres 26 september 2018, Ede Disclosure Slides geven mijn mening weer en niet die van het UMC Utrecht of het Julius Centrum Ethische
Tweede Kamer der Staten-Generaal
 Tweede Kamer der Staten-Generaal 2 Vergaderjaar 2012 2013 33 646 Wijziging van de Wet medisch-wetenschappelijk onderzoek met mensen in verband met een uitbreiding van de meldingsplicht van ernstige ongewenste
Tweede Kamer der Staten-Generaal 2 Vergaderjaar 2012 2013 33 646 Wijziging van de Wet medisch-wetenschappelijk onderzoek met mensen in verband met een uitbreiding van de meldingsplicht van ernstige ongewenste
Antwoorden CRO-vragenlijst - foto van het veld
 Antwoorden CRO-vragenlijst - foto van het veld In samenwerking met het RIVM heeft de Inspectie voor de Gezondheidszorg (IGZ) een digitale vragenlijst ontwikkeld die bestond uit drie delen (zie Vragenlijst
Antwoorden CRO-vragenlijst - foto van het veld In samenwerking met het RIVM heeft de Inspectie voor de Gezondheidszorg (IGZ) een digitale vragenlijst ontwikkeld die bestond uit drie delen (zie Vragenlijst
Tweede Kamer der Staten-Generaal
 Tweede Kamer der Staten-Generaal 2 Vergaderjaar 2015 2016 34 429 Wijziging van de Wet medisch-wetenschappelijk onderzoek met mensen en de Geneesmiddelenwet in verband met de uitvoering van verordening
Tweede Kamer der Staten-Generaal 2 Vergaderjaar 2015 2016 34 429 Wijziging van de Wet medisch-wetenschappelijk onderzoek met mensen en de Geneesmiddelenwet in verband met de uitvoering van verordening
Handleiding Goedkeuringsprocedure Raad van Bestuur Zuyderland wetenschappelijk onderzoek
 Handleiding Goedkeuringsprocedure Raad van Bestuur Zuyderland wetenschappelijk onderzoek INLEIDING oor al het onderzoek dat binnen Zuyderland wordt uitgevoerd moet goedkeuring worden verkregen van de Raad
Handleiding Goedkeuringsprocedure Raad van Bestuur Zuyderland wetenschappelijk onderzoek INLEIDING oor al het onderzoek dat binnen Zuyderland wordt uitgevoerd moet goedkeuring worden verkregen van de Raad
Toetsingskader nwmo. Peggy Manders 4 november 2016 Symposium V&VN Research Professionals
 Toetsingskader nwmo Peggy Manders 4 november 2016 Symposium V&VN Research Professionals Biobank: definitie en rationale Wat is een biobank? + + Waarom een biobank starten? Verbeteren gezondheidszorg voor
Toetsingskader nwmo Peggy Manders 4 november 2016 Symposium V&VN Research Professionals Biobank: definitie en rationale Wat is een biobank? + + Waarom een biobank starten? Verbeteren gezondheidszorg voor
Aanmelden WMO-plichtig onderzoek
 Aanmelden WMO-plichtig onderzoek 1. Doel Het beschrijven van de procedure die gevolgd wordt bij het aanmelden van onderzoek dat onder de WMO valt en waarbij ZGV optreedt als deelnemend centrum. Voordat
Aanmelden WMO-plichtig onderzoek 1. Doel Het beschrijven van de procedure die gevolgd wordt bij het aanmelden van onderzoek dat onder de WMO valt en waarbij ZGV optreedt als deelnemend centrum. Voordat
3 april 2014 Partnership in Clinical Trials Martijn Griep, PhD Associate Director Kwaliteit en Naleving Janssen GCO Benelux, Tilburg
 Ideale site ideale samenwerking in clinical trials 3 april 2014 Partnership in Clinical Trials Martijn Griep, PhD Associate Director Kwaliteit en Naleving Janssen GCO Benelux, Tilburg MICROSOFT CORPORATION
Ideale site ideale samenwerking in clinical trials 3 april 2014 Partnership in Clinical Trials Martijn Griep, PhD Associate Director Kwaliteit en Naleving Janssen GCO Benelux, Tilburg MICROSOFT CORPORATION
Tweede Kamer der Staten-Generaal
 Tweede Kamer der Staten-Generaal 2 Vergaderjaar 2013 2014 33 646 Wijziging van de Wet medisch-wetenschappelijk onderzoek met mensen in verband met een uitbreiding van de meldingsplicht van ernstige ongewenste
Tweede Kamer der Staten-Generaal 2 Vergaderjaar 2013 2014 33 646 Wijziging van de Wet medisch-wetenschappelijk onderzoek met mensen in verband met een uitbreiding van de meldingsplicht van ernstige ongewenste
ETHISCH COMITÉ PZ HF KORTRIJK - PC MENEN
 ETHISCH COMITÉ PZ HF KORTRIJK - PC MENEN Aanvraagformulier Ethisch advies voor experimenten op de menselijke persoon Richtlijnen Ethische comités hebben een beperkte tijd om dossiers te evalueren en hun
ETHISCH COMITÉ PZ HF KORTRIJK - PC MENEN Aanvraagformulier Ethisch advies voor experimenten op de menselijke persoon Richtlijnen Ethische comités hebben een beperkte tijd om dossiers te evalueren en hun
Inhoudstafel per onderwerp volume 2 experimenten op de mens en menselijk lichaamsmateriaal
 Inhoudstafel per onderwerp volume 2 experimenten op de mens en menselijk lichaamsmateriaal Pharma Codex Deel I vol. 2 vii Voor de bijlagen bij de omzendbrieven en de nota s, raadpleeg de website van het
Inhoudstafel per onderwerp volume 2 experimenten op de mens en menselijk lichaamsmateriaal Pharma Codex Deel I vol. 2 vii Voor de bijlagen bij de omzendbrieven en de nota s, raadpleeg de website van het
DIFFERENT STEPS IN DRUG DEVELOPMENT: FROM THEORETICAL CONCEPT TO ACCESS FOR PATIENTS ROLE OF THE ETHICAL COMMITTEES
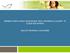 DIFFERENT STEPS IN DRUG DEVELOPMENT: FROM THEORETICAL CONCEPT TO ACCESS FOR PATIENTS ROLE OF THE ETHICAL COMMITTEES Klinische trials Verplicht vooraleer een geneesmiddel een marketing autorisatie kan krijgen
DIFFERENT STEPS IN DRUG DEVELOPMENT: FROM THEORETICAL CONCEPT TO ACCESS FOR PATIENTS ROLE OF THE ETHICAL COMMITTEES Klinische trials Verplicht vooraleer een geneesmiddel een marketing autorisatie kan krijgen
Verdiepende sessie Klinisch onderzoek MHM
 Verdiepende sessie Klinisch onderzoek MHM Opbrengsten en actiepunten Woensdag 14 februari 2018 Sufficient clinical evidence Wat is voldoende klinisch bewijs (voor medische hulpmiddelen zonder directe relatie
Verdiepende sessie Klinisch onderzoek MHM Opbrengsten en actiepunten Woensdag 14 februari 2018 Sufficient clinical evidence Wat is voldoende klinisch bewijs (voor medische hulpmiddelen zonder directe relatie
Wetenschappelijk onderzoek met Karakter
 Wetenschappelijk onderzoek met Karakter 1 Inleiding Karakter is als academisch centrum partner in een groot aantal multicenter studies. Voor het uitvoeren van uw onderzoek in samenwerking met Karakter
Wetenschappelijk onderzoek met Karakter 1 Inleiding Karakter is als academisch centrum partner in een groot aantal multicenter studies. Voor het uitvoeren van uw onderzoek in samenwerking met Karakter
Vragen en antwoorden over de gegevenssectie van de model-pif
 Vragen en antwoorden over de gegevenssectie van de model-pif Algemene informatie over de Algemene Verordening Gegevensbescherming Waar vind ik algemene informatie over de gevolgen van de Algemene Verordening
Vragen en antwoorden over de gegevenssectie van de model-pif Algemene informatie over de Algemene Verordening Gegevensbescherming Waar vind ik algemene informatie over de gevolgen van de Algemene Verordening
European Clinical Trial Regulation: Kans voor Nederland. Annelies van Woudenberg, ClinOps-dag NVFG, 20 april 2017
 European Clinical Trial Regulation: Kans voor Nederland Annelies van Woudenberg, ClinOps-dag NVFG, 20 april 2017 2 Dutch Clinical Research Foundation (DCRF) Doel ECTR project In oktober 2018 is Nederland
European Clinical Trial Regulation: Kans voor Nederland Annelies van Woudenberg, ClinOps-dag NVFG, 20 april 2017 2 Dutch Clinical Research Foundation (DCRF) Doel ECTR project In oktober 2018 is Nederland
Wat brengt de ECTR 536/2014 de patiënt & onderzoeker
 Wat brengt de ECTR 536/2014 de patiënt & onderzoeker Veronica van Nederveen, patient advocate Patientenstem.nu Thera Max, Sanofi, team manager Clinical Study Unit, namens Vereniging Innovatieve Geneesmiddelen
Wat brengt de ECTR 536/2014 de patiënt & onderzoeker Veronica van Nederveen, patient advocate Patientenstem.nu Thera Max, Sanofi, team manager Clinical Study Unit, namens Vereniging Innovatieve Geneesmiddelen
 ------------------------------------------------------------------------------------------------------------------------------------------- Concept Procedure Lokale Haalbaarheid klinisch geneesmiddelenonderzoek
------------------------------------------------------------------------------------------------------------------------------------------- Concept Procedure Lokale Haalbaarheid klinisch geneesmiddelenonderzoek
Cijfers jaarverslag CCMO 2015
 Cijfers jaarverslag CCMO 2015 Bron ToetsingOnline Peildatum 19 januari 2016 Sortering 2015 De commissies zijn gerangschikt naar het aantal besluiten dat zij over 2015 namen De cijfers Aan de in het Excel
Cijfers jaarverslag CCMO 2015 Bron ToetsingOnline Peildatum 19 januari 2016 Sortering 2015 De commissies zijn gerangschikt naar het aantal besluiten dat zij over 2015 namen De cijfers Aan de in het Excel
Standard Operating Procedure
 Standard Operating Procedure STZ SOP: U8 Melding van (Serious) Adverse Events en SUSARs Distributielijst : STZ Datum : 19-06-2014 Revisiedatum : 19-06-2015 Veranderingen ten opzichte van eerdere versies
Standard Operating Procedure STZ SOP: U8 Melding van (Serious) Adverse Events en SUSARs Distributielijst : STZ Datum : 19-06-2014 Revisiedatum : 19-06-2015 Veranderingen ten opzichte van eerdere versies
Aanvraagformulier Ethisch advies voor experimenten op de menselijke persoon
 groep emmaüs christelijke vereniging voor gezondheids- en welzijnszorg ETHISCH COMITÉ Edgard Tinellaan 1c 2800 MECHELEN Tel. : 015 44 67 21 Fax : 015 44 67 10 Erkenningsnummer: 0G 066 Aanvraagformulier
groep emmaüs christelijke vereniging voor gezondheids- en welzijnszorg ETHISCH COMITÉ Edgard Tinellaan 1c 2800 MECHELEN Tel. : 015 44 67 21 Fax : 015 44 67 10 Erkenningsnummer: 0G 066 Aanvraagformulier
Bijlage 2 bij het Convenant PSI Samenstelling en werkwijze toetsingscommissie
 Bijlage 2 bij het Convenant PSI Samenstelling en werkwijze toetsingscommissie 1. Samenstelling toetsingscommissie De kerncommissie betstaat uit leden met ten minste de volgende specialismes 1 : Arts of
Bijlage 2 bij het Convenant PSI Samenstelling en werkwijze toetsingscommissie 1. Samenstelling toetsingscommissie De kerncommissie betstaat uit leden met ten minste de volgende specialismes 1 : Arts of
Aanmelden medischwetenschappelijk
 Aanmelden medischwetenschappelijk onderzoek SOP Aanmelden WMO-plichtig onderzoek_versie juli 2016.doc Pagina 1 van 10 Aanmelden WMO-plichtig onderzoek 1. Doel Het beschrijven van de procedure die gevolgd
Aanmelden medischwetenschappelijk onderzoek SOP Aanmelden WMO-plichtig onderzoek_versie juli 2016.doc Pagina 1 van 10 Aanmelden WMO-plichtig onderzoek 1. Doel Het beschrijven van de procedure die gevolgd
Handleiding. Investigational Medicinal Product Dossier (IMPD)
 Handleiding Investigational Medicinal Product Dossier (IMPD) Inhoudsopgave Afkortingen... - 3 - Wat is het IMPD?... - 4 - Beslisschema inhoud IMPD... - 5 - Beschrijving inhoud IMPD... - 6 - Overzicht hoofdstukken
Handleiding Investigational Medicinal Product Dossier (IMPD) Inhoudsopgave Afkortingen... - 3 - Wat is het IMPD?... - 4 - Beslisschema inhoud IMPD... - 5 - Beschrijving inhoud IMPD... - 6 - Overzicht hoofdstukken
Welkom. Klinisch geneesmiddelenonderzoek: samen sneller! Denk je mee?
 Welkom Klinisch geneesmiddelenonderzoek: samen sneller! Denk je mee? WELKOM! De ACRON, een introductie ACRON introductie Vereniging, opgericht in 1995 44 leden, 1,200 medewerkers Branche-vereniging Belangenbehartiging
Welkom Klinisch geneesmiddelenonderzoek: samen sneller! Denk je mee? WELKOM! De ACRON, een introductie ACRON introductie Vereniging, opgericht in 1995 44 leden, 1,200 medewerkers Branche-vereniging Belangenbehartiging
Richtlijnen voor onderzoek. met vrijwilligers in het AMC. met geneesmiddelen, hulpmiddelen of ingrepen die niet eerder bij de mens zijn toegepast
 Richtlijnen voor onderzoek met vrijwilligers in het AMC en met geneesmiddelen, hulpmiddelen of ingrepen die niet eerder bij de mens zijn toegepast bij patiënten in het AMC augustus 2008 Inhoud Inleiding
Richtlijnen voor onderzoek met vrijwilligers in het AMC en met geneesmiddelen, hulpmiddelen of ingrepen die niet eerder bij de mens zijn toegepast bij patiënten in het AMC augustus 2008 Inhoud Inleiding
Model Verklaring lokale uitvoerbaarheid instellingsleiding (bij Richtlijn Externe Toetsing)
 Model Verklaring lokale uitvoerbaarheid instellingsleiding (bij Richtlijn Externe Toetsing) Aan de indiener van het onderzoeksdossier getiteld: Chronic pain experience in Down syndrome, with and without
Model Verklaring lokale uitvoerbaarheid instellingsleiding (bij Richtlijn Externe Toetsing) Aan de indiener van het onderzoeksdossier getiteld: Chronic pain experience in Down syndrome, with and without
Eerste Kamer der Staten-Generaal
 Eerste Kamer der Staten-Generaal 1 Vergaderjaar 2016 2017 34 429 Wijziging van de Wet medisch-wetenschappelijk onderzoek met mensen en de Geneesmiddelenwet in verband met de uitvoering van verordening
Eerste Kamer der Staten-Generaal 1 Vergaderjaar 2016 2017 34 429 Wijziging van de Wet medisch-wetenschappelijk onderzoek met mensen en de Geneesmiddelenwet in verband met de uitvoering van verordening
Standard Operating Procedure
 Standard Operating Procedure STZ SOP: U4 Registratie /randomisatie procedure Distributielijst : STZ Datum : 19-06-2014 Revisiedatum : 19-06-2015 Veranderingen ten opzichte van eerdere versies Versiedatum
Standard Operating Procedure STZ SOP: U4 Registratie /randomisatie procedure Distributielijst : STZ Datum : 19-06-2014 Revisiedatum : 19-06-2015 Veranderingen ten opzichte van eerdere versies Versiedatum
s-hertogenbosch 26 mei 2014 Een nieuw
 s-hertogenbosch 26 mei 2014 Een nieuw Toetsingstijdperk Een onderzoek naar de gevolgen van de nieuwe Europese Verordening voor de toetsing van medisch wetenschappelijk onderzoek met geneesmiddelen in Nederland
s-hertogenbosch 26 mei 2014 Een nieuw Toetsingstijdperk Een onderzoek naar de gevolgen van de nieuwe Europese Verordening voor de toetsing van medisch wetenschappelijk onderzoek met geneesmiddelen in Nederland
Eerste Kamer der Staten-Generaal
 Eerste Kamer der Staten-Generaal Vergaderjaar 20 202 3 452 Wijziging van de Wet medisch-wetenschappelijk onderzoek met mensen in verband met de evaluatie van deze wet en herstel van onvolledige implementatie
Eerste Kamer der Staten-Generaal Vergaderjaar 20 202 3 452 Wijziging van de Wet medisch-wetenschappelijk onderzoek met mensen in verband met de evaluatie van deze wet en herstel van onvolledige implementatie
Rapport Institutioneel Onderzoek
 Rapport Institutioneel Onderzoek Beleidsterrein patiëntenbeleid / Wet medisch-wetenschappelijk onderzoek met mensen Behorend bij het Basisselectiedocument voor de neerslag van de handelingen van de Medisch
Rapport Institutioneel Onderzoek Beleidsterrein patiëntenbeleid / Wet medisch-wetenschappelijk onderzoek met mensen Behorend bij het Basisselectiedocument voor de neerslag van de handelingen van de Medisch
Tweede Kamer der Staten-Generaal
 Tweede Kamer der Staten-Generaal 2 Vergaderjaar 2014 2015 33 508 Wijziging van de Wet medisch-wetenschappelijk onderzoek met mensen in verband met het wijzigen van de mogelijkheden voor het verrichten
Tweede Kamer der Staten-Generaal 2 Vergaderjaar 2014 2015 33 508 Wijziging van de Wet medisch-wetenschappelijk onderzoek met mensen in verband met het wijzigen van de mogelijkheden voor het verrichten
Handleiding Goedkeuringsprocedure Raad van Bestuur Zuyderland voor wetenschappelijk onderzoek
 Handleiding Goedkeuringsprocedure Raad van Bestuur Zuyderland voor wetenschappelijk onderzoek Deze handleiding wordt voortdurend geupdate naar aanleiding van de meest recente wet- en regelgeving en wijzigingen
Handleiding Goedkeuringsprocedure Raad van Bestuur Zuyderland voor wetenschappelijk onderzoek Deze handleiding wordt voortdurend geupdate naar aanleiding van de meest recente wet- en regelgeving en wijzigingen
Toezicht op klinisch onderzoek - bevindingen vanuit de praktijk
 Toezicht op klinisch onderzoek - bevindingen vanuit de praktijk Namens Deelprogramma Klinisch Onderzoek, IGZ Spreker Dr. ir. J. Eland-Gerritsen Coördinerend/Specialistisch Senior inspecteur Inhoud Toezicht
Toezicht op klinisch onderzoek - bevindingen vanuit de praktijk Namens Deelprogramma Klinisch Onderzoek, IGZ Spreker Dr. ir. J. Eland-Gerritsen Coördinerend/Specialistisch Senior inspecteur Inhoud Toezicht
Adviesaanvraag betreffende een protocol van een klinische proef of experiment
 Ethische Commissie UVC Brugmann Adviesaanvraag betreffende een protocol van een klinische proef of experiment Aanvraag te richten aan Dr J. VALSAMIS Ethische Commissie UVC Brugmann c/o Medische Directie
Ethische Commissie UVC Brugmann Adviesaanvraag betreffende een protocol van een klinische proef of experiment Aanvraag te richten aan Dr J. VALSAMIS Ethische Commissie UVC Brugmann c/o Medische Directie
Tweede Kamer der Staten-Generaal
 Tweede Kamer der Staten-Generaal 2 Vergaderjaar 2010 2011 31 452 Wijziging van de Wet medisch-wetenschappelijk onderzoek met mensen in verband met de evaluatie van deze wet en herstel van onvolledige implementatie
Tweede Kamer der Staten-Generaal 2 Vergaderjaar 2010 2011 31 452 Wijziging van de Wet medisch-wetenschappelijk onderzoek met mensen in verband met de evaluatie van deze wet en herstel van onvolledige implementatie
Monitorplan voorbeeld
 Monitorplan voorbeeld Protocol Er moet in het protocol beschreven worden dat er monitoring plaatsvindt (zie ook CCMO voorbeeld template). Het monitoringplan mag als bijlage worden toegevoegd (in dat geval
Monitorplan voorbeeld Protocol Er moet in het protocol beschreven worden dat er monitoring plaatsvindt (zie ook CCMO voorbeeld template). Het monitoringplan mag als bijlage worden toegevoegd (in dat geval
nwmo toetsingskader Eveline Loriaux projectleider 4 oktober 2017 Jaarcongres DCRF
 nwmo toetsingskader Eveline Loriaux projectleider 4 oktober 2017 Jaarcongres DCRF Zien we door de bomen nog het bos? nwmo Toetsingskader Overzicht Start: juli 2015 In 2017 zijn 39 aanvragen ingediend
nwmo toetsingskader Eveline Loriaux projectleider 4 oktober 2017 Jaarcongres DCRF Zien we door de bomen nog het bos? nwmo Toetsingskader Overzicht Start: juli 2015 In 2017 zijn 39 aanvragen ingediend
Includeer hem maar in de studie. De familie is onderweg!
 Includeer hem maar in de studie. De familie is onderweg! Ethiek van toestemming voor onderzoek in spoedeisende situaties dr Erwin J.O. Kompanje Department of Intensive Care Spoedeisend onderzoek op intensive
Includeer hem maar in de studie. De familie is onderweg! Ethiek van toestemming voor onderzoek in spoedeisende situaties dr Erwin J.O. Kompanje Department of Intensive Care Spoedeisend onderzoek op intensive
Bijgaand ontvangt u het primaire besluit van de commissie over het hierna vermelde onderzoek.
 Medisch :' i < r. c Toetsingscommissie Noord-Holland t AMC Orthopedie A.J. Kievit Staalmeesterslaan 271 1057 NZ Amsterdam datum kenmerk METC- registratie CCMO-registratie EudraCTnummer 30 oktober 2012
Medisch :' i < r. c Toetsingscommissie Noord-Holland t AMC Orthopedie A.J. Kievit Staalmeesterslaan 271 1057 NZ Amsterdam datum kenmerk METC- registratie CCMO-registratie EudraCTnummer 30 oktober 2012
Standard Operating Procedure
 Standard Operating Procedure STZ SOP: A1 Afsluiting studie Distributielijst : STZ Datum : 03-06-2014 Revisiedatum : 03-06-2015 Veranderingen ten opzichte van eerdere versies Versiedatum Opmerkingen Versiedatum
Standard Operating Procedure STZ SOP: A1 Afsluiting studie Distributielijst : STZ Datum : 03-06-2014 Revisiedatum : 03-06-2015 Veranderingen ten opzichte van eerdere versies Versiedatum Opmerkingen Versiedatum
Tweede Kamer der Staten-Generaal
 Tweede Kamer der Staten-Generaal 2 Vergaderjaar 2009 200 32 23 XVI Vaststelling van de begrotingsstaten van het Ministerie van Volksgezondheid, Welzijn en Sport (XVI) voor het jaar 200 Nr. 30 BRIEF VAN
Tweede Kamer der Staten-Generaal 2 Vergaderjaar 2009 200 32 23 XVI Vaststelling van de begrotingsstaten van het Ministerie van Volksgezondheid, Welzijn en Sport (XVI) voor het jaar 200 Nr. 30 BRIEF VAN
Verzoek tot advies van de Commissie Medische Ethiek betreffende een klinische studie
 Titel van het onderzoek: EudraCT nummer, indien van toepassing: Arts-onderzoeker HHZH Lier + medische discipline: PI (Naam, adres, tel en e-mail): Sponsor (Naam, contactpersoon, adres, tel en e-mail):
Titel van het onderzoek: EudraCT nummer, indien van toepassing: Arts-onderzoeker HHZH Lier + medische discipline: PI (Naam, adres, tel en e-mail): Sponsor (Naam, contactpersoon, adres, tel en e-mail):
Monitoring van Investigator Initiated onderzoek
 Monitoring van Investigator Initiated onderzoek V1.0 Angela Vlug Clinical Research Bureau VUmc Wat is een IIS (volgens de NFU) Onderzoek waarvoor de raad van bestuur van een (universitair) medisch centrum
Monitoring van Investigator Initiated onderzoek V1.0 Angela Vlug Clinical Research Bureau VUmc Wat is een IIS (volgens de NFU) Onderzoek waarvoor de raad van bestuur van een (universitair) medisch centrum
1. Er is sprake van medisch wetenschappelijk onderzoek én
 Normen voor toetsing nwmo onderzoek Introductie De gezondheidszorg is gebaat bij het plaatsvinden van verantwoord medisch- wetenschappelijk onderzoek. Voor onderzoek dat onder de Wet Medisch Wetenschappelijk
Normen voor toetsing nwmo onderzoek Introductie De gezondheidszorg is gebaat bij het plaatsvinden van verantwoord medisch- wetenschappelijk onderzoek. Voor onderzoek dat onder de Wet Medisch Wetenschappelijk
Geneesmiddelenonderzoek en de ziekenhuisapotheek
 Geneesmiddelenonderzoek en de ziekenhuisapotheek Pierre Bet ziekenhuisapotheker Klinische Farmacologie & Apotheek VU medisch centrum feb 2011 Inhoud Verantwoordelijkheden Bereiding van IMP Voortraject
Geneesmiddelenonderzoek en de ziekenhuisapotheek Pierre Bet ziekenhuisapotheker Klinische Farmacologie & Apotheek VU medisch centrum feb 2011 Inhoud Verantwoordelijkheden Bereiding van IMP Voortraject
Procedure deelnemend aan multicenter WMO-plichtig klinisch wetenschappelijk onderzoek
 Wetenschappelijk onderzoek in het Elisabeth-TweeSteden Ziekenhuis Procedure deelnemend aan multicenter WMO-plichtig klinisch wetenschappelijk onderzoek Bij dit type onderzoek neemt de onderzoeker van het
Wetenschappelijk onderzoek in het Elisabeth-TweeSteden Ziekenhuis Procedure deelnemend aan multicenter WMO-plichtig klinisch wetenschappelijk onderzoek Bij dit type onderzoek neemt de onderzoeker van het
Procedure multicenter WMO-plichtig klinisch wetenschappelijk onderzoek geïnitieerd vanuit het Elisabeth-TweeSteden Ziekenhuis
 Wetenschappelijk onderzoek in het Elisabeth-TweeSteden Ziekenhuis Procedure multicenter WMO-plichtig klinisch wetenschappelijk onderzoek geïnitieerd vanuit het Elisabeth-TweeSteden Ziekenhuis Bij dit type
Wetenschappelijk onderzoek in het Elisabeth-TweeSteden Ziekenhuis Procedure multicenter WMO-plichtig klinisch wetenschappelijk onderzoek geïnitieerd vanuit het Elisabeth-TweeSteden Ziekenhuis Bij dit type
Standard Operating Procedure
 Standard Operating Procedure STZ SOP: VC2 Ontwikkelen proefpersoneninformatie / toestemmingsformulier (centraal) Distributielijst : STZ Datum : 18-02-2014 Revisiedatum : 18-02-2015 Veranderingen ten opzichte
Standard Operating Procedure STZ SOP: VC2 Ontwikkelen proefpersoneninformatie / toestemmingsformulier (centraal) Distributielijst : STZ Datum : 18-02-2014 Revisiedatum : 18-02-2015 Veranderingen ten opzichte
