Standard Operating Procedure
|
|
|
- Renée de Boer
- 6 jaren geleden
- Aantal bezoeken:
Transcriptie
1 Standard Operating Procedure STZ SOP: VL2 Aanpassen proefpersoneninformatie / toestemmingsformulier aan lokale situatie Distributielijst : STZ Datum : Revisiedatum : Veranderingen ten opzichte van eerdere versies Versiedatum Opmerkingen Versiedatum Opmerkingen Naam SOP, jaarlijkse revisie, administratieve wijzigingen Versiedatum Pagina 1 van 5
2 1. Doel Het beschrijven van de procedure om een centraal verstrekte proefpersoneninformatie en toestemmingsformulier aan te passen aan de lokale situatie middels locatie specifieke gegevens in aparte bijlagen. 2. Afkortingen, definities en termen METC SOP WMO Medisch Ethische Toetsingscommissie Standard Operating Procedure Wet Medisch-wetenschappelijk Onderzoek met mensen CCMO: De CCMO is het overkoepelende orgaan van alle Medisch Ethische Toetsingscommissies in Nederland en de bevoegde instantie (competent authority) voor geneesmiddelenonderzoek. De CCMO waarborgt de bescherming van proefpersonen betrokken bij medisch-wetenschappelijk onderzoek, middels toetsing aan de daarvoor vastgestelde wettelijke bepalingen en met inachtneming van de voortgang van de medische wetenschap. Tevens fungeren zij als centraal toetsende commissie in specifieke gevallen. Informed consent: Een werkwijze waarbij een proefpersoon zich vrijwillig bereid verklaart deel te nemen aan een bepaald onderzoek, na te zijn ingelicht over alle aspecten van het onderzoek die relevant zijn voor de beslissing van de proefpersoon om deel te nemen. Informed consent wordt gedocumenteerd door middel van een ingevuld, ondertekend en van een datum voorzien formulier voor informed consent. Medisch Ethische Toetsingscommissie (METC): Een zelfstandig en onafhankelijk bestuursorgaan (instellings-, regionale, nationale of supranationale beoordelingsraad of commissie), bestaande uit medici, wetenschappers en niet-medici/wetenschappers, dat de verantwoordelijkheid heeft er voor te zorgen dat de rechten, veiligheid en het welzijn van de proefpersonen in een onderzoek worden zeker gesteld. Deze bescherming moet openbaar worden gewaarborgd door onder andere het beoordelen van en een positief oordeel geven over het onderzoeksprotocol, de geschiktheid van de onderzoekers, de faciliteiten en de methoden en het materiaal dat zal worden gebruikt om het informed consent van de proefpersonen te verkrijgen en te documenteren. Investigator / onderzoeker: De persoon die verantwoordelijk is voor de uitvoering van een klinisch onderzoek op één onderzoekslocatie. De onderzoeker die landelijk verantwoordelijk is voor de studie wordt de CCI (country co-ordinating investigator) genoemd. Als een klinisch onderzoek op één onderzoekslocatie door één team van personen wordt uitgevoerd dan is de onderzoeker de verantwoordelijke teamleider en kan deze als hoofdonderzoeker (principal investigator; PI) worden aangeduid. Proefpersoneninformatie: Document dat de proefpersoon schriftelijk informeert over het onderzoek. De proefpersoneninformatie is vaak gekoppeld aan het Informed Consent Formulier (ICF). Protocol: Een document waarin doelstelling(en), opzet, methodologie, statistische overwegingen en organisatie van een onderzoek staan beschreven. Het protocol beschrijft doorgaans ook de achtergrond van en de verantwoording voor het onderzoeksproject, maar deze kunnen ook in de andere documenten, waarnaar in het protocol wordt verwezen, zijn opgenomen. In het ICH GCP richtsnoer verwijst de term protocol zowel naar protocol als naar protocolamendementen. Standard Operating Procedure (SOP): Dit zijn gedetailleerde schriftelijke instructies om uniformiteit te bereiken in de uitvoering van een bepaalde taak. Sponsor/verrichter: Een persoon, bedrijf, instelling of organisatie die de verantwoordelijkheid neemt voor het initiëren, organiseren en/of financieren van een klinisch onderzoek. In de WMO spreekt men van verrichter als zijnde diegene die opdracht heeft gegeven voor de organisatie en/of uitvoering van een klinisch onderzoek. Versiedatum Pagina 2 van 5
3 WMO: De WMO heeft tot doel het beschermen van de proefpersonen die deelnemen aan medisch wetenschappelijk onderzoek waarbij personen aan handelingen worden onderworpen of hen gedragregels worden opgelegd. In de praktijk betekent dit dat onderzoek waarbij op de een of andere manier inbreuk wordt gemaakt op de integriteit van personen onder de wet valt. Bijzondere aandacht schenkt de wet aan het onderzoek met wilsonbekwame mensen. 3. Verantwoordelijkheden Hieronder worden de verantwoordelijkheden van de verschillende partijen met betrekking tot deze STZ SOP VL2 Aanpassen proefpersoneninformatie / toestemmingsformulier aan lokale situatie beschreven. Sponsor/verrichter/investigator is eindverantwoordelijk voor: het aanpassen met betrekking tot de locatiespecifieke informatie in de het beschikken over het positieve oordeel van de METC met betrekking tot de het beschikken over een schriftelijk vastgelegde toestemming van de raad van bestuur voor de start van het onderzoek. METC is eindverantwoordelijk voor: het waarborgen van de rechten, de veiligheid en het welzijn van alle proefpersonen die deelnemen aan klinische onderzoeken en het correct beschrijven daarvan in de proefpersoneninformatie en toestemmingsformulier; het verzoek om meer informatie te geven aan de proefpersonen als, naar het oordeel van de oordelende toetsingscommissie, deze aanvullende informatie wezenlijk bijdraagt tot de bescherming van de rechten, de veiligheid en/of het welzijn van de proefpersonen; het geven van een gedagtekend schriftelijk positief oordeel over de aangepaste het schriftelijk vastleggen welke documenten zijn beoordeeld en de versiedatums hiervan. Raad van bestuur is eindverantwoordelijk voor: het geven van schriftelijke toestemming voor de start van het onderzoek op basis van een positief oordeel over de locatiespecifieke gegevens in de proefpersoneninformatie, het toestemmingsformulier en alle andere schriftelijke informatie die aan de proefpersonen wordt verstrekt. Versiedatum Pagina 3 van 5
4 4. Stroomdiagram 5.1 Protocol centraal goedgekeurd Volg STZ SOP VC6 5.2 ICF bevat locatie specifieke gegevens Aanpassen proefpersonen bijlages Akkoord sponsor (indien van toepassing) 5.3 Versie aanbieden aan Raad van Bestuur STZ SOP VL1 5. Werkwijze 5.1. De sponsor/verrichter/investigator van een studie zorgt voor een door een METC goedgekeurd protocol. Naast dit protocol dient er een centraal goedgekeurde proefpersoneninformatie / toestemmingsformulier te zijn. Beide documenten zijn beoordeeld door de oordelende METC van de betreffende studie. Mocht het protocol niet centraal goedgekeurd zijn dan moet STZ SOP VC6 Beoordeling toetsende commissie (centraal) uitgevoerd worden De proefpersoneninformatie / toestemmingsformulier bevat voor alle deelnemende centra één hoofdtekst. Locatie specifieke informatie die per deelnemend centrum kan verschillen dient in aparte bijlagen te zijn opgenomen. Zoals de namen van uitvoerend personeel, contactgegevens van de uitvoerder, contactgegevens van de researchverpleegkundige, evt. onafhankelijk arts en de verzekeraar van de WMO-proefpersonenverzekering. De lokale proefpersoneninformatie en het toestemmingsformulier moeten voorzien zijn van een datumaanduiding ofwel in het briefhoofd ofwel een versieaanduiding in bijvoorbeeld een kop- of een voettekst. Tevens dient de eerste pagina van de proefpersoneninformatie / toestemmingsformulier voorzien te zijn van het ziekenhuislogo. Indien de raad van bestuur aanvullende eisen heeft opgesteld waaraan de lokaal aangepaste proefpersoneninformatie / toestemmingsformulier moet voldoen dan staat deze genoemd in bijlage 9. Dit lokaal gegenereerde document moet door de sponsor (indien van toepassing) goedgekeurd worden voordat het aangeboden kan worden aan de raad van bestuur De proefpersoneninformatie / toestemmingsformulier die volgens de criteria van het ziekenhuis aangepast is, moet aan de raad van bestuur voorgelegd worden. In STZ SOP VL1 Beoordeling raad van bestuur (lokaal, inclusief financiële verantwoording) staat beschreven wat hiervoor de procedure is. Een positief oordeel van de oordelende METC en een goedkeuring van de raad van bestuur moeten binnen zijn alvorens de goedgekeurde versie voor het ziekenhuis van de proefpersoneninformatie / toestemmingsformulier gebruikt mag Versiedatum Pagina 4 van 5
5 worden. De onderzoeker mag niet starten met het includeren van patiënten voordat er een voor het ziekenhuis goedgekeurde versie is. Noot: Alleen daar waar sprake is van een voor de proefpersonen relevant verschil in de uitvoering van het onderzoek voor bepaalde deelnemende centra, kunnen wijzigingen voor die centra in de hoofdtekst van de informatie goedgekeurd worden. 6. Archivering De lokaal aangepaste proefpersoneninformatie en toestemmingsformulier dienen gearchiveerd te worden in de Investigator site file en in het archief van de sponsor. Zie verder voor archivering STZ SOP A2 Archiveren studie. 7. Referenties Richtsnoer voor Good Clinical Practice (CPMP/ICH/135/95), officiële Nederlandse vertaling Wet Medisch-wetenschappelijk Onderzoek met mensen Website van de CCMO ( STZ SOP VC2: Ontwikkelen proefpersoneninformatie / toestemmingsformulier (centraal) STZ SOP VC6: Beoordeling toetsende commissie (centraal) STZ SOP VL1: Beoordeling raad van bestuur (lokaal, inclusief financiële verantwoording) STZ SOP A2: Archiveren studie 8. Literatuur Richtsnoer voor Good Clinical Practice (CPMP/ICH/135/95), officiële Nederlandse vertaling Website van de CCMO ( 9. Bijlage(n) 10. MGG specifiek Voor lokale toestemming in MGG is er een specifieke bijlage opgesteld. Deze staat op de website bij Wetenschap onder lokale toestemming rvb. Met de komst van een wettelijk kader voor de toetsing van medisch-wetenschappelijk onderzoek met mensen is ook de behoefte ontstaan aan harmonisering van die beoordeling. Een belangrijk onderdeel daarbij vormt de toetsing van gespreid uitgevoerd onderzoek, ook wel multicenter-onderzoek. Naast de medisch-ethische toets (uitgevoerd door een METC) dient ook te worden vastgesteld of het onderzoek op een bepaalde locatie kan worden uitgevoerd (bekend als de 'oude lokale uitvoerbaarheidstoets'). Dit staat omschreven in de Richtlijn Externe Toetsing (RET) van de CCMO welke per 1 maart is geïmplementeerd. Voor meer informatie zie tevens de brochure van de CCMO. In deze nieuwe versie van de richtlijn staat de voorwaarde dat voor multicenteronderzoek één hoofdtekst van de proefpersoneninformatie wordt betrokken in de beoordeling. Achtergrond is de onwenselijkheid dat naar eigen inzicht en voorkeur per centrum steeds voorstellen voor wijziging van de tekst worden aangedragen en moeten worden beoordeeld. De locatie specifieke gegevens die zijn opgenomen in een bijlage van het proefpersoneninformatieformulier zijn vanzelfsprekend verschillend. Door de locatie specifieke gegevens in een bijlage op te nemen wordt voorkomen dat ook de hoofdtekst van het onderzoek opnieuw ter discussie komt te staan bij wijziging van de lokale gegevens, en wordt een eenduidig beeld voor alle proefpersonen in het onderzoek geschetst. Versiedatum Pagina 5 van 5
Standard Operating Procedure
 Standard Operating Procedure STZ SOP: VL5 Protocolamendement (lokaal) Distributielijst : STZ Datum : 03-06-2014 Revisiedatum : 03-06-2015 Veranderingen ten opzichte van eerdere versies Versiedatum Opmerkingen
Standard Operating Procedure STZ SOP: VL5 Protocolamendement (lokaal) Distributielijst : STZ Datum : 03-06-2014 Revisiedatum : 03-06-2015 Veranderingen ten opzichte van eerdere versies Versiedatum Opmerkingen
Standard Operating Procedure
 Standard Operating Procedure STZ SOP: VC8 Beoordeling amendement toetsende commissie (centraal) Distributielijst : STZ Datum : 10-03-2014 Revisiedatum : 10-03-2015 Veranderingen ten opzichte van eerdere
Standard Operating Procedure STZ SOP: VC8 Beoordeling amendement toetsende commissie (centraal) Distributielijst : STZ Datum : 10-03-2014 Revisiedatum : 10-03-2015 Veranderingen ten opzichte van eerdere
Standard Operating Procedure
 Standard Operating Procedure STZ SOP: U11 Voortgangsrapportage Distributielijst : STZ Datum : 19-06-2014 Revisiedatum : 19-06-2015 Veranderingen ten opzichte van eerdere versies Versiedatum Opmerkingen
Standard Operating Procedure STZ SOP: U11 Voortgangsrapportage Distributielijst : STZ Datum : 19-06-2014 Revisiedatum : 19-06-2015 Veranderingen ten opzichte van eerdere versies Versiedatum Opmerkingen
Standard Operating Procedure
 Standard Operating Procedure STZ SOP: VC9 Proefpersonen- en aansprakelijkheidsverzekering (centraal) Distributielijst : STZ Datum : 10-03-2014 Revisiedatum : 10-03-2015 Veranderingen ten opzichte van eerdere
Standard Operating Procedure STZ SOP: VC9 Proefpersonen- en aansprakelijkheidsverzekering (centraal) Distributielijst : STZ Datum : 10-03-2014 Revisiedatum : 10-03-2015 Veranderingen ten opzichte van eerdere
Standard Operating Procedure
 Standard Operating Procedure STZ SOP: U1 Identificatie, werving en pre-screening proefpersonen Distributielijst : STZ Datum : 19-06-2014 Revisiedatum : 19-06-2015 Veranderingen ten opzichte van eerdere
Standard Operating Procedure STZ SOP: U1 Identificatie, werving en pre-screening proefpersonen Distributielijst : STZ Datum : 19-06-2014 Revisiedatum : 19-06-2015 Veranderingen ten opzichte van eerdere
Standard Operating Procedure
 Standard Operating Procedure STZ SOP: U9 Monitoren Distributielijst : STZ Datum : 15-10-2012 Revisiedatum : 15-10-2013 Veranderingen ten opzichte van eerdere versies Versiedatum Hoofdstuk Versiedatum Hoofdstuk
Standard Operating Procedure STZ SOP: U9 Monitoren Distributielijst : STZ Datum : 15-10-2012 Revisiedatum : 15-10-2013 Veranderingen ten opzichte van eerdere versies Versiedatum Hoofdstuk Versiedatum Hoofdstuk
Standard Operating Procedure
 Standard Operating Procedure STZ SOP: U10 Audit Distributielijst : STZ Datum : 19-06-2014 Revisiedatum : 19-06-2015 Veranderingen ten opzichte van eerdere versies Versiedatum Opmerkingen Versiedatum Opmerkingen
Standard Operating Procedure STZ SOP: U10 Audit Distributielijst : STZ Datum : 19-06-2014 Revisiedatum : 19-06-2015 Veranderingen ten opzichte van eerdere versies Versiedatum Opmerkingen Versiedatum Opmerkingen
Standard Operating Procedure
 Standard Operating Procedure STZ SOP: U4 Registratie /randomisatie procedure Distributielijst : STZ Datum : 19-06-2014 Revisiedatum : 19-06-2015 Veranderingen ten opzichte van eerdere versies Versiedatum
Standard Operating Procedure STZ SOP: U4 Registratie /randomisatie procedure Distributielijst : STZ Datum : 19-06-2014 Revisiedatum : 19-06-2015 Veranderingen ten opzichte van eerdere versies Versiedatum
Standard Operating Procedure
 Standard Operating Procedure STZ SOP: U2 Informed consent Distributielijst : STZ Datum : 19-06-2014 Revisiedatum : 19-06-2015 Veranderingen ten opzichte van eerdere versies Versiedatum Opmerkingen Versiedatum
Standard Operating Procedure STZ SOP: U2 Informed consent Distributielijst : STZ Datum : 19-06-2014 Revisiedatum : 19-06-2015 Veranderingen ten opzichte van eerdere versies Versiedatum Opmerkingen Versiedatum
Standard Operating Procedure
 Standard Operating Procedure STZ SOP: A1 Afsluiting studie Distributielijst : STZ Datum : 03-06-2014 Revisiedatum : 03-06-2015 Veranderingen ten opzichte van eerdere versies Versiedatum Opmerkingen Versiedatum
Standard Operating Procedure STZ SOP: A1 Afsluiting studie Distributielijst : STZ Datum : 03-06-2014 Revisiedatum : 03-06-2015 Veranderingen ten opzichte van eerdere versies Versiedatum Opmerkingen Versiedatum
Standard Operating Procedure
 Standard Operating Procedure STZ SOP: U7 Ondersteunende diensten Distributielijst : STZ Datum : 19-06-2014 Revisiedatum : 19-06-2015 Veranderingen ten opzichte van eerdere versies Versiedatum Opmerkingen
Standard Operating Procedure STZ SOP: U7 Ondersteunende diensten Distributielijst : STZ Datum : 19-06-2014 Revisiedatum : 19-06-2015 Veranderingen ten opzichte van eerdere versies Versiedatum Opmerkingen
Standard Operating Procedure
 Standard Operating Procedure STZ SOP: O3 Ontwikkelen, implementeren en beheren van SOP s Distributielijst : STZ Datum : 15-10-2012 Revisiedatum : 15-10-2013 Veranderingen ten opzichte van eerdere versies
Standard Operating Procedure STZ SOP: O3 Ontwikkelen, implementeren en beheren van SOP s Distributielijst : STZ Datum : 15-10-2012 Revisiedatum : 15-10-2013 Veranderingen ten opzichte van eerdere versies
Standard Operating Procedure
 Standard Operating Procedure STZ SOP: A4 Publicatie Distributielijst : STZ Datum : 20-03-2014 Revisiedatum : 20-03-2015 Veranderingen ten opzichte van eerdere versies Versiedatum Opmerkingen Versiedatum
Standard Operating Procedure STZ SOP: A4 Publicatie Distributielijst : STZ Datum : 20-03-2014 Revisiedatum : 20-03-2015 Veranderingen ten opzichte van eerdere versies Versiedatum Opmerkingen Versiedatum
Standard Operating Procedure
 Standard Operating Procedure STZ SOP: U5 Datamanagement Distributielijst : STZ Datum : 19-06-2014 Revisiedatum : 19-06-2015 Veranderingen ten opzichte van eerdere versies Versiedatum Opmerkingen Versiedatum
Standard Operating Procedure STZ SOP: U5 Datamanagement Distributielijst : STZ Datum : 19-06-2014 Revisiedatum : 19-06-2015 Veranderingen ten opzichte van eerdere versies Versiedatum Opmerkingen Versiedatum
Standard Operating Procedure
 Standard Operating Procedure SOP: V9 Initiatievisite Auteur Naam: Functie instelling/afdeling Judie van den Elshout Staffunctionaris Wetenschapsbureau Wetenschapsbureau / Cluster Leerhuis Handtekening:...
Standard Operating Procedure SOP: V9 Initiatievisite Auteur Naam: Functie instelling/afdeling Judie van den Elshout Staffunctionaris Wetenschapsbureau Wetenschapsbureau / Cluster Leerhuis Handtekening:...
Standard Operating Procedure
 Standard Operating Procedure STZ SOP: A2 Archiveren studie Distributielijst : STZ Datum : 03-06-2014 Revisiedatum : 03-06-2015 Veranderingen ten opzichte van eerdere versies Versiedatum Opmerkingen Versiedatum
Standard Operating Procedure STZ SOP: A2 Archiveren studie Distributielijst : STZ Datum : 03-06-2014 Revisiedatum : 03-06-2015 Veranderingen ten opzichte van eerdere versies Versiedatum Opmerkingen Versiedatum
Standard Operating Procedure
 Standard Operating Procedure STZ SOP: U6 Studie medicatie Distributielijst : STZ Datum : 19-06-2014 Revisiedatum : 19-06-2015 Veranderingen ten opzichte van eerdere versies Versiedatum Opmerkingen Versiedatum
Standard Operating Procedure STZ SOP: U6 Studie medicatie Distributielijst : STZ Datum : 19-06-2014 Revisiedatum : 19-06-2015 Veranderingen ten opzichte van eerdere versies Versiedatum Opmerkingen Versiedatum
Aanmelden WMO-plichtig onderzoek
 Aanmelden WMO-plichtig onderzoek 1. Doel Het beschrijven van de procedure die gevolgd wordt bij het aanmelden van onderzoek dat onder de WMO valt en waarbij ZGV optreedt als deelnemend centrum. Voordat
Aanmelden WMO-plichtig onderzoek 1. Doel Het beschrijven van de procedure die gevolgd wordt bij het aanmelden van onderzoek dat onder de WMO valt en waarbij ZGV optreedt als deelnemend centrum. Voordat
Standard Operating Procedure
 Standard Operating Procedure STZ SOP: VL4 Investigator Site File Distributielijst : STZ Datum : 03-06-2014 Revisiedatum : 03-06-2015 Veranderingen ten opzichte van eerdere versies Versiedatum Opmerkingen
Standard Operating Procedure STZ SOP: VL4 Investigator Site File Distributielijst : STZ Datum : 03-06-2014 Revisiedatum : 03-06-2015 Veranderingen ten opzichte van eerdere versies Versiedatum Opmerkingen
Standard Operating Procedure
 Standard Operating Procedure STZ SOP: VC2 Ontwikkelen proefpersoneninformatie / toestemmingsformulier (centraal) Distributielijst : STZ Datum : 18-02-2014 Revisiedatum : 18-02-2015 Veranderingen ten opzichte
Standard Operating Procedure STZ SOP: VC2 Ontwikkelen proefpersoneninformatie / toestemmingsformulier (centraal) Distributielijst : STZ Datum : 18-02-2014 Revisiedatum : 18-02-2015 Veranderingen ten opzichte
Standard Operating Procedure
 Standard Operating Procedure STZ SOP: U8 Melding van (Serious) Adverse Events en SUSARs Distributielijst : STZ Datum : 19-06-2014 Revisiedatum : 19-06-2015 Veranderingen ten opzichte van eerdere versies
Standard Operating Procedure STZ SOP: U8 Melding van (Serious) Adverse Events en SUSARs Distributielijst : STZ Datum : 19-06-2014 Revisiedatum : 19-06-2015 Veranderingen ten opzichte van eerdere versies
Toezicht op klinisch onderzoek: bevindingen uit inspecties bij GGZ instellingen
 Toezicht op klinisch onderzoek: bevindingen uit inspecties bij GGZ instellingen Afdeling Farmaceutische Bedrijven, Klinisch Onderzoek Good Clinical Practice Inhoud Wat doet de IGJ aan toezicht op klinisch
Toezicht op klinisch onderzoek: bevindingen uit inspecties bij GGZ instellingen Afdeling Farmaceutische Bedrijven, Klinisch Onderzoek Good Clinical Practice Inhoud Wat doet de IGJ aan toezicht op klinisch
IC ICF ICH ISF. Lijst met afkortingen, definities en termen STZ-Kwaliteitshandboek SOP s
 Lijst met afkortingen, definities en termen STZ-Kwaliteitshandboek SOP s ABR ADR AE AR BROK CCMO CRF CTA CV DSMB EMEA EU EudraCT FU brief GCP GMP IB IC ICF ICH IMPD ISF MEB METC EU RCT SAE SOP SPC SUSAR
Lijst met afkortingen, definities en termen STZ-Kwaliteitshandboek SOP s ABR ADR AE AR BROK CCMO CRF CTA CV DSMB EMEA EU EudraCT FU brief GCP GMP IB IC ICF ICH IMPD ISF MEB METC EU RCT SAE SOP SPC SUSAR
Checklist Lokale Uitvoerbaarheid
 Primaire indieningsproces Lokale Uitvoerbaarheid in METC Management, screening door Assistent Secretaris. Hieronder staan de generieke uitgangspunten en is toegelicht hoe de toetsing indiening Lokale Uitvoerbaarheid
Primaire indieningsproces Lokale Uitvoerbaarheid in METC Management, screening door Assistent Secretaris. Hieronder staan de generieke uitgangspunten en is toegelicht hoe de toetsing indiening Lokale Uitvoerbaarheid
Toezicht op klinisch onderzoek bij STZ-ziekenhuizen. Farmaceutische Bedrijven Deelteam Klinisch Onderzoek
 Toezicht op klinisch onderzoek bij STZ-ziekenhuizen Farmaceutische Bedrijven Deelteam Klinisch Onderzoek Toezicht op klinisch onderzoek bij STZ-ziekenhuizen Bevindingen vanuit de praktijk Conclusies en
Toezicht op klinisch onderzoek bij STZ-ziekenhuizen Farmaceutische Bedrijven Deelteam Klinisch Onderzoek Toezicht op klinisch onderzoek bij STZ-ziekenhuizen Bevindingen vanuit de praktijk Conclusies en
Checklist en toelichting indienen Lokale Uitvoerbaarheid
 Checklist en toelichting indienen Lokale Uitvoerbaarheid In onderstaande tabel staan de documenten die u moet indienen als u toestemming wilt van de Raad van Bestuur VUmc voor uitvoering van uw onderzoek
Checklist en toelichting indienen Lokale Uitvoerbaarheid In onderstaande tabel staan de documenten die u moet indienen als u toestemming wilt van de Raad van Bestuur VUmc voor uitvoering van uw onderzoek
AMC Uitvoeringsrichtlijnen: Goedkeuring medisch-wetenschappelijk onderzoek door de Raad van Bestuur
 AMC Uitvoeringsrichtlijnen: Goedkeuring medisch-wetenschappelijk onderzoek door de Raad van Bestuur en Deelname van personeelsleden en studenten aan medisch-wetenschappelijk onderzoek Versie 1.1 Dit document
AMC Uitvoeringsrichtlijnen: Goedkeuring medisch-wetenschappelijk onderzoek door de Raad van Bestuur en Deelname van personeelsleden en studenten aan medisch-wetenschappelijk onderzoek Versie 1.1 Dit document
Inhoud onderzoeksdossier
 Inhoud onderzoeksdossier (documenten in de witte box zijn nodig voor de primaire beoordeling) A. Brieven B. Formulieren C. Onderzoeksprotocol en protocolamendementen D. Productinformatie E. Informatie
Inhoud onderzoeksdossier (documenten in de witte box zijn nodig voor de primaire beoordeling) A. Brieven B. Formulieren C. Onderzoeksprotocol en protocolamendementen D. Productinformatie E. Informatie
Checklist en toelichting indienen Lokale Uitvoerbaarheid
 Checklist en toelichting indienen Lokale Uitvoerbaarheid In onderstaande tabel staan de documenten die u moet indienen als u toestemming wilt van de Raad van Bestuur VUmc voor uitvoering van uw onderzoek
Checklist en toelichting indienen Lokale Uitvoerbaarheid In onderstaande tabel staan de documenten die u moet indienen als u toestemming wilt van de Raad van Bestuur VUmc voor uitvoering van uw onderzoek
Handleiding Goedkeuringsprocedure Raad van Bestuur Zuyderland wetenschappelijk onderzoek
 Handleiding Goedkeuringsprocedure Raad van Bestuur Zuyderland wetenschappelijk onderzoek INLEIDING oor al het onderzoek dat binnen Zuyderland wordt uitgevoerd moet goedkeuring worden verkregen van de Raad
Handleiding Goedkeuringsprocedure Raad van Bestuur Zuyderland wetenschappelijk onderzoek INLEIDING oor al het onderzoek dat binnen Zuyderland wordt uitgevoerd moet goedkeuring worden verkregen van de Raad
Procedure monocenter WMO-plichtig klinisch wetenschappelijk onderzoek
 Wetenschappelijk onderzoek in het Elisabeth-TweeSteden Ziekenhuis Procedure monocenter WMO-plichtig klinisch wetenschappelijk onderzoek Bij dit type onderzoek vindt het WMO-plichtig onderzoek enkel plaats
Wetenschappelijk onderzoek in het Elisabeth-TweeSteden Ziekenhuis Procedure monocenter WMO-plichtig klinisch wetenschappelijk onderzoek Bij dit type onderzoek vindt het WMO-plichtig onderzoek enkel plaats
29 juni Initiatie bijeenkomst PORTEC 4. Kwaliteitsborging WMO GCP richtsnoer. Frank van Leeuwen IKNL
 29 juni 2012 Initiatie bijeenkomst PORTEC 4 Kwaliteitsborging WMO GCP richtsnoer Frank van Leeuwen IKNL Wet en regelgeving Verklaring van Helsinki Richtsnoer voor Good Clinical Practice (CPMP/ICH/135/95)
29 juni 2012 Initiatie bijeenkomst PORTEC 4 Kwaliteitsborging WMO GCP richtsnoer Frank van Leeuwen IKNL Wet en regelgeving Verklaring van Helsinki Richtsnoer voor Good Clinical Practice (CPMP/ICH/135/95)
SOP aanleveren en afhandelen WMO onderzoek METC Onze Lieve Vrouwe Gasthuis, versie 1, juli
 Aanmelden en afhandelen medisch-wetenschappelijk onderzoek met mensen (WMO-onderzoek) Medisch-ethische toetsingscommissie (METC) Onze Lieve Vrouwe Gasthuis Hieronder treft u aan de procedure van aanmelding
Aanmelden en afhandelen medisch-wetenschappelijk onderzoek met mensen (WMO-onderzoek) Medisch-ethische toetsingscommissie (METC) Onze Lieve Vrouwe Gasthuis Hieronder treft u aan de procedure van aanmelding
Site selectie visite checklist
 Site selectie visite checklist Informatie sponsor: Naam sponsor: Contactpersoon: Functie: Afdeling: Telefoonnummer : Email : Informatie onderzoekslocatie: Naam onderzoekslocatie : Naam onderzoeker: Functie:
Site selectie visite checklist Informatie sponsor: Naam sponsor: Contactpersoon: Functie: Afdeling: Telefoonnummer : Email : Informatie onderzoekslocatie: Naam onderzoekslocatie : Naam onderzoeker: Functie:
Informatie inzake de bijlage proefpersonenverzekering bij de proefpersoneninformatie Toelichting voor de onderzoeker
 Versie 08 d.d. 14-02-2014 Informatie inzake de bijlage proefpersonenverzekering bij de proefpersoneninformatie Toelichting voor de onderzoeker Wettelijke verplichtingen Op grond van artikel 9 van het Besluit
Versie 08 d.d. 14-02-2014 Informatie inzake de bijlage proefpersonenverzekering bij de proefpersoneninformatie Toelichting voor de onderzoeker Wettelijke verplichtingen Op grond van artikel 9 van het Besluit
Procedure multicenter WMO-plichtig klinisch wetenschappelijk onderzoek geïnitieerd vanuit het Elisabeth-TweeSteden Ziekenhuis
 Wetenschappelijk onderzoek in het Elisabeth-TweeSteden Ziekenhuis Procedure multicenter WMO-plichtig klinisch wetenschappelijk onderzoek geïnitieerd vanuit het Elisabeth-TweeSteden Ziekenhuis Bij dit type
Wetenschappelijk onderzoek in het Elisabeth-TweeSteden Ziekenhuis Procedure multicenter WMO-plichtig klinisch wetenschappelijk onderzoek geïnitieerd vanuit het Elisabeth-TweeSteden Ziekenhuis Bij dit type
Monitorplan voorbeeld
 Monitorplan voorbeeld Protocol Er moet in het protocol beschreven worden dat er monitoring plaatsvindt (zie ook CCMO voorbeeld template). Het monitoringplan mag als bijlage worden toegevoegd (in dat geval
Monitorplan voorbeeld Protocol Er moet in het protocol beschreven worden dat er monitoring plaatsvindt (zie ook CCMO voorbeeld template). Het monitoringplan mag als bijlage worden toegevoegd (in dat geval
1. Voorafgaand aan de klinische fase van het onderzoek
 Essentiële documenten Bron: Richtsnoer voor good clinical practice (CPMP/ICH/135/95) De verwijzingen in dit document verwijzen naar de artikelen in bovenstaand document. 1. Voorafgaand aan de klinische
Essentiële documenten Bron: Richtsnoer voor good clinical practice (CPMP/ICH/135/95) De verwijzingen in dit document verwijzen naar de artikelen in bovenstaand document. 1. Voorafgaand aan de klinische
Bijlage 2 bij het Convenant PSI Samenstelling en werkwijze toetsingscommissie
 Bijlage 2 bij het Convenant PSI Samenstelling en werkwijze toetsingscommissie 1. Samenstelling toetsingscommissie De kerncommissie betstaat uit leden met ten minste de volgende specialismes 1 : Arts of
Bijlage 2 bij het Convenant PSI Samenstelling en werkwijze toetsingscommissie 1. Samenstelling toetsingscommissie De kerncommissie betstaat uit leden met ten minste de volgende specialismes 1 : Arts of
Wetenschappelijk onderzoek in het Elisabeth-TweeSteden Ziekenhuis. Procedure niet-wmo-plichtig klinisch wetenschappelijk onderzoek
 Wetenschappelijk onderzoek in het Elisabeth-TweeSteden Ziekenhuis Procedure niet-wmo-plichtig klinisch wetenschappelijk onderzoek Deze procedure geldt voor niet-wmo-plichtig onderzoek dat of: a) enkel
Wetenschappelijk onderzoek in het Elisabeth-TweeSteden Ziekenhuis Procedure niet-wmo-plichtig klinisch wetenschappelijk onderzoek Deze procedure geldt voor niet-wmo-plichtig onderzoek dat of: a) enkel
Monitoren vs auditen. CRA dag 21 april 2016
 Monitoren vs auditen CRA dag 21 april 2016 Introductie Freelance consultant, mede oprichter TAPAS Group B.V. Mede oprichter/directeur van CRA B.V. Medical Adviser Yamanouchi Pharma Clinical trial monitor
Monitoren vs auditen CRA dag 21 april 2016 Introductie Freelance consultant, mede oprichter TAPAS Group B.V. Mede oprichter/directeur van CRA B.V. Medical Adviser Yamanouchi Pharma Clinical trial monitor
ccmo-richtlijn Externe Toetsing 2012
 Richtlijn van de centrale commissie medisch-wetenschappelijk onderzoek krachtens artikel 24 van de Wet medisch-wetenschappelijk onderzoek met mensen, inzake de toetsingsprocedure multicenteronderzoek en
Richtlijn van de centrale commissie medisch-wetenschappelijk onderzoek krachtens artikel 24 van de Wet medisch-wetenschappelijk onderzoek met mensen, inzake de toetsingsprocedure multicenteronderzoek en
Handleiding Goedkeuringsprocedure Raad van Bestuur Zuyderland voor wetenschappelijk onderzoek
 Handleiding Goedkeuringsprocedure Raad van Bestuur Zuyderland voor wetenschappelijk onderzoek Deze handleiding wordt voortdurend geupdate naar aanleiding van de meest recente wet- en regelgeving en wijzigingen
Handleiding Goedkeuringsprocedure Raad van Bestuur Zuyderland voor wetenschappelijk onderzoek Deze handleiding wordt voortdurend geupdate naar aanleiding van de meest recente wet- en regelgeving en wijzigingen
EU verordening no 536/2014 betreffende klinische proeven met geneesmiddelen voor menselijk gebruik
 EU verordening no 536/2014 betreffende klinische proeven met geneesmiddelen voor menselijk gebruik -Implicaties voor onderzoekers- Paula Vossebeld Symposium van de V&VN RP 10 november 2015 Verordening
EU verordening no 536/2014 betreffende klinische proeven met geneesmiddelen voor menselijk gebruik -Implicaties voor onderzoekers- Paula Vossebeld Symposium van de V&VN RP 10 november 2015 Verordening
CCMO Structuur documenten Technische Toetsing (ass.secr.) Inhoudelijke Toetsing (secretaris)
 CHECKLIST WMO Primaire indieningsproces WMO in METC Management, screening door Assistent Secretaris. Hieronder staan de generieke uitgangspunten en is toegelicht hoe de primaire toetsing indiening WMO
CHECKLIST WMO Primaire indieningsproces WMO in METC Management, screening door Assistent Secretaris. Hieronder staan de generieke uitgangspunten en is toegelicht hoe de primaire toetsing indiening WMO
Procedure aanvraag voor het verrichten van wetenschappelijk onderzoek in Meander Medisch Centrum
 Procedure aanvraag voor het verrichten van wetenschappelijk onderzoek in Meander Medisch Centrum Commissie Toetsing Wetenschappelijk Onderzoek (TWO) I II Algemeen 1. Alvorens onderzoek in Meander MC van
Procedure aanvraag voor het verrichten van wetenschappelijk onderzoek in Meander Medisch Centrum Commissie Toetsing Wetenschappelijk Onderzoek (TWO) I II Algemeen 1. Alvorens onderzoek in Meander MC van
Op naar het snel opstarten van klinisch onderzoek in Nederland!
 Op naar het snel opstarten van klinisch onderzoek in Nederland! Marika Trieling Voorzitter DCRF werkgroep Lokale uitvoerbaarheid 12 februari 2019 Wat is er in Nederland nodig? Verkorten tijdslijnen van
Op naar het snel opstarten van klinisch onderzoek in Nederland! Marika Trieling Voorzitter DCRF werkgroep Lokale uitvoerbaarheid 12 februari 2019 Wat is er in Nederland nodig? Verkorten tijdslijnen van
SOP: Voorlichtingsgesprek en uitgesteld informed consent CONTRAST trials
 SOP: Voorlichtingsgesprek en uitgesteld informed consent CONTRAST trials SOP: IC1 Versie Nr.: 1.1 Geldig m.i.v.: 03-04-2018 Auteur: S.A. van den Berg, arts-onderzoeker AMC Autorisator: Dr. H.B. van der
SOP: Voorlichtingsgesprek en uitgesteld informed consent CONTRAST trials SOP: IC1 Versie Nr.: 1.1 Geldig m.i.v.: 03-04-2018 Auteur: S.A. van den Berg, arts-onderzoeker AMC Autorisator: Dr. H.B. van der
DE MONITOR. Bijlage 1
 DE MONITOR Bijlage 1 legenda procesfase rol voorbereidingsfase v=verantwoordelijk uitvoeringsfase p= partner gerealiseerd evaluatiefase Geen actie agenda werkgroep aandachtslevel regisseur **** direct
DE MONITOR Bijlage 1 legenda procesfase rol voorbereidingsfase v=verantwoordelijk uitvoeringsfase p= partner gerealiseerd evaluatiefase Geen actie agenda werkgroep aandachtslevel regisseur **** direct
Aanvraagformulier REGISTRATIE oncologie monitor
 Aanvraagformulier REGISTRATIE oncologie monitor 1. Gegevens aanvrager Naam + Voorletters:... Adres:... Postcode + Woonplaats:.... Geboortedatum:... Geboorteplaats:... Werkzaam bij: Organisatie + Afdeling:...
Aanvraagformulier REGISTRATIE oncologie monitor 1. Gegevens aanvrager Naam + Voorletters:... Adres:... Postcode + Woonplaats:.... Geboortedatum:... Geboorteplaats:... Werkzaam bij: Organisatie + Afdeling:...
Toezicht op onderzoeker geïnitieerd klinisch onderzoek (IIT) Team Klinisch Onderzoek
 Toezicht op onderzoeker geïnitieerd klinisch onderzoek (IIT) 2014-2016 Team Klinisch Onderzoek Toezicht op IIT 2014-2016 Aanleiding en werkwijze Bevindingen vanuit de praktijk Conclusies en aandachtspunten
Toezicht op onderzoeker geïnitieerd klinisch onderzoek (IIT) 2014-2016 Team Klinisch Onderzoek Toezicht op IIT 2014-2016 Aanleiding en werkwijze Bevindingen vanuit de praktijk Conclusies en aandachtspunten
Veel gestelde vragen Melden voorvallen/bijwerkingen bij geneesmiddelenonderzoek
 Veel gestelde vragen Melden voorvallen/bijwerkingen bij geneesmiddelenonderzoek Wat is een SUSAR? SUSAR is de afkorting van Suspected Unexpected Serious Adverse Reaction. In het Nederlands betekent dit
Veel gestelde vragen Melden voorvallen/bijwerkingen bij geneesmiddelenonderzoek Wat is een SUSAR? SUSAR is de afkorting van Suspected Unexpected Serious Adverse Reaction. In het Nederlands betekent dit
Procedure voor het starten van wetenschappelijk onderzoek bij Lentis (klik op de witte pijltjes voor meer informatie)
 Procedure voor het starten van wetenschappelijk onderzoek bij Lentis (klik op de witte pijltjes voor meer informatie) Ik ben extern onderzoeker en wil mijn onderzoek bij Lentis uitvoeren Ik ben onderzoeker
Procedure voor het starten van wetenschappelijk onderzoek bij Lentis (klik op de witte pijltjes voor meer informatie) Ik ben extern onderzoeker en wil mijn onderzoek bij Lentis uitvoeren Ik ben onderzoeker
Titel: Good Clinical Practice & Monitoring. Initiation Investigator Driven Studies. Versie: 14-jan-2013
 Titel: Good Clinical Practice & Monitoring Initiation Investigator Driven Studies Inhoud Wet- en regelgeving/declaration of Helsinki Good Clinical Practice Patiënteninformatie/ informed consent Basisvereisten
Titel: Good Clinical Practice & Monitoring Initiation Investigator Driven Studies Inhoud Wet- en regelgeving/declaration of Helsinki Good Clinical Practice Patiënteninformatie/ informed consent Basisvereisten
Bij dit type onderzoek vindt het WMO-plichtig onderzoek enkel plaats in het Elisabeth-TweeSteden Ziekenhuis.
 Wetenschappelijk onderzoek in het Elisabeth-TweeSteden Ziekenhuis Procedure monocenter WMO-plichtig klinisch wetenschappelijk onderzoek Bij dit type onderzoek vindt het WMO-plichtig onderzoek enkel plaats
Wetenschappelijk onderzoek in het Elisabeth-TweeSteden Ziekenhuis Procedure monocenter WMO-plichtig klinisch wetenschappelijk onderzoek Bij dit type onderzoek vindt het WMO-plichtig onderzoek enkel plaats
STATEC trial praktische uitvoering Hilde Dijcker
 STATEC trial praktische uitvoering 17-04-2018 Hilde Dijcker Inhoud IKNL trialbureau Site activation Datamanagement Monitoring IKNL Trialbureau Site activation: - Ine Leenen en Hilde Dijcker Kwaliteit van
STATEC trial praktische uitvoering 17-04-2018 Hilde Dijcker Inhoud IKNL trialbureau Site activation Datamanagement Monitoring IKNL Trialbureau Site activation: - Ine Leenen en Hilde Dijcker Kwaliteit van
WMO-GCP opfriscursus Nederlandse Vereniging voor Oncologie Datamanagers 27 februari 2019
 WMO-GCP opfriscursus Nederlandse Vereniging voor Oncologie Datamanagers 27 februari 2019 Agenda Introductie ICH-GCP R2 AVG Kwaliteitssyteem Informed Consent ISF e-tmf Monitoren SAE rapportage Waarom wetgeving?
WMO-GCP opfriscursus Nederlandse Vereniging voor Oncologie Datamanagers 27 februari 2019 Agenda Introductie ICH-GCP R2 AVG Kwaliteitssyteem Informed Consent ISF e-tmf Monitoren SAE rapportage Waarom wetgeving?
Voorzitter, vice-voorzitter en secretaris(sen) van de METC Erasmus MC.
 REGLEMENT MEDISCH ETHISCHE TOETSINGS COMMISSIE ERASMUS MC Inleiding Dit reglement geeft, in aanmerking nemende het bepaalde in artikel 16, lid 2, onder b tot en met d van de WMO, voorschriften betreffende
REGLEMENT MEDISCH ETHISCHE TOETSINGS COMMISSIE ERASMUS MC Inleiding Dit reglement geeft, in aanmerking nemende het bepaalde in artikel 16, lid 2, onder b tot en met d van de WMO, voorschriften betreffende
SEMINAR 4 NOVEMBER 2014
 SEMINAR 4 NOVEMBER 2014 Professioneel opzetten en uitvoeren van klinisch onderzoek www.deresearchmanager.nl Striksteeg 7 7411 KR Deventer 0570 594 789 [email protected] Ontwikkeling Afdeling Innovatie
SEMINAR 4 NOVEMBER 2014 Professioneel opzetten en uitvoeren van klinisch onderzoek www.deresearchmanager.nl Striksteeg 7 7411 KR Deventer 0570 594 789 [email protected] Ontwikkeling Afdeling Innovatie
Monitoring van Investigator Initiated onderzoek
 Monitoring van Investigator Initiated onderzoek V1.0 Angela Vlug Clinical Research Bureau VUmc Wat is een IIS (volgens de NFU) Onderzoek waarvoor de raad van bestuur van een (universitair) medisch centrum
Monitoring van Investigator Initiated onderzoek V1.0 Angela Vlug Clinical Research Bureau VUmc Wat is een IIS (volgens de NFU) Onderzoek waarvoor de raad van bestuur van een (universitair) medisch centrum
Kwaliteitsborging onderzoek in het. NVMETC bijeenkomst 23 november UMC Utrecht. Oktober 2016
 1 Kwaliteitsborging onderzoek in het UMC Utrecht NVMETC bijeenkomst 23 november 2016 Eugenie Ram, kwaliteitsmanager Onderzoek - Office Concernstaf Raad van Bestuur Oktober 2016 UMC Utrecht breed kwaliteitssysteem
1 Kwaliteitsborging onderzoek in het UMC Utrecht NVMETC bijeenkomst 23 november 2016 Eugenie Ram, kwaliteitsmanager Onderzoek - Office Concernstaf Raad van Bestuur Oktober 2016 UMC Utrecht breed kwaliteitssysteem
Wetenschappelijk onderzoek met Karakter
 Wetenschappelijk onderzoek met Karakter 1 Inleiding Karakter is als academisch centrum partner in een groot aantal multicenter studies. Voor het uitvoeren van uw onderzoek in samenwerking met Karakter
Wetenschappelijk onderzoek met Karakter 1 Inleiding Karakter is als academisch centrum partner in een groot aantal multicenter studies. Voor het uitvoeren van uw onderzoek in samenwerking met Karakter
Toezicht op IIT: bevindingen vanuit de praktijk
 Toezicht op IIT: bevindingen vanuit de praktijk Elysée Hille, senior inspecteur namens deelteam KO-GCP Teamcoördinator KO-GCP/PhV/GZH Afdeling Farmaceutische Bedrijven Wat doet de IGZ? Toezicht op klinisch
Toezicht op IIT: bevindingen vanuit de praktijk Elysée Hille, senior inspecteur namens deelteam KO-GCP Teamcoördinator KO-GCP/PhV/GZH Afdeling Farmaceutische Bedrijven Wat doet de IGZ? Toezicht op klinisch
Bijlage I bij het Kaderreglement van het Parelsnoer Initiatief. Handleiding Parelspecifiek reglement
 Bijlage I bij het Kaderreglement van het Parelsnoer Initiatief Handleiding Parelspecifiek reglement Op grond van artikel 4 lid 17 van het Kaderreglement Parelsnoer Initiatief dient per Parel een reglement
Bijlage I bij het Kaderreglement van het Parelsnoer Initiatief Handleiding Parelspecifiek reglement Op grond van artikel 4 lid 17 van het Kaderreglement Parelsnoer Initiatief dient per Parel een reglement
EU verordening no 536/2014 betreffende klinische proeven met geneesmiddelen voor menselijk gebruik
 EU verordening no 536/2014 betreffende klinische proeven met geneesmiddelen voor menselijk gebruik -Implicaties voor CCMO, METC s en onderzoekers- Paula Vossebeld DCTF jaarcongres 7 oktober 2015 Verordening
EU verordening no 536/2014 betreffende klinische proeven met geneesmiddelen voor menselijk gebruik -Implicaties voor CCMO, METC s en onderzoekers- Paula Vossebeld DCTF jaarcongres 7 oktober 2015 Verordening
KWALITEITSHANDBOEK WETENSCHAPSBELEID KENNEMER GASTHUIS EN SPAARNE ZIEKENHUIS. Organisatie en richtlijnen medisch-wetenschappelijk onderzoek
 KWALITEITSHANDBOEK WETENSCHAPSBELEID KENNEMER GASTHUIS EN SPAARNE ZIEKENHUIS Organisatie en richtlijnen medisch-wetenschappelijk onderzoek april 2014 Inhoudsopgave 1. INLEIDING 1.1. Organisatie wetenschap
KWALITEITSHANDBOEK WETENSCHAPSBELEID KENNEMER GASTHUIS EN SPAARNE ZIEKENHUIS Organisatie en richtlijnen medisch-wetenschappelijk onderzoek april 2014 Inhoudsopgave 1. INLEIDING 1.1. Organisatie wetenschap
Model Verklaring lokale uitvoerbaarheid instellingsleiding (bij Richtlijn Externe Toetsing)
 Model Verklaring lokale uitvoerbaarheid instellingsleiding (bij Richtlijn Externe Toetsing) Aan de indiener van het onderzoeksdossier getiteld: Chronic pain experience in Down syndrome, with and without
Model Verklaring lokale uitvoerbaarheid instellingsleiding (bij Richtlijn Externe Toetsing) Aan de indiener van het onderzoeksdossier getiteld: Chronic pain experience in Down syndrome, with and without
KLINISCH GENEESMIDDELEN- ONDERZOEK
 KLINISCH GENEESMIDDELEN- ONDERZOEK HET PROCES VAN HET OPSTARTEN VAN KLINISCH ONDERZOEK MET GENEESMIDDELEN GAAT VERANDEREN De ECTR verandert het klinisch onderzoek met geneesmiddelen in Europa. Dit heeft
KLINISCH GENEESMIDDELEN- ONDERZOEK HET PROCES VAN HET OPSTARTEN VAN KLINISCH ONDERZOEK MET GENEESMIDDELEN GAAT VERANDEREN De ECTR verandert het klinisch onderzoek met geneesmiddelen in Europa. Dit heeft
MDR (2017/745) en klinisch onderzoek - Implementatie in Nederland -
 MDR (2017/745) en klinisch onderzoek - Implementatie in Nederland - DCRF 26 september 2018 Monique Al Teamcoördinator Landelijk Bureau CCMO MDR: Drie hoofdcategoriën klinisch onderzoek I II III Klinisch
MDR (2017/745) en klinisch onderzoek - Implementatie in Nederland - DCRF 26 september 2018 Monique Al Teamcoördinator Landelijk Bureau CCMO MDR: Drie hoofdcategoriën klinisch onderzoek I II III Klinisch
Ongewenste voorvallen flow AE SAE SAR SUSAR SADE voor onderzoeker geïnitieerd WMO-plichtig onderzoek
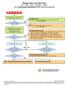 Ongewenste voorvallen flow AE SAE SAR SUSAR SADE voor onderzoeker geïnitieerd WMO-plichtig onderzoek Melding voorval proefpersoon aan onderzoeker/arts 1 Rapportage voorval door onderzoeker/arts in patiëntenstatus
Ongewenste voorvallen flow AE SAE SAR SUSAR SADE voor onderzoeker geïnitieerd WMO-plichtig onderzoek Melding voorval proefpersoon aan onderzoeker/arts 1 Rapportage voorval door onderzoeker/arts in patiëntenstatus
De laatste versie van dit document is te downloaden op: www.umcutrecht.nl/metc. Indienen documenten bij de METC UMC Utrecht
 Indienen documenten bij de METC UMC Utrecht Begin hier Bekijk in onderstaande tabel wat u wilt indienen. Kijk daarna welke methode van indiening en welke documenten bij uw indiening horen. Volg bij het
Indienen documenten bij de METC UMC Utrecht Begin hier Bekijk in onderstaande tabel wat u wilt indienen. Kijk daarna welke methode van indiening en welke documenten bij uw indiening horen. Volg bij het
Danazol voor idiopathische pulmonale fibrose
 Danazol voor idiopathische pulmonale fibrose Thijs W. Hoffman 18-04-2018 Idiopathische pulmonale fibrose (IPF) Normaal Ernstige interstitiële longziekte Ca. 3000 patiënten in NL Verlittekening van de longen
Danazol voor idiopathische pulmonale fibrose Thijs W. Hoffman 18-04-2018 Idiopathische pulmonale fibrose (IPF) Normaal Ernstige interstitiële longziekte Ca. 3000 patiënten in NL Verlittekening van de longen
Formulier Voortgangsrapportage
 Formulier Voortgangsrapportage De METC azm/um wil van al het door haar beoordeelde WMO-onderzoek jaarlijks een voortgangsrapportage zien. Zij heeft deze eis daartoe opgenomen in de tekst van haar eigen
Formulier Voortgangsrapportage De METC azm/um wil van al het door haar beoordeelde WMO-onderzoek jaarlijks een voortgangsrapportage zien. Zij heeft deze eis daartoe opgenomen in de tekst van haar eigen
Algemene informatie. Medisch wetenschappelijk onderzoek
 Algemene informatie Medisch wetenschappelijk onderzoek 1 Inleiding Artsen verrichten naast hun normale behandelingen soms medisch wetenschappelijk onderzoek. Dit doen artsen in het Scheper Ziekenhuis Emmen
Algemene informatie Medisch wetenschappelijk onderzoek 1 Inleiding Artsen verrichten naast hun normale behandelingen soms medisch wetenschappelijk onderzoek. Dit doen artsen in het Scheper Ziekenhuis Emmen
Standard Operating Procedure
 Standard Operating Procedure STZ SOP: VC1 Ontwikkelen onderzoeksprotocol Distributielijst : STZ Datum : 03-02-2014 Revisiedatum : 03-02-2015 Veranderingen ten opzichte van eerdere versies Versiedatum Opmerkingen
Standard Operating Procedure STZ SOP: VC1 Ontwikkelen onderzoeksprotocol Distributielijst : STZ Datum : 03-02-2014 Revisiedatum : 03-02-2015 Veranderingen ten opzichte van eerdere versies Versiedatum Opmerkingen
 ------------------------------------------------------------------------------------------------------------------------------------------- Concept Procedure Lokale Haalbaarheid klinisch geneesmiddelenonderzoek
------------------------------------------------------------------------------------------------------------------------------------------- Concept Procedure Lokale Haalbaarheid klinisch geneesmiddelenonderzoek
Concept procedure Lokale Haalbaarheid
 -------------------------------------------------------------------------------------------------------------------------------------------- Opzet pilot Stap 2 Lokale Haalbaarheid ter voorbereiding op
-------------------------------------------------------------------------------------------------------------------------------------------- Opzet pilot Stap 2 Lokale Haalbaarheid ter voorbereiding op
ETHISCH COMITÉ PZ HF KORTRIJK - PC MENEN
 ETHISCH COMITÉ PZ HF KORTRIJK - PC MENEN Aanvraagformulier Ethisch advies voor experimenten op de menselijke persoon Richtlijnen Ethische comités hebben een beperkte tijd om dossiers te evalueren en hun
ETHISCH COMITÉ PZ HF KORTRIJK - PC MENEN Aanvraagformulier Ethisch advies voor experimenten op de menselijke persoon Richtlijnen Ethische comités hebben een beperkte tijd om dossiers te evalueren en hun
