Kwaliteitsborging onderzoek in het. NVMETC bijeenkomst 23 november UMC Utrecht. Oktober 2016
|
|
|
- Hanne Verbeke
- 7 jaren geleden
- Aantal bezoeken:
Transcriptie
1 1 Kwaliteitsborging onderzoek in het UMC Utrecht NVMETC bijeenkomst 23 november 2016 Eugenie Ram, kwaliteitsmanager Onderzoek - Office Concernstaf Raad van Bestuur Oktober 2016
2 UMC Utrecht breed kwaliteitssysteem voor onderzoek Indiening kwalitatief goed onderzoeksdossier bij Toetsingscommissie Bewaking gedurende het onderzoek
3 Organization, roles and responsibilities WMO research Responsibility Executive Board Quality of Office Division of Internal Medicine & Dermatology Division Head Manager of Operations Manager & Education QC QC QC Medical Head of Departments Division Neurosciences Division Head Manager of Operations Manager & Education Medical Head of Departments. Division Pediatrics Division Head Manager of Operations Manager & Education Medical Head of Departments
4 Kwaliteitssysteem onderzoek UMC breed NFU 2.0 Standard Operating Procedures (SOPs) en Beleid Monitoring verplicht voor alle WMO onderzoek Auditing auditprogramma Scholing BROK en WMO/GCP verplicht Data Safety Monitoring Board interne DSMB Archivering met digitaliseringsproces code Registratie onderzoek nog geen gevalideerd systeem
5 Kwaliteitssysteem onderzoek UMC breed Standard Operating Procedures en Policies Overkoepelend Meerdere malen verzocht door IGZ Aanvullende policies t.b.v. Joint Commission International Divisieniveau aansluitende SOPs / werkinstructies Samenwerking Kwaliteit van Onderzoek en kwaliteitscoördinatoren onderzoek* Experts (onderzoekers) uit diverse divisies Goedkeuring Managers Onderzoek van divisies * In elke divisie (# 12) een kwaliteitscoördinator onderzoek
6 Indienen kwalitatief goed onderzoeksdossier 1 SOP Voorbereiden: Onderzoeksvoorstel aan Divisieleiding /afdelingshoofd: wetenschappelijke kwaliteit methodologie strategie UMC Utrecht haalbaarheid: financieel / rekrutering / personeel / tijd Akkoord door Divisieleiding/afdelingshoofd via checklist
7 Indienen kwalitatief goed onderzoeksdossier 2 Checklist Voorbereiding voor onderzoeker: - Begroting - Bepalen wie TC: METC CCMO VWS IGZ - Opstellen onderzoeksprotocol - Monitoringplan - Datamanagementplan - Informatiebrief en toestemmingsformulier - Afspraken andere afdelingen: Apotheek Medisch technologie Laboratorium Beeld Monitoring ed. - Contracten (extern) monitoring deelnemende centra archivering ed. - Voorbereiding indiening (ABR, EudraCT, CV, OV ed.)
8 Indienen kwalitatief goed onderzoeksdossier 4 Kwaliteitscheck kwaliteitscoördinator onderzoek (KC) op niet wetenschappelijke aspecten - Afspraken faciliterende afdelingen - Vaststelling risicoclassificatie NFU - Monitorplan conform risicoclassificatie - BROK certificering - Protocol: informed consent procedure monitoring datamanagement/-plan safety passage (studiespecifiek) - PIF/IC: inzagerecht algemene brochure - verzekering - Consistentie namen, versiedata ed. Akkoord KC Akkoord AH + MO indiening TC
9 Bewaking gedurende het onderzoek 1 Monitoring verplicht voor al het WMO-plichtig onderzoek Laag risico: interne monitors Matig/hoog risico: externe monitors Opvolgen bevindingen: Hoofdonderzoeker verantwoordelijk Non-compliance: escalatie afdelingshoofd / divisieleiding Kwaliteitscoördinator onderzoek altijd cc monitorrapporten Protocol violations: hoofdonderzoeker melden TC Controle op melden SAEs: via TOL bij TC
10 Bewaking gedurende het onderzoek 2 UMC breed Auditprogramma Onderzoekstracer / Onderzoekstracer leiderschap Het doel van onderzoekstracers is om als divisie/afdeling/onderzoeker zicht te krijgen op het actuele kwaliteitsniveau van mensgebonden onderzoek, gekoppeld aan het UMC breed onderzoeksbeleid, relevante wet- en regelgeving en de JCI HRP normen (Human Subjects Programs)
11 Bewaking gedurende het onderzoek 3 Onderzoekstracer - 10% lopend onderzoek - Uitvoering: Onderzoeker + Kwaliteitscoördinator onderzoek (tracerpoule) - Aanwezig: Hoofdonderzoeker Uitvoerend Onderzoeker Onderzoeksverpleegkundige(n) Onderzoekstracer op leiderschap - Elke divisie minimaal eenmaal per drie jaar - Uitvoering: Kwaliteit van Onderzoek (RvB) - Aanwezig: Manager Onderzoek, Afdelingshoofd, Hoofdonderzoeker, Kwaliteitscoördinator Onderzoek Resultaten op dashboard UMC breed
12 Bewaking gedurende het onderzoek 4 Follow-up bevindingen: verantwoordelijkheid binnen divisie - Hoofdonderzoeker - Afdelingshoofd - Manager Onderzoek > Support kwaliteitscoördinator onderzoek Kritische bevindingen: - Via Afdelingshoofd naar Manager Onderzoek naar Raad van Bestuur - Bij onderzoekstracers door hoofdonderzoeker ook naar TC
13 Bewaking gedurende het onderzoek 5 Data Safety Monitoring Board (DSMB) Initiatief verrichter of op advies TC Interne DSMB UMC Utrecht - ook adviserend of DSMB nodig, evt. externe DSMB (hoog risico; multinationaal; kwetsbaren ed.) Advies DSMB via hoofdonderzoeker naar afdelingshoofd divisieleiding - TC
14 Quality Assurance and Control mechanisms for Human Subject Clinical Investigator Initiated Trials UMC Utrecht Sponsor Process idea Prepare research protocol / file File START? Conduct of the research Closure of Progress the END research Quality Assurance and Control Mechanisms WMO/GCP or BROK training; UMC-vision document Scientific Integrity Programs / Feasibility/ Finance / Methodology / Statistics / DM / Pharmacy / Device / Legal / DSMB/ Monitoring Qualiy Check Medical ethical review incl. insurance/ agreements Risk-based Monitoring Reporting of SAEs/ SUSARs to authorities and if appl.dsmb; Reporting incidents/ calamities Notification End of Trial to authorities; Database closure and analysis / Financial closure / End Report to MREC or CCMO Archiving Responsible parties involved PI ; Head of Department and Manager Principal Investigator Head of Department or Manager Quality Coordinator and Manager MREC UMC Utrecht or CCMO and if appl. CA Internal or external monitors Principal investigator and Head of Department Principal investigator and Head of Department PI Head of Department / Manager Quality of Department Audit program Policies and Procedures Management Abbreviations CA Competent Authorities (CCMO or the Health Care Inspectorate) CCMO Central Committee on Involving Human Subject (national) DM Datamanagement DSMB Data Safety and Monitoring Board GCP Good Clinical Practice MREC Medical Ethical Committee PI Principal Investigator SAE Serious Adverse Event SUSARs Suspected Unexpected Serious Adverse Reaction WMO Medical Involving Human subjects Act Source Document for this chart: Kwaliteitsborging_mensgebonden_onderzoek_2.0.pdf Adapted for the UMC Utrecht Approved by Directorate Quality & Patient Safety dated:
15 Vragen?
Tracers als methodiek voor kwaliteitsborging onderzoek in het UMC Utrecht. DCTF jaarcongres 5 oktober Oktober 2016
 Tracers als methodiek voor kwaliteitsborging onderzoek in het UMC Utrecht DCTF jaarcongres 5 oktober 2016 1 Oktober 2016 Eugenie Ram Kwaliteitsmanager Onderzoek afdeling Kwaliteit van Onderzoek Directie
Tracers als methodiek voor kwaliteitsborging onderzoek in het UMC Utrecht DCTF jaarcongres 5 oktober 2016 1 Oktober 2016 Eugenie Ram Kwaliteitsmanager Onderzoek afdeling Kwaliteit van Onderzoek Directie
Kwaliteitsborging vanuit academisch perspectief DCTF jaarcongres 2016
 Kwaliteitsborging vanuit academisch perspectief DCTF jaarcongres 2016 Gemma Voss 5 oktober 2016 Mensgebonden onderzoek (WMO) in Nederland 2015 CCMO-jaarverslag 2015 CCMO-jaarverslag 2015 Mensgebonden onderzoek
Kwaliteitsborging vanuit academisch perspectief DCTF jaarcongres 2016 Gemma Voss 5 oktober 2016 Mensgebonden onderzoek (WMO) in Nederland 2015 CCMO-jaarverslag 2015 CCMO-jaarverslag 2015 Mensgebonden onderzoek
Clinical Trials in Nederland: op weg naar topkwaliteit DCTF Congres 3 oktober 2012 Lunteren. M.P.W. Lamberti, BA Algemeen Directeur
 Clinical Trials in Nederland: op weg naar topkwaliteit DCTF Congres 3 oktober 2012 Lunteren M.P.W. Lamberti, BA Algemeen Directeur Maastricht UMC-Holding MUMC-Holding CTCM BPCM MI Groningen Utrecht Nijmegen
Clinical Trials in Nederland: op weg naar topkwaliteit DCTF Congres 3 oktober 2012 Lunteren M.P.W. Lamberti, BA Algemeen Directeur Maastricht UMC-Holding MUMC-Holding CTCM BPCM MI Groningen Utrecht Nijmegen
Standard Operating Procedure
 Standard Operating Procedure STZ SOP: U9 Monitoren Distributielijst : STZ Datum : 15-10-2012 Revisiedatum : 15-10-2013 Veranderingen ten opzichte van eerdere versies Versiedatum Hoofdstuk Versiedatum Hoofdstuk
Standard Operating Procedure STZ SOP: U9 Monitoren Distributielijst : STZ Datum : 15-10-2012 Revisiedatum : 15-10-2013 Veranderingen ten opzichte van eerdere versies Versiedatum Hoofdstuk Versiedatum Hoofdstuk
Monitoring van Investigator Initiated onderzoek
 Monitoring van Investigator Initiated onderzoek V1.0 Angela Vlug Clinical Research Bureau VUmc Wat is een IIS (volgens de NFU) Onderzoek waarvoor de raad van bestuur van een (universitair) medisch centrum
Monitoring van Investigator Initiated onderzoek V1.0 Angela Vlug Clinical Research Bureau VUmc Wat is een IIS (volgens de NFU) Onderzoek waarvoor de raad van bestuur van een (universitair) medisch centrum
Toezicht op klinisch onderzoek bij STZ-ziekenhuizen. Farmaceutische Bedrijven Deelteam Klinisch Onderzoek
 Toezicht op klinisch onderzoek bij STZ-ziekenhuizen Farmaceutische Bedrijven Deelteam Klinisch Onderzoek Toezicht op klinisch onderzoek bij STZ-ziekenhuizen Bevindingen vanuit de praktijk Conclusies en
Toezicht op klinisch onderzoek bij STZ-ziekenhuizen Farmaceutische Bedrijven Deelteam Klinisch Onderzoek Toezicht op klinisch onderzoek bij STZ-ziekenhuizen Bevindingen vanuit de praktijk Conclusies en
Monitorplan voorbeeld
 Monitorplan voorbeeld Protocol Er moet in het protocol beschreven worden dat er monitoring plaatsvindt (zie ook CCMO voorbeeld template). Het monitoringplan mag als bijlage worden toegevoegd (in dat geval
Monitorplan voorbeeld Protocol Er moet in het protocol beschreven worden dat er monitoring plaatsvindt (zie ook CCMO voorbeeld template). Het monitoringplan mag als bijlage worden toegevoegd (in dat geval
Toezicht op onderzoeker geïnitieerd klinisch onderzoek (IIT) Team Klinisch Onderzoek
 Toezicht op onderzoeker geïnitieerd klinisch onderzoek (IIT) 2014-2016 Team Klinisch Onderzoek Toezicht op IIT 2014-2016 Aanleiding en werkwijze Bevindingen vanuit de praktijk Conclusies en aandachtspunten
Toezicht op onderzoeker geïnitieerd klinisch onderzoek (IIT) 2014-2016 Team Klinisch Onderzoek Toezicht op IIT 2014-2016 Aanleiding en werkwijze Bevindingen vanuit de praktijk Conclusies en aandachtspunten
RISK BASED MONITORING IIS FROM AN ACADEMIC PERSPECTIVE; SURGICAL SPECIALTIES
 RISK BASED MONITORING IIS FROM AN ACADEMIC PERSPECTIVE; SURGICAL SPECIALTIES 8 Oktober 2014, DCTF Onderzoeksbureau Divisie Heelkundige Specialismen UMC Utrecht Marianne van Es-Gulinck, arts, F.F.P.M. RISK
RISK BASED MONITORING IIS FROM AN ACADEMIC PERSPECTIVE; SURGICAL SPECIALTIES 8 Oktober 2014, DCTF Onderzoeksbureau Divisie Heelkundige Specialismen UMC Utrecht Marianne van Es-Gulinck, arts, F.F.P.M. RISK
Standard Operating Procedure
 Standard Operating Procedure STZ SOP: VL2 Aanpassen proefpersoneninformatie / toestemmingsformulier aan lokale situatie Distributielijst : STZ Datum : 20-03-2014 Revisiedatum : 20-03-2015 Veranderingen
Standard Operating Procedure STZ SOP: VL2 Aanpassen proefpersoneninformatie / toestemmingsformulier aan lokale situatie Distributielijst : STZ Datum : 20-03-2014 Revisiedatum : 20-03-2015 Veranderingen
Ongewenste voorvallen flow AE SAE SAR SUSAR SADE voor onderzoeker geïnitieerd WMO-plichtig onderzoek
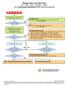 Ongewenste voorvallen flow AE SAE SAR SUSAR SADE voor onderzoeker geïnitieerd WMO-plichtig onderzoek Melding voorval proefpersoon aan onderzoeker/arts 1 Rapportage voorval door onderzoeker/arts in patiëntenstatus
Ongewenste voorvallen flow AE SAE SAR SUSAR SADE voor onderzoeker geïnitieerd WMO-plichtig onderzoek Melding voorval proefpersoon aan onderzoeker/arts 1 Rapportage voorval door onderzoeker/arts in patiëntenstatus
Toezicht op kwaliteitsborging: ken uw verantwoordelijkheden
 Toezicht op kwaliteitsborging: ken uw verantwoordelijkheden Elysée Hille Karina van Wonderen namens deelteam Klinisch Onderzoek-GCP Afdeling Farmaceutische Bedrijven Workshop Kwaliteitsbewaking door samenwerking
Toezicht op kwaliteitsborging: ken uw verantwoordelijkheden Elysée Hille Karina van Wonderen namens deelteam Klinisch Onderzoek-GCP Afdeling Farmaceutische Bedrijven Workshop Kwaliteitsbewaking door samenwerking
Site selectie visite checklist
 Site selectie visite checklist Informatie sponsor: Naam sponsor: Contactpersoon: Functie: Afdeling: Telefoonnummer : Email : Informatie onderzoekslocatie: Naam onderzoekslocatie : Naam onderzoeker: Functie:
Site selectie visite checklist Informatie sponsor: Naam sponsor: Contactpersoon: Functie: Afdeling: Telefoonnummer : Email : Informatie onderzoekslocatie: Naam onderzoekslocatie : Naam onderzoeker: Functie:
Standard Operating Procedure
 Standard Operating Procedure STZ SOP: VC9 Proefpersonen- en aansprakelijkheidsverzekering (centraal) Distributielijst : STZ Datum : 10-03-2014 Revisiedatum : 10-03-2015 Veranderingen ten opzichte van eerdere
Standard Operating Procedure STZ SOP: VC9 Proefpersonen- en aansprakelijkheidsverzekering (centraal) Distributielijst : STZ Datum : 10-03-2014 Revisiedatum : 10-03-2015 Veranderingen ten opzichte van eerdere
Toezicht op IIT: bevindingen vanuit de praktijk
 Toezicht op IIT: bevindingen vanuit de praktijk Elysée Hille, senior inspecteur namens deelteam KO-GCP Teamcoördinator KO-GCP/PhV/GZH Afdeling Farmaceutische Bedrijven Wat doet de IGZ? Toezicht op klinisch
Toezicht op IIT: bevindingen vanuit de praktijk Elysée Hille, senior inspecteur namens deelteam KO-GCP Teamcoördinator KO-GCP/PhV/GZH Afdeling Farmaceutische Bedrijven Wat doet de IGZ? Toezicht op klinisch
Standard Operating Procedure
 Standard Operating Procedure STZ SOP: VC8 Beoordeling amendement toetsende commissie (centraal) Distributielijst : STZ Datum : 10-03-2014 Revisiedatum : 10-03-2015 Veranderingen ten opzichte van eerdere
Standard Operating Procedure STZ SOP: VC8 Beoordeling amendement toetsende commissie (centraal) Distributielijst : STZ Datum : 10-03-2014 Revisiedatum : 10-03-2015 Veranderingen ten opzichte van eerdere
Standard Operating Procedure
 Standard Operating Procedure STZ SOP: U10 Audit Distributielijst : STZ Datum : 19-06-2014 Revisiedatum : 19-06-2015 Veranderingen ten opzichte van eerdere versies Versiedatum Opmerkingen Versiedatum Opmerkingen
Standard Operating Procedure STZ SOP: U10 Audit Distributielijst : STZ Datum : 19-06-2014 Revisiedatum : 19-06-2015 Veranderingen ten opzichte van eerdere versies Versiedatum Opmerkingen Versiedatum Opmerkingen
Toezicht op klinisch onderzoek: bevindingen uit inspecties bij GGZ instellingen
 Toezicht op klinisch onderzoek: bevindingen uit inspecties bij GGZ instellingen Afdeling Farmaceutische Bedrijven, Klinisch Onderzoek Good Clinical Practice Inhoud Wat doet de IGJ aan toezicht op klinisch
Toezicht op klinisch onderzoek: bevindingen uit inspecties bij GGZ instellingen Afdeling Farmaceutische Bedrijven, Klinisch Onderzoek Good Clinical Practice Inhoud Wat doet de IGJ aan toezicht op klinisch
Standard Operating Procedure
 Standard Operating Procedure STZ SOP: A4 Publicatie Distributielijst : STZ Datum : 20-03-2014 Revisiedatum : 20-03-2015 Veranderingen ten opzichte van eerdere versies Versiedatum Opmerkingen Versiedatum
Standard Operating Procedure STZ SOP: A4 Publicatie Distributielijst : STZ Datum : 20-03-2014 Revisiedatum : 20-03-2015 Veranderingen ten opzichte van eerdere versies Versiedatum Opmerkingen Versiedatum
De rol van de Contract Research Organisatie (CRO) Klinisch onderzoek
 De rol van de Contract Research Organisatie (CRO) in klinisch geneesmiddelenonderzoek Klinisch onderzoek Inhoud Aanleiding CRO project Methode en resultaten» Werkwijze en resultaten foto van het veld vragenlijst»
De rol van de Contract Research Organisatie (CRO) in klinisch geneesmiddelenonderzoek Klinisch onderzoek Inhoud Aanleiding CRO project Methode en resultaten» Werkwijze en resultaten foto van het veld vragenlijst»
Standard Operating Procedure
 Standard Operating Procedure STZ SOP: VL5 Protocolamendement (lokaal) Distributielijst : STZ Datum : 03-06-2014 Revisiedatum : 03-06-2015 Veranderingen ten opzichte van eerdere versies Versiedatum Opmerkingen
Standard Operating Procedure STZ SOP: VL5 Protocolamendement (lokaal) Distributielijst : STZ Datum : 03-06-2014 Revisiedatum : 03-06-2015 Veranderingen ten opzichte van eerdere versies Versiedatum Opmerkingen
Standard Operating Procedure
 Standard Operating Procedure STZ SOP: VL4 Investigator Site File Distributielijst : STZ Datum : 03-06-2014 Revisiedatum : 03-06-2015 Veranderingen ten opzichte van eerdere versies Versiedatum Opmerkingen
Standard Operating Procedure STZ SOP: VL4 Investigator Site File Distributielijst : STZ Datum : 03-06-2014 Revisiedatum : 03-06-2015 Veranderingen ten opzichte van eerdere versies Versiedatum Opmerkingen
IC ICF ICH ISF. Lijst met afkortingen, definities en termen STZ-Kwaliteitshandboek SOP s
 Lijst met afkortingen, definities en termen STZ-Kwaliteitshandboek SOP s ABR ADR AE AR BROK CCMO CRF CTA CV DSMB EMEA EU EudraCT FU brief GCP GMP IB IC ICF ICH IMPD ISF MEB METC EU RCT SAE SOP SPC SUSAR
Lijst met afkortingen, definities en termen STZ-Kwaliteitshandboek SOP s ABR ADR AE AR BROK CCMO CRF CTA CV DSMB EMEA EU EudraCT FU brief GCP GMP IB IC ICF ICH IMPD ISF MEB METC EU RCT SAE SOP SPC SUSAR
CCMO Structuur documenten Technische Toetsing (ass.secr.) Inhoudelijke Toetsing (secretaris)
 CHECKLIST WMO Primaire indieningsproces WMO in METC Management, screening door Assistent Secretaris. Hieronder staan de generieke uitgangspunten en is toegelicht hoe de primaire toetsing indiening WMO
CHECKLIST WMO Primaire indieningsproces WMO in METC Management, screening door Assistent Secretaris. Hieronder staan de generieke uitgangspunten en is toegelicht hoe de primaire toetsing indiening WMO
Standard Operating Procedure
 Standard Operating Procedure STZ SOP: A1 Afsluiting studie Distributielijst : STZ Datum : 03-06-2014 Revisiedatum : 03-06-2015 Veranderingen ten opzichte van eerdere versies Versiedatum Opmerkingen Versiedatum
Standard Operating Procedure STZ SOP: A1 Afsluiting studie Distributielijst : STZ Datum : 03-06-2014 Revisiedatum : 03-06-2015 Veranderingen ten opzichte van eerdere versies Versiedatum Opmerkingen Versiedatum
Standard Operating Procedure
 Standard Operating Procedure STZ SOP: U1 Identificatie, werving en pre-screening proefpersonen Distributielijst : STZ Datum : 19-06-2014 Revisiedatum : 19-06-2015 Veranderingen ten opzichte van eerdere
Standard Operating Procedure STZ SOP: U1 Identificatie, werving en pre-screening proefpersonen Distributielijst : STZ Datum : 19-06-2014 Revisiedatum : 19-06-2015 Veranderingen ten opzichte van eerdere
Aanvraagformulier REGISTRATIE centraal oncologie datamanager
 Aanvraagformulier REGISTRATIE centraal oncologie datamanager 1. Gegevens aanvrager Naam + Voorletters:... Adres:... Postcode + Woonplaats:.... Geboortedatum:... Geboorteplaats:... Werkzaam bij: Organisatie
Aanvraagformulier REGISTRATIE centraal oncologie datamanager 1. Gegevens aanvrager Naam + Voorletters:... Adres:... Postcode + Woonplaats:.... Geboortedatum:... Geboorteplaats:... Werkzaam bij: Organisatie
Jouw GCP up-to-date in 45 minuten. Marieke Meulemans, oprichter GCP Central
 Jouw GCP up-to-date in 45 minuten Marieke Meulemans, oprichter GCP Central Waarom een GCP update tijdens de CRA dag? Gedreven Meesterschap. Meesterschap is vakmanschap. Vakmanschap is beheersing van het
Jouw GCP up-to-date in 45 minuten Marieke Meulemans, oprichter GCP Central Waarom een GCP update tijdens de CRA dag? Gedreven Meesterschap. Meesterschap is vakmanschap. Vakmanschap is beheersing van het
Titel: Good Clinical Practice & Monitoring. Initiation Investigator Driven Studies. Versie: 14-jan-2013
 Titel: Good Clinical Practice & Monitoring Initiation Investigator Driven Studies Inhoud Wet- en regelgeving/declaration of Helsinki Good Clinical Practice Patiënteninformatie/ informed consent Basisvereisten
Titel: Good Clinical Practice & Monitoring Initiation Investigator Driven Studies Inhoud Wet- en regelgeving/declaration of Helsinki Good Clinical Practice Patiënteninformatie/ informed consent Basisvereisten
Standard Operating Procedure
 Standard Operating Procedure SOP: V9 Initiatievisite Auteur Naam: Functie instelling/afdeling Judie van den Elshout Staffunctionaris Wetenschapsbureau Wetenschapsbureau / Cluster Leerhuis Handtekening:...
Standard Operating Procedure SOP: V9 Initiatievisite Auteur Naam: Functie instelling/afdeling Judie van den Elshout Staffunctionaris Wetenschapsbureau Wetenschapsbureau / Cluster Leerhuis Handtekening:...
Inhoud onderzoeksdossier
 Inhoud onderzoeksdossier (documenten in de witte box zijn nodig voor de primaire beoordeling) A. Brieven B. Formulieren C. Onderzoeksprotocol en protocolamendementen D. Productinformatie E. Informatie
Inhoud onderzoeksdossier (documenten in de witte box zijn nodig voor de primaire beoordeling) A. Brieven B. Formulieren C. Onderzoeksprotocol en protocolamendementen D. Productinformatie E. Informatie
Standard Operating Procedure
 Standard Operating Procedure STZ SOP: U4 Registratie /randomisatie procedure Distributielijst : STZ Datum : 19-06-2014 Revisiedatum : 19-06-2015 Veranderingen ten opzichte van eerdere versies Versiedatum
Standard Operating Procedure STZ SOP: U4 Registratie /randomisatie procedure Distributielijst : STZ Datum : 19-06-2014 Revisiedatum : 19-06-2015 Veranderingen ten opzichte van eerdere versies Versiedatum
Handleiding. Investigational Medicinal Product Dossier (IMPD)
 Handleiding Investigational Medicinal Product Dossier (IMPD) Inhoudsopgave Afkortingen... - 3 - Wat is het IMPD?... - 4 - Beslisschema inhoud IMPD... - 5 - Beschrijving inhoud IMPD... - 6 - Overzicht hoofdstukken
Handleiding Investigational Medicinal Product Dossier (IMPD) Inhoudsopgave Afkortingen... - 3 - Wat is het IMPD?... - 4 - Beslisschema inhoud IMPD... - 5 - Beschrijving inhoud IMPD... - 6 - Overzicht hoofdstukken
INFORMATIEBLAD. Maart 2011
 INFORMATIEBLAD AANMELDING TRIALBUREAU/DATACENTRUM Maart 2011 Kanker zo snel mogelijk terugdringen en onder controle brengen. We zijn er voor mensen die leven met kanker en de mensen die met hen samenleven.
INFORMATIEBLAD AANMELDING TRIALBUREAU/DATACENTRUM Maart 2011 Kanker zo snel mogelijk terugdringen en onder controle brengen. We zijn er voor mensen die leven met kanker en de mensen die met hen samenleven.
nee nee nee Wordt proefpersoon aan handelingen onderworpen of gedragswijze opgelegd?
 Medischwetenschappelijk onderzoek en deelname proefpersonen? Wordt proefpersoon aan handelingen onderworpen of gedragswijze opgelegd? Worden behandelingen met elkaar via randomisatie vergeleken? Vallen
Medischwetenschappelijk onderzoek en deelname proefpersonen? Wordt proefpersoon aan handelingen onderworpen of gedragswijze opgelegd? Worden behandelingen met elkaar via randomisatie vergeleken? Vallen
Standard Operating Procedure
 Standard Operating Procedure STZ SOP: U8 Melding van (Serious) Adverse Events en SUSARs Distributielijst : STZ Datum : 19-06-2014 Revisiedatum : 19-06-2015 Veranderingen ten opzichte van eerdere versies
Standard Operating Procedure STZ SOP: U8 Melding van (Serious) Adverse Events en SUSARs Distributielijst : STZ Datum : 19-06-2014 Revisiedatum : 19-06-2015 Veranderingen ten opzichte van eerdere versies
Kwaliteitsborging Geneesmiddelenonderzoek UMC Utrecht Jaarverslag 2007 Bureau Kwaliteitsborging Onderzoek
 Kwaliteitsborging Geneesmiddelenonderzoek UMC Utrecht Jaarverslag 2007 Bureau Kwaliteitsborging Onderzoek UMC Utrecht Julius Centrum voor Gezondheidswetenschappen en Eerstelijns Geneeskunde Clinical Trial
Kwaliteitsborging Geneesmiddelenonderzoek UMC Utrecht Jaarverslag 2007 Bureau Kwaliteitsborging Onderzoek UMC Utrecht Julius Centrum voor Gezondheidswetenschappen en Eerstelijns Geneeskunde Clinical Trial
29 juni Initiatie bijeenkomst PORTEC 4. Kwaliteitsborging WMO GCP richtsnoer. Frank van Leeuwen IKNL
 29 juni 2012 Initiatie bijeenkomst PORTEC 4 Kwaliteitsborging WMO GCP richtsnoer Frank van Leeuwen IKNL Wet en regelgeving Verklaring van Helsinki Richtsnoer voor Good Clinical Practice (CPMP/ICH/135/95)
29 juni 2012 Initiatie bijeenkomst PORTEC 4 Kwaliteitsborging WMO GCP richtsnoer Frank van Leeuwen IKNL Wet en regelgeving Verklaring van Helsinki Richtsnoer voor Good Clinical Practice (CPMP/ICH/135/95)
STATEC trial praktische uitvoering Hilde Dijcker
 STATEC trial praktische uitvoering 17-04-2018 Hilde Dijcker Inhoud IKNL trialbureau Site activation Datamanagement Monitoring IKNL Trialbureau Site activation: - Ine Leenen en Hilde Dijcker Kwaliteit van
STATEC trial praktische uitvoering 17-04-2018 Hilde Dijcker Inhoud IKNL trialbureau Site activation Datamanagement Monitoring IKNL Trialbureau Site activation: - Ine Leenen en Hilde Dijcker Kwaliteit van
MDR (2017/745) en klinisch onderzoek - Implementatie in Nederland -
 MDR (2017/745) en klinisch onderzoek - Implementatie in Nederland - DCRF 26 september 2018 Monique Al Teamcoördinator Landelijk Bureau CCMO MDR: Drie hoofdcategoriën klinisch onderzoek I II III Klinisch
MDR (2017/745) en klinisch onderzoek - Implementatie in Nederland - DCRF 26 september 2018 Monique Al Teamcoördinator Landelijk Bureau CCMO MDR: Drie hoofdcategoriën klinisch onderzoek I II III Klinisch
Het Clinical Research Bureau (CRB) van VUmc
 1 Het Clinical Research Bureau (CRB) van VUmc Angela Vlug Kwaliteitsborging van mensgebonden onderzoek 1 Het Clinical Research Bureau heeft als doel om optimale kwaliteit van de uitvoering van mensgebonden
1 Het Clinical Research Bureau (CRB) van VUmc Angela Vlug Kwaliteitsborging van mensgebonden onderzoek 1 Het Clinical Research Bureau heeft als doel om optimale kwaliteit van de uitvoering van mensgebonden
Aanvraagformulier REGISTRATIE CENTRAAL ONCOLOGIE DATAMANAGER GEGEVENS AANVRAGER
 GEGEVENS AANVRAGER Naam + Voorletters Voorna(a)m(en) Adres Postcode + Woonplaats Geboortedatum Geboorteplaats E-mailadres/telefoon Lidmaatschapsnummer NVvOD geen lid Datum preregistratie CDM Werkervaring
GEGEVENS AANVRAGER Naam + Voorletters Voorna(a)m(en) Adres Postcode + Woonplaats Geboortedatum Geboorteplaats E-mailadres/telefoon Lidmaatschapsnummer NVvOD geen lid Datum preregistratie CDM Werkervaring
Standard Operating Procedure
 Standard Operating Procedure STZ SOP: U11 Voortgangsrapportage Distributielijst : STZ Datum : 19-06-2014 Revisiedatum : 19-06-2015 Veranderingen ten opzichte van eerdere versies Versiedatum Opmerkingen
Standard Operating Procedure STZ SOP: U11 Voortgangsrapportage Distributielijst : STZ Datum : 19-06-2014 Revisiedatum : 19-06-2015 Veranderingen ten opzichte van eerdere versies Versiedatum Opmerkingen
Standard Operating Procedure
 Standard Operating Procedure STZ SOP: O3 Ontwikkelen, implementeren en beheren van SOP s Distributielijst : STZ Datum : 15-10-2012 Revisiedatum : 15-10-2013 Veranderingen ten opzichte van eerdere versies
Standard Operating Procedure STZ SOP: O3 Ontwikkelen, implementeren en beheren van SOP s Distributielijst : STZ Datum : 15-10-2012 Revisiedatum : 15-10-2013 Veranderingen ten opzichte van eerdere versies
Klinisch onderzoek beter mogelijk met een EPD. Prof. Dr. H. Pieterse Profess Medical Consultancy Voorzitter NVMA 3 juni 2010
 1 Klinisch onderzoek beter mogelijk met een EPD Prof. Dr. H. Pieterse Profess Medical Consultancy Voorzitter NVMA 3 juni 2010 Agenda 2 Aan welke wettelijke eisen moet mensgebonden onderzoek in Nederland
1 Klinisch onderzoek beter mogelijk met een EPD Prof. Dr. H. Pieterse Profess Medical Consultancy Voorzitter NVMA 3 juni 2010 Agenda 2 Aan welke wettelijke eisen moet mensgebonden onderzoek in Nederland
Antwoorden CRO-vragenlijst - foto van het veld
 Antwoorden CRO-vragenlijst - foto van het veld In samenwerking met het RIVM heeft de Inspectie voor de Gezondheidszorg (IGZ) een digitale vragenlijst ontwikkeld die bestond uit drie delen (zie Vragenlijst
Antwoorden CRO-vragenlijst - foto van het veld In samenwerking met het RIVM heeft de Inspectie voor de Gezondheidszorg (IGZ) een digitale vragenlijst ontwikkeld die bestond uit drie delen (zie Vragenlijst
Standard Operating Procedure
 Standard Operating Procedure STZ SOP: U5 Datamanagement Distributielijst : STZ Datum : 19-06-2014 Revisiedatum : 19-06-2015 Veranderingen ten opzichte van eerdere versies Versiedatum Opmerkingen Versiedatum
Standard Operating Procedure STZ SOP: U5 Datamanagement Distributielijst : STZ Datum : 19-06-2014 Revisiedatum : 19-06-2015 Veranderingen ten opzichte van eerdere versies Versiedatum Opmerkingen Versiedatum
Standard Operating Procedure
 Standard Operating Procedure STZ SOP: A2 Archiveren studie Distributielijst : STZ Datum : 03-06-2014 Revisiedatum : 03-06-2015 Veranderingen ten opzichte van eerdere versies Versiedatum Opmerkingen Versiedatum
Standard Operating Procedure STZ SOP: A2 Archiveren studie Distributielijst : STZ Datum : 03-06-2014 Revisiedatum : 03-06-2015 Veranderingen ten opzichte van eerdere versies Versiedatum Opmerkingen Versiedatum
Aanmelden medischwetenschappelijk
 Aanmelden medischwetenschappelijk onderzoek SOP Aanmelden WMO-plichtig onderzoek_versie juli 2016.doc Pagina 1 van 10 Aanmelden WMO-plichtig onderzoek 1. Doel Het beschrijven van de procedure die gevolgd
Aanmelden medischwetenschappelijk onderzoek SOP Aanmelden WMO-plichtig onderzoek_versie juli 2016.doc Pagina 1 van 10 Aanmelden WMO-plichtig onderzoek 1. Doel Het beschrijven van de procedure die gevolgd
Europese verordening klinische proeven. Harrie Storms (VWS)
 Europese verordening klinische proeven Harrie Storms (VWS) 1 Veranderingen EU verordening Indiening via EU-portal (nationale studies en multinationale studies) Centrale beoordeling van multinationaal onderzoek
Europese verordening klinische proeven Harrie Storms (VWS) 1 Veranderingen EU verordening Indiening via EU-portal (nationale studies en multinationale studies) Centrale beoordeling van multinationaal onderzoek
Handleiding Goedkeuringsprocedure Raad van Bestuur Zuyderland wetenschappelijk onderzoek
 Handleiding Goedkeuringsprocedure Raad van Bestuur Zuyderland wetenschappelijk onderzoek INLEIDING oor al het onderzoek dat binnen Zuyderland wordt uitgevoerd moet goedkeuring worden verkregen van de Raad
Handleiding Goedkeuringsprocedure Raad van Bestuur Zuyderland wetenschappelijk onderzoek INLEIDING oor al het onderzoek dat binnen Zuyderland wordt uitgevoerd moet goedkeuring worden verkregen van de Raad
Procedure aanvraag voor het verrichten van wetenschappelijk onderzoek in Meander Medisch Centrum
 Procedure aanvraag voor het verrichten van wetenschappelijk onderzoek in Meander Medisch Centrum Commissie Toetsing Wetenschappelijk Onderzoek (TWO) I II Algemeen 1. Alvorens onderzoek in Meander MC van
Procedure aanvraag voor het verrichten van wetenschappelijk onderzoek in Meander Medisch Centrum Commissie Toetsing Wetenschappelijk Onderzoek (TWO) I II Algemeen 1. Alvorens onderzoek in Meander MC van
Handleiding Goedkeuringsprocedure Raad van Bestuur Zuyderland voor wetenschappelijk onderzoek
 Handleiding Goedkeuringsprocedure Raad van Bestuur Zuyderland voor wetenschappelijk onderzoek Deze handleiding wordt voortdurend geupdate naar aanleiding van de meest recente wet- en regelgeving en wijzigingen
Handleiding Goedkeuringsprocedure Raad van Bestuur Zuyderland voor wetenschappelijk onderzoek Deze handleiding wordt voortdurend geupdate naar aanleiding van de meest recente wet- en regelgeving en wijzigingen
Handleiding Goedkeuringsprocedure Raad van Bestuur Zuyderland voor wetenschappelijk onderzoek - Handleiding voor externe onderzoekers -
 Handleiding Goedkeuringsprocedure Raad van Bestuur Zuyderland voor wetenschappelijk onderzoek - Handleiding voor externe onderzoekers - Deze handleiding wordt voortdurend geupdate naar aanleiding van de
Handleiding Goedkeuringsprocedure Raad van Bestuur Zuyderland voor wetenschappelijk onderzoek - Handleiding voor externe onderzoekers - Deze handleiding wordt voortdurend geupdate naar aanleiding van de
Richtlijn Kwaliteitsborging Mensgebonden Onderzoek 2019
 NEDERLANDSE FEDERATIE VAN UNIVERSITAIR MEDISCHE CENTRA Richtlijn Kwaliteitsborging Mensgebonden Onderzoek 2019 maart 2019 Voorwoord Mede dankzij hun wereldwijd toonaangevende biomedisch- en gezondheidszorgonderzoek
NEDERLANDSE FEDERATIE VAN UNIVERSITAIR MEDISCHE CENTRA Richtlijn Kwaliteitsborging Mensgebonden Onderzoek 2019 maart 2019 Voorwoord Mede dankzij hun wereldwijd toonaangevende biomedisch- en gezondheidszorgonderzoek
BROK staat voor Basiscursus Regelgeving en Organisatie voor Klinisch onderzoekers.
 VEELGESTELDE VRAGEN OVER DE BROK CURSUS Wat is de BROK cursus? BROK staat voor Basiscursus Regelgeving en Organisatie voor Klinisch onderzoekers. Aan de uitvoering van mensgebonden onderzoek worden door
VEELGESTELDE VRAGEN OVER DE BROK CURSUS Wat is de BROK cursus? BROK staat voor Basiscursus Regelgeving en Organisatie voor Klinisch onderzoekers. Aan de uitvoering van mensgebonden onderzoek worden door
Checklist (en toelichting) bij het indienen van een WMO-plichtig onderzoeksdossier
 Checklist (en toelichting) bij het indienen van een WMO-plichtig onderzoeksdossier In onderstaande tabel staan de documenten die u moet indienen als u een onderzoek wilt laten beoordelen door de METC-WU.
Checklist (en toelichting) bij het indienen van een WMO-plichtig onderzoeksdossier In onderstaande tabel staan de documenten die u moet indienen als u een onderzoek wilt laten beoordelen door de METC-WU.
Checklist Lokale Uitvoerbaarheid
 Primaire indieningsproces Lokale Uitvoerbaarheid in METC Management, screening door Assistent Secretaris. Hieronder staan de generieke uitgangspunten en is toegelicht hoe de toetsing indiening Lokale Uitvoerbaarheid
Primaire indieningsproces Lokale Uitvoerbaarheid in METC Management, screening door Assistent Secretaris. Hieronder staan de generieke uitgangspunten en is toegelicht hoe de toetsing indiening Lokale Uitvoerbaarheid
KWALITEITSHANDBOEK WETENSCHAPSBELEID KENNEMER GASTHUIS EN SPAARNE ZIEKENHUIS. Organisatie en richtlijnen medisch-wetenschappelijk onderzoek
 KWALITEITSHANDBOEK WETENSCHAPSBELEID KENNEMER GASTHUIS EN SPAARNE ZIEKENHUIS Organisatie en richtlijnen medisch-wetenschappelijk onderzoek april 2014 Inhoudsopgave 1. INLEIDING 1.1. Organisatie wetenschap
KWALITEITSHANDBOEK WETENSCHAPSBELEID KENNEMER GASTHUIS EN SPAARNE ZIEKENHUIS Organisatie en richtlijnen medisch-wetenschappelijk onderzoek april 2014 Inhoudsopgave 1. INLEIDING 1.1. Organisatie wetenschap
Standard Operating Procedure
 Standard Operating Procedure STZ SOP: U2 Informed consent Distributielijst : STZ Datum : 19-06-2014 Revisiedatum : 19-06-2015 Veranderingen ten opzichte van eerdere versies Versiedatum Opmerkingen Versiedatum
Standard Operating Procedure STZ SOP: U2 Informed consent Distributielijst : STZ Datum : 19-06-2014 Revisiedatum : 19-06-2015 Veranderingen ten opzichte van eerdere versies Versiedatum Opmerkingen Versiedatum
Checklist (en toelichting) bij het indienen van een WMO-plichtig onderzoeksdossier
 Checklist (en toelichting) bij het indienen van een WMO-plichtig onderzoeksdossier In onderstaande tabel staan de documenten die u moet indienen als u een onderzoek wilt laten beoordelen door de METC-WU.
Checklist (en toelichting) bij het indienen van een WMO-plichtig onderzoeksdossier In onderstaande tabel staan de documenten die u moet indienen als u een onderzoek wilt laten beoordelen door de METC-WU.
Kwaliteit: Minder is meer
 Kwaliteit: Minder is meer Kwaliteit in klinisch onderzoek met medische hulpmiddelen Jako Pranger QA Manager Cardialysis 9 Nov 2012 Kwaliteit en integriteit Mensgebonden onderzoek Trends in kwaliteitsbeleving
Kwaliteit: Minder is meer Kwaliteit in klinisch onderzoek met medische hulpmiddelen Jako Pranger QA Manager Cardialysis 9 Nov 2012 Kwaliteit en integriteit Mensgebonden onderzoek Trends in kwaliteitsbeleving
Op naar het snel opstarten van klinisch onderzoek in Nederland!
 Op naar het snel opstarten van klinisch onderzoek in Nederland! Marika Trieling Voorzitter DCRF werkgroep Lokale uitvoerbaarheid 12 februari 2019 Wat is er in Nederland nodig? Verkorten tijdslijnen van
Op naar het snel opstarten van klinisch onderzoek in Nederland! Marika Trieling Voorzitter DCRF werkgroep Lokale uitvoerbaarheid 12 februari 2019 Wat is er in Nederland nodig? Verkorten tijdslijnen van
CRO s kwaliteit en toegevoegde waarde
 CRO s kwaliteit en toegevoegde waarde dr. Annejet P. Meijler Programmadirecteur Geneesmiddelen IGZ 1 Medisch-wetenschappelijk onderzoek 4 april 2011 Deze workshop Inleiding I prof. Herman Pieterse Inleiding
CRO s kwaliteit en toegevoegde waarde dr. Annejet P. Meijler Programmadirecteur Geneesmiddelen IGZ 1 Medisch-wetenschappelijk onderzoek 4 april 2011 Deze workshop Inleiding I prof. Herman Pieterse Inleiding
Aanmelden WMO-plichtig onderzoek
 Aanmelden WMO-plichtig onderzoek 1. Doel Het beschrijven van de procedure die gevolgd wordt bij het aanmelden van onderzoek dat onder de WMO valt en waarbij ZGV optreedt als deelnemend centrum. Voordat
Aanmelden WMO-plichtig onderzoek 1. Doel Het beschrijven van de procedure die gevolgd wordt bij het aanmelden van onderzoek dat onder de WMO valt en waarbij ZGV optreedt als deelnemend centrum. Voordat
Ervaringen met document X
 Martini Ziekenhuis Groningen Ervaringen met document X Ellen Rusch, wetenschappelijk medewerker Wetenschappelijk Instituut Wat gaan we doen? Structuur lokale haalbaarheid Martini Ziekenhuis Het werken
Martini Ziekenhuis Groningen Ervaringen met document X Ellen Rusch, wetenschappelijk medewerker Wetenschappelijk Instituut Wat gaan we doen? Structuur lokale haalbaarheid Martini Ziekenhuis Het werken
Monitoren vs auditen. CRA dag 21 april 2016
 Monitoren vs auditen CRA dag 21 april 2016 Introductie Freelance consultant, mede oprichter TAPAS Group B.V. Mede oprichter/directeur van CRA B.V. Medical Adviser Yamanouchi Pharma Clinical trial monitor
Monitoren vs auditen CRA dag 21 april 2016 Introductie Freelance consultant, mede oprichter TAPAS Group B.V. Mede oprichter/directeur van CRA B.V. Medical Adviser Yamanouchi Pharma Clinical trial monitor
Checklist en toelichting indienen Lokale Uitvoerbaarheid
 Checklist en toelichting indienen Lokale Uitvoerbaarheid In onderstaande tabel staan de documenten die u moet indienen als u toestemming wilt van de Raad van Bestuur VUmc voor uitvoering van uw onderzoek
Checklist en toelichting indienen Lokale Uitvoerbaarheid In onderstaande tabel staan de documenten die u moet indienen als u toestemming wilt van de Raad van Bestuur VUmc voor uitvoering van uw onderzoek
(Industrie geïnitieerd) Onderzoek in de STZ Omgeving' Joep Dille (j.dille@isala.nl) Manager wetenschapsbureau Isala klinieken, Zwolle
 (Industrie geïnitieerd) Onderzoek in de STZ Omgeving' Joep Dille (j.dille@isala.nl) Manager wetenschapsbureau Isala klinieken, Zwolle Take home message Ga op zoek naar wat mensen drijft en sluit daarbij
(Industrie geïnitieerd) Onderzoek in de STZ Omgeving' Joep Dille (j.dille@isala.nl) Manager wetenschapsbureau Isala klinieken, Zwolle Take home message Ga op zoek naar wat mensen drijft en sluit daarbij
1. Beschrijving werkgebieden / thema s
 1. Beschrijving werkgebieden / thema s Nr 1 Thema Wetenschappelijke Achtergrond en Opzet van Onderzoek 2 Ethische en veiligheid overwegingen 3 Ontwikkeling en Regelgeving 4 Clinical Trial Operations (Projectorganisatie)
1. Beschrijving werkgebieden / thema s Nr 1 Thema Wetenschappelijke Achtergrond en Opzet van Onderzoek 2 Ethische en veiligheid overwegingen 3 Ontwikkeling en Regelgeving 4 Clinical Trial Operations (Projectorganisatie)
De laatste versie van dit document is te downloaden op: www.umcutrecht.nl/metc. Indienen documenten bij de METC UMC Utrecht
 Indienen documenten bij de METC UMC Utrecht Begin hier Bekijk in onderstaande tabel wat u wilt indienen. Kijk daarna welke methode van indiening en welke documenten bij uw indiening horen. Volg bij het
Indienen documenten bij de METC UMC Utrecht Begin hier Bekijk in onderstaande tabel wat u wilt indienen. Kijk daarna welke methode van indiening en welke documenten bij uw indiening horen. Volg bij het
Opleiding PECB ISO 9001 Quality Manager.
 Opleiding PECB ISO 9001 Quality Manager www.bpmo-academy.nl Wat is kwaliteitsmanagement? Kwaliteitsmanagement beoogt aan te sturen op het verbeteren van kwaliteit. Tevens houdt het zich bezig met het verbinden
Opleiding PECB ISO 9001 Quality Manager www.bpmo-academy.nl Wat is kwaliteitsmanagement? Kwaliteitsmanagement beoogt aan te sturen op het verbeteren van kwaliteit. Tevens houdt het zich bezig met het verbinden
Checklist en toelichting indienen Lokale Uitvoerbaarheid
 Checklist en toelichting indienen Lokale Uitvoerbaarheid In onderstaande tabel staan de documenten die u moet indienen als u toestemming wilt van de Raad van Bestuur VUmc voor uitvoering van uw onderzoek
Checklist en toelichting indienen Lokale Uitvoerbaarheid In onderstaande tabel staan de documenten die u moet indienen als u toestemming wilt van de Raad van Bestuur VUmc voor uitvoering van uw onderzoek
Recente ontwikkelingen in de ethische normen voor medisch-wetenschappelijk onderzoek
 Recente ontwikkelingen in de ethische normen voor medisch-wetenschappelijk onderzoek Prof dr JJM van Delden Julius Centrum, UMC Utrecht j.j.m.vandelden@umcutrecht.nl Inleiding Medisch-wetenschappelijk
Recente ontwikkelingen in de ethische normen voor medisch-wetenschappelijk onderzoek Prof dr JJM van Delden Julius Centrum, UMC Utrecht j.j.m.vandelden@umcutrecht.nl Inleiding Medisch-wetenschappelijk
Gedigitaliseerd onderzoek..
 Gedigitaliseerd onderzoek.. ITC Validation Consultants an extra measure of Quality Frans Leijse Managing Director GSK Global QA-eCompliance Manager Adviseurs voor.. GxP compliance van ICT Systemen Computer
Gedigitaliseerd onderzoek.. ITC Validation Consultants an extra measure of Quality Frans Leijse Managing Director GSK Global QA-eCompliance Manager Adviseurs voor.. GxP compliance van ICT Systemen Computer
Wat verwacht de Inspectie van Klinisch onderzoek?
 Wat verwacht de Inspectie van Klinisch onderzoek? Jos Kraus, senior inspecteur Inspectie voor de gezondheidszorg Baarn, 7 oktober 009. Wat is klinisch onderzoek Introductie Definities De weg door de wet
Wat verwacht de Inspectie van Klinisch onderzoek? Jos Kraus, senior inspecteur Inspectie voor de gezondheidszorg Baarn, 7 oktober 009. Wat is klinisch onderzoek Introductie Definities De weg door de wet
Standard Operating Procedure
 Standard Operating Procedure STZ SOP: U6 Studie medicatie Distributielijst : STZ Datum : 19-06-2014 Revisiedatum : 19-06-2015 Veranderingen ten opzichte van eerdere versies Versiedatum Opmerkingen Versiedatum
Standard Operating Procedure STZ SOP: U6 Studie medicatie Distributielijst : STZ Datum : 19-06-2014 Revisiedatum : 19-06-2015 Veranderingen ten opzichte van eerdere versies Versiedatum Opmerkingen Versiedatum
Praktisch: Wetenschappelijk onderzoek in het Elisabeth-TweeSteden Ziekenhuis. Procedure niet-wmo-plichtig klinisch wetenschappelijk onderzoek
 Wetenschappelijk onderzoek in het Elisabeth-TweeSteden Ziekenhuis Procedure niet-wmo-plichtig klinisch wetenschappelijk onderzoek Deze procedure geldt voor niet-wmo-plichtig onderzoek dat of: a) enkel
Wetenschappelijk onderzoek in het Elisabeth-TweeSteden Ziekenhuis Procedure niet-wmo-plichtig klinisch wetenschappelijk onderzoek Deze procedure geldt voor niet-wmo-plichtig onderzoek dat of: a) enkel
EU verordening no 536/2014 betreffende klinische proeven met geneesmiddelen voor menselijk gebruik
 EU verordening no 536/2014 betreffende klinische proeven met geneesmiddelen voor menselijk gebruik -Implicaties voor onderzoekers- Paula Vossebeld Symposium van de V&VN RP 10 november 2015 Verordening
EU verordening no 536/2014 betreffende klinische proeven met geneesmiddelen voor menselijk gebruik -Implicaties voor onderzoekers- Paula Vossebeld Symposium van de V&VN RP 10 november 2015 Verordening
WMO-GCP opfriscursus Nederlandse Vereniging voor Oncologie Datamanagers 27 februari 2019
 WMO-GCP opfriscursus Nederlandse Vereniging voor Oncologie Datamanagers 27 februari 2019 Agenda Introductie ICH-GCP R2 AVG Kwaliteitssyteem Informed Consent ISF e-tmf Monitoren SAE rapportage Waarom wetgeving?
WMO-GCP opfriscursus Nederlandse Vereniging voor Oncologie Datamanagers 27 februari 2019 Agenda Introductie ICH-GCP R2 AVG Kwaliteitssyteem Informed Consent ISF e-tmf Monitoren SAE rapportage Waarom wetgeving?
VOORBEEL. De expert is verbonden aan mijn vakgroep/instituut. Ik heb samen met een datamanagement expert intern het DMP opgesteld.
 DMP title Project Name Voorbeeld ingevuld DMP 'Analgosedation after cardiac surgery in infants: A "model-based" nation-wide randomized controlled trial' - DMP title Principal Investigator / Researcher
DMP title Project Name Voorbeeld ingevuld DMP 'Analgosedation after cardiac surgery in infants: A "model-based" nation-wide randomized controlled trial' - DMP title Principal Investigator / Researcher
Veel gestelde vragen Melden voorvallen/bijwerkingen bij geneesmiddelenonderzoek
 Veel gestelde vragen Melden voorvallen/bijwerkingen bij geneesmiddelenonderzoek Wat is een SUSAR? SUSAR is de afkorting van Suspected Unexpected Serious Adverse Reaction. In het Nederlands betekent dit
Veel gestelde vragen Melden voorvallen/bijwerkingen bij geneesmiddelenonderzoek Wat is een SUSAR? SUSAR is de afkorting van Suspected Unexpected Serious Adverse Reaction. In het Nederlands betekent dit
SEMINAR 4 NOVEMBER 2014
 SEMINAR 4 NOVEMBER 2014 Professioneel opzetten en uitvoeren van klinisch onderzoek www.deresearchmanager.nl Striksteeg 7 7411 KR Deventer 0570 594 789 info@deresearchmanager.nl Ontwikkeling Afdeling Innovatie
SEMINAR 4 NOVEMBER 2014 Professioneel opzetten en uitvoeren van klinisch onderzoek www.deresearchmanager.nl Striksteeg 7 7411 KR Deventer 0570 594 789 info@deresearchmanager.nl Ontwikkeling Afdeling Innovatie
DE MONITOR. Bijlage 1
 DE MONITOR Bijlage 1 legenda procesfase rol voorbereidingsfase v=verantwoordelijk uitvoeringsfase p= partner gerealiseerd evaluatiefase Geen actie agenda werkgroep aandachtslevel regisseur **** direct
DE MONITOR Bijlage 1 legenda procesfase rol voorbereidingsfase v=verantwoordelijk uitvoeringsfase p= partner gerealiseerd evaluatiefase Geen actie agenda werkgroep aandachtslevel regisseur **** direct
Jaarverslag Medisch Ethische Toetsingscommissie Universitair Medisch Centrum Utrecht
 Jaarverslag 2014 Medisch Ethische Toetsingscommissie Universitair Medisch Centrum Utrecht INHOUD Voorwoord van de voorzitter blz. 3 Samenvatting blz. 4 Summary blz. 5 Hoofdstuk 1. Samenstelling commissie
Jaarverslag 2014 Medisch Ethische Toetsingscommissie Universitair Medisch Centrum Utrecht INHOUD Voorwoord van de voorzitter blz. 3 Samenvatting blz. 4 Summary blz. 5 Hoofdstuk 1. Samenstelling commissie
SOP: Voorlichtingsgesprek en uitgesteld informed consent CONTRAST trials
 SOP: Voorlichtingsgesprek en uitgesteld informed consent CONTRAST trials SOP: IC1 Versie Nr.: 1.1 Geldig m.i.v.: 03-04-2018 Auteur: S.A. van den Berg, arts-onderzoeker AMC Autorisator: Dr. H.B. van der
SOP: Voorlichtingsgesprek en uitgesteld informed consent CONTRAST trials SOP: IC1 Versie Nr.: 1.1 Geldig m.i.v.: 03-04-2018 Auteur: S.A. van den Berg, arts-onderzoeker AMC Autorisator: Dr. H.B. van der
Procedure monocenter WMO-plichtig klinisch wetenschappelijk onderzoek
 Wetenschappelijk onderzoek in het Elisabeth-TweeSteden Ziekenhuis Procedure monocenter WMO-plichtig klinisch wetenschappelijk onderzoek Bij dit type onderzoek vindt het WMO-plichtig onderzoek enkel plaats
Wetenschappelijk onderzoek in het Elisabeth-TweeSteden Ziekenhuis Procedure monocenter WMO-plichtig klinisch wetenschappelijk onderzoek Bij dit type onderzoek vindt het WMO-plichtig onderzoek enkel plaats
De ECTR: een kans voor Nederland! Annelies van Woudenberg, DCRF congres, 5 oktober 2016
 De ECTR: een kans voor Nederland! Annelies van Woudenberg, DCRF congres, 5 oktober 2016 European Clinical Trial Regulation 536/ 2014 European Clinical Trial Regulation (ECTR): EU Verordening betreffende
De ECTR: een kans voor Nederland! Annelies van Woudenberg, DCRF congres, 5 oktober 2016 European Clinical Trial Regulation 536/ 2014 European Clinical Trial Regulation (ECTR): EU Verordening betreffende
Procedure multicenter WMO-plichtig klinisch wetenschappelijk onderzoek geïnitieerd vanuit het Elisabeth-TweeSteden Ziekenhuis
 Wetenschappelijk onderzoek in het Elisabeth-TweeSteden Ziekenhuis Procedure multicenter WMO-plichtig klinisch wetenschappelijk onderzoek geïnitieerd vanuit het Elisabeth-TweeSteden Ziekenhuis Bij dit type
Wetenschappelijk onderzoek in het Elisabeth-TweeSteden Ziekenhuis Procedure multicenter WMO-plichtig klinisch wetenschappelijk onderzoek geïnitieerd vanuit het Elisabeth-TweeSteden Ziekenhuis Bij dit type
Business as (un)usual
 Business as (un)usual Beperking van de impact van incidenten begint vandaag! Aon Global Risk Consulting Business Continuity Practice Continuiteit = basis voor succesvol ondernemen.voor u business as usual?
Business as (un)usual Beperking van de impact van incidenten begint vandaag! Aon Global Risk Consulting Business Continuity Practice Continuiteit = basis voor succesvol ondernemen.voor u business as usual?
Jaarverslag CTCM ENABLING RESEARCH, OUR QUALITY
 Jaarverslag CTCM ENABLING RESEARCH, OUR QUALITY ENABLING RESEARCH, OUR QUALITY Dit is CTCM De mooie mijlpaal van het 10-jarige jubileum en alle veelbelovende ontwikkelingen maken dat we trots terug én
Jaarverslag CTCM ENABLING RESEARCH, OUR QUALITY ENABLING RESEARCH, OUR QUALITY Dit is CTCM De mooie mijlpaal van het 10-jarige jubileum en alle veelbelovende ontwikkelingen maken dat we trots terug én
Clinical Trials in Nederland 25 april 2013
 Clinical Trials in Nederland 25 april 2013 Leonie Middelink * Bestuurslid NVFG Head Clinical Operations - Roche * Spreekt op persoonlijke titel Imago versus facts and figures Is de ietwat negatieve perceptie
Clinical Trials in Nederland 25 april 2013 Leonie Middelink * Bestuurslid NVFG Head Clinical Operations - Roche * Spreekt op persoonlijke titel Imago versus facts and figures Is de ietwat negatieve perceptie
KLINISCH GENEESMIDDELEN- ONDERZOEK
 KLINISCH GENEESMIDDELEN- ONDERZOEK HET PROCES VAN HET OPSTARTEN VAN KLINISCH ONDERZOEK MET GENEESMIDDELEN GAAT VERANDEREN De ECTR verandert het klinisch onderzoek met geneesmiddelen in Europa. Dit heeft
KLINISCH GENEESMIDDELEN- ONDERZOEK HET PROCES VAN HET OPSTARTEN VAN KLINISCH ONDERZOEK MET GENEESMIDDELEN GAAT VERANDEREN De ECTR verandert het klinisch onderzoek met geneesmiddelen in Europa. Dit heeft
Europese en landelijke ontwikkelingen ter verbetering van medicijnonderzoek bij kinderen. Jos Gilissen. DCRF Jaarcongres-26Sep2018
 Europese en landelijke ontwikkelingen ter verbetering van medicijnonderzoek bij kinderen. Jos Gilissen DCRF Jaarcongres-26Sep2018 This project has received funding from the Innovative Medicines Initiative
Europese en landelijke ontwikkelingen ter verbetering van medicijnonderzoek bij kinderen. Jos Gilissen DCRF Jaarcongres-26Sep2018 This project has received funding from the Innovative Medicines Initiative
Concept procedure Lokale Haalbaarheid
 -------------------------------------------------------------------------------------------------------------------------------------------- Opzet pilot Stap 2 Lokale Haalbaarheid ter voorbereiding op
-------------------------------------------------------------------------------------------------------------------------------------------- Opzet pilot Stap 2 Lokale Haalbaarheid ter voorbereiding op
Research informatie- en datamanagement nieuwe taken voor bibliotheken in wetenschappelijke communicatie en ondersteuning bij onderzoek
 OCLC Contactdag 12 oktober 2017 Research informatie- en datamanagement nieuwe taken voor bibliotheken in wetenschappelijke communicatie en ondersteuning bij onderzoek Jacquelijn Ringersma Wageningen University
OCLC Contactdag 12 oktober 2017 Research informatie- en datamanagement nieuwe taken voor bibliotheken in wetenschappelijke communicatie en ondersteuning bij onderzoek Jacquelijn Ringersma Wageningen University
Kwaliteitsborging mensgebonden onderzoek 2.0 Nederlandse Federatie van Universitair Medische Centra
 Kwaliteitsborging mensgebonden onderzoek 2.0 Nederlandse Federatie van Universitair Medische Centra 12.6053 1/34 Voorwoord Voor de universitair medische centra (umc s) is onderzoek met proefpersonen een
Kwaliteitsborging mensgebonden onderzoek 2.0 Nederlandse Federatie van Universitair Medische Centra 12.6053 1/34 Voorwoord Voor de universitair medische centra (umc s) is onderzoek met proefpersonen een
NFU NEDERLANDSE FEDERATIE VAN UNIVERSITAIR MEDISCHE CENTRA
 Kwaliteitsborging van mensgebonden onderzoek NFU NEDERLANDSE FEDERATIE VAN UNIVERSITAIR MEDISCHE CENTRA Kwaliteitsborging van mensgebonden onderzoek Nederlandse Federatie van Universitair Medische Centra
Kwaliteitsborging van mensgebonden onderzoek NFU NEDERLANDSE FEDERATIE VAN UNIVERSITAIR MEDISCHE CENTRA Kwaliteitsborging van mensgebonden onderzoek Nederlandse Federatie van Universitair Medische Centra
Checklist en toelichting indienen WMO amendement uitbreiding centrum
 Checklist en toelichting indienen WMO amendement uitbreiding centrum In onderstaande tabel staan de documenten die u moet indienen als u een amendement uitbreiding centrum wilt laten beoordelen door de
Checklist en toelichting indienen WMO amendement uitbreiding centrum In onderstaande tabel staan de documenten die u moet indienen als u een amendement uitbreiding centrum wilt laten beoordelen door de
Standard Operating Procedure
 Standard Operating Procedure SOP: V1 Ontwikkelen Onderzoeksprotocol Auteur Naam: Functie instelling/afdeling Judie van den Elshout Staffunctionaris Wetenschapsbureau Wetenschapsbureau / Cluster Leerhuis
Standard Operating Procedure SOP: V1 Ontwikkelen Onderzoeksprotocol Auteur Naam: Functie instelling/afdeling Judie van den Elshout Staffunctionaris Wetenschapsbureau Wetenschapsbureau / Cluster Leerhuis
