Deeltjes (of golven?) in Dozen. e. van den berg december 2005 g.j. schooten l. van dijk. project. Moderne Natuurkunde. op het VWO
|
|
|
- Erika Maes
- 8 jaren geleden
- Aantal bezoeken:
Transcriptie
1 Deeltjes (of golven?) in Dozen In a) nanodraden, in b) gebiedjes met maximum geleidbaarheid (di/dv) die dus laten zien waar vrije elektronen zijn gelokaliseerd. Die zijn opgesloten tussen de nanodraden: deeltjes in doosjes! d.j.hoekzema Woudschoten Conferentie e. van den berg december 005 g.j. schooten l. van dijk project Moderne Natuurkunde op het VWO
2 Inhoud Inhoud... 1 De Workshop... 1 Overzicht... 1 Deeltjes (golven) in Dozen (1)... 3 Conceptuele Vragen I: Golven, deeltjes, doosjes, golffuncties Werkblad 3.: Deeltje in de Doos PMN Oefenopgaven Conceptuele vragen II...17 PMN Examen de tijdvak 005 Quantumdots Correctievoorschrift: De Quantum dot Geleiding tussen nanodraden, hoe kijk je daar met een deeltje-in-doos model naar?... 1 Werkblad 3.: Deeltje in de Doos (Antwoorden)... 3 De Workshop In de workshop: a) presenteren we het deeltje-in-doos model; b) visualiseren we de conceptuele aspecten met applets; c) hebben we kleine groep discussies over conceptuele vragen rond het doosjesmodel; d) gaan we er even mee rekenen; en e) geven we aan hoe PMN materiaal eventueel als verrijking gebruikt kan worden bij de moderne natuurkunde van het reguliere programma en delen we daarvoor materiaal uit. Overzicht In het Project Moderne Natuurkunde hebben we gekozen voor het eenvoudige deeltje (golf!)-in-doos model i.p.v. het Schrödinger model. Het deeltje-in-doos model is wiskundig vrij eenvoudig en geeft mooie illustraties van quantumeffecten zoals kwantisatie, waarschijnlijkheid, deeltje-golf karakter en hoe fysici daarmee om gaan. In sommige gevallen zoals bij atoomspectra, kloppen deeltje-in-doos berekeningen absoluut niet. In andere gevallen (zie volgend artikel) geeft het model aardige orde-vangrootte schattingen, o.a. bij een aantal recente quantum toepassingen in de sterrenkunde en in nanoscience. Het is mogelijk leerlingen in een paar lessen aan dit model te laten ruiken. We nemen dan aan dat leerlingen al kennis gemaakt hebben met het golf-deeltje karakter van materie via het foto-elektrisch effect, elektrondiffractie, en dubbele spleet experimenten. Er zijn een aantal dubbele spleet applets op het web (bv. kies quantum experimenten 1 ). We hebben zelf in PMN een uitgebreid werkblad gemaakt voor 1 les rond een Duitse simulatie met de naam Doppelspalt. Meer informatie daarover is op aanvraag beschikbaar. In dit boekje concentreren we ons dus op het deeltje/golf-in-doos model. In een eerste les kan het deeltje in doos model geïntroduceerd worden zoals in het eerste deel van het hiernavolgende NVOX artikel. Als een deeltje zich als golf gedraagt, hoe pas je die golf in een 1- dimensionaal doosje? Daaruit volgt dan een energie formule die kwantisatie oplevert van de kinetische energie (formule 3). Eventueel kunnen leerlingen zelf een stukje van de afleiding doen aan de hand van opgave 38 (later in dit boekje). Men kan dan een aantal kwalitatieve voorbeelden behandelen van het deeltje-in-doos model zoals bindingen tussen atomen (zie 4 van het NVOX artikel). 1 Het mooie quantum interferentie experiment met o.a. een spleten simulatie, werkt niet altijd of vereist veranderingen in computerinstellingen. De indeling in 1ste les, de les, etc. moet niet al te strikt geïnterpreteerd worden. Bepaalde onderdelen kunnen meer of minder tijd kosten. 1
3 In een tweede les kan een uitstapje worden gemaakt naar golffuncties en interpretatie. Na een inleiding door de docent, kunnen leerlingen aan de slag met een setje conceptuele vragen. De derde les gaat terug naar het model. De uitbreiding naar dimensies is gemakkelijk te doen. Er is een fantastisch applet ( ) om klassieke -dimensionale trillingen te laten zien en de betekenis van quantumgetallen te illustreren. De frequenties in x- en y-richting van het membraam kunnen worden ingesteld in de hokjesmatrix onder het simulatieraam. Doe daarna werkblad 3. voor oefening van leerlingen. Naast een leerlingversie, is ook een versie met antwoorden opgenomen in deze bundel. Intermezzo: Werkblad 3. gaat over kunstmatige atomen waarin elektronen in dimensies zijn opgesloten. De belangrijkste reden is dat het doosjesmodel voor echte atomen niet werkt, is dat het geen rekening houdt met de elektrische ladingen in het atoom. De modelberekeningen kloppen dus niet met echte atomen maar wel met -dimensionale quantumputjes die met halfgeleiders gemaakt kunnen worden...een soort van kunstmatige atomen. In de vierde en vijfde les kan men willekeurige opgaven uit het NVOX artikel en het PMN materiaal kiezen. Bijvoorbeeld de schatting van typische energieverschillen in atomen en in de kern, en tussen energieniveaus van de kern en van quarks (NVOX artikel). Verder zijn er PMN oefen opgaven (in dit boekje) en tenslotte is er een grote verzameling School Examen opgaven waarvan enkele in dit boekje zijn opgenomen. Ook hebben we nog een tweede collectie conceptuele vragen waarmee leerlingen in groepjes hun begrip kunnen oefenen en docenten rond kunnen gaan om begripsproblemen te onderscheppen.
4 Deeltjes (golven) in Dozen (1) 3 Quantumfysica op het VWO Dick Hoekzema, Ed van den Berg, PMN, Centrum voor Betadidactiek, Universiteit Utrecht Leo van Dijk, RSG NO Veluwe, Epe Gert Schooten, Agnieten College Locatie Carolus Clusius, Zwolle Inleiding Het deeltje-in-de-doos is een vast onderdeel van elke inleiding in de quantumfysica. We herinneren het ons vast nog wel. Maar wat dat deeltje-in-de-doos nu met quantummechanica te maken had is misschien verdronken in het rekenwerk van een typisch college quantummechanica. Dat is jammer, want de grote verdienste van het doosjesmodel is nu juist dat het met weinig rekenwerk inzicht geeft in een aantal essentiële facetten van de quantumfysica. Bovendien blijkt het deeltje-in-de-doos niet alleen een belangrijk didactisch hulpmiddel te zijn, maar levert het in bepaalde gevallen ook nog eens redelijk goede voorspellingen op. Dat is toch wel verrassend voor wie altijd dacht dat je voor redelijke uitkomsten op zijn minst een Schrödingervergelijking met een realistische potentiaal moest gebruiken. In het Project Moderne Natuurkunde (PMN) op het VWO hebben we de Schrödingervergelijking links laten liggen. Dat was een brug te ver en de nadruk ligt binnen het project meer op conceptuele aspecten, die we niet wilden laten ondersneeuwen door wiskundige problemen. Toch wilden we naast een kwalitatieve behandeling van verschillen tussen klassieke en quantumfysica ook iets kwantitatiefs. Vooral door Piet Lijnses Aula (1981) over quantumfysica hebben we besloten het deeltje-in-de-doos in het PMN op te nemen, omdat Piet liet zien dat je toch wel heel leuke dingen kon doen met die quantumdoosjes, zowel in kwalitatief als in kwantitatief opzicht. Dat besluit is inmiddels goed bevallen, omdat het model acceptabele resultaten blijkt te geven voor veel meer verschijnselen dan we oorspronkelijk dachten. In eerste instantie werd het model gebruikt omdat er orde-van-grootte schattingen van de diameters van atomen, kernen, en elementaire deeltjes mee kunnen worden gemaakt en omdat de kleuren van bepaalde typen kleurstoffen er mee kunnen worden voorspeld. Maar er kan veel meer. Het model kan bijvoorbeeld gebruikt worden om een kwalitatief inzicht te geven in het ontstaan van covalente binding (waarom is het voor atomen voordelig om elektronen te delen?). Er kunnen kwantitatieve schattingen mee gemaakt worden van de stevigheid van materialen en er kunnen verschijnselen mee verklaard worden die zich afspelen in sterkernen en bij het ontstaan van supernova s. Het model duikt op allerlei plaatsen in het project op, soms voor kwalitatieve inzichten of ruwe orde-van-grootte schattingen maar soms ook bij kwantitatieve berekeningen waar heel aardige resultaten uitkomen, bijvoorbeeld bij een opgave over de schatting van de elasticiteit van diamant en bij een schatting van de massa van aangeslagen toestanden van het proton. Bij zeer actuele natuurkunde zoals die van quantumputjes (quantum dots), wordt het model zelfs door onderzoekers gebruikt, wat de mogelijkheid geeft om bij zeer actuele ontwikkelingen aan te sluiten Inmiddels is gebleken dat NT leerlingen na een korte gewenningsperiode het werken met het doosjesmodel aan kunnen. Op de school van een van ons (Leo) gaven leerlingen zelfs interessante presentaties over toepassingen van deeltjes-in-dozen nadat ze eerder vastgelopen leken in het onderwerp. De projectdocenten hebben zelf ook tijd nodig om ervaring met het doosjesmodel en zijn toepassingen op te doen. We denken dat met het toenemen van deze ervaring de resultaten nog beter zullen worden. 3 Dit artikel verscheen in iets andere lay-out in NVOX, September 005, p De vergelijking tussen het deeltje in de doos en het waterstof atom aan het eind, is toegevoegd. 3
5 In dit artikel geven we u een beknopte introductie van het doosjesmodel in de paragrafen I en II. In paragraaf III bespreken we het nut van het model bij het verkrijgen van een kwalitatief inzicht in het waterstofatoom. Vervolgens illustreren we de vruchtbaarheid van het model met allerlei voorbeelden waar het goede orde-van-grootte schattingen of zelfs kwantitatief redelijke voorspellingen geeft (IV VI). Voor complete leerlingentekst, opgaven, en uitwerkingen van ons hoofdstuk over quantumfysica verwijzen we naar onze website: paragraaf 3b en volgende. In een volgend artikel hopen we in te gaan op quantumputjes, oftewel quantum dots, de elektronische componenten van de toekomst. I. Spectra en energieniveaus Gassen onder lage druk geven bij excitatie een spectrum van heldere lijnen. Bij absorptie van wit licht door koele gassen is er een spectrum van donkere lijnen (Fraunhofer spectrum). Uit deze emissie- of absorptielijnenspectra kunnen we energieniveaus afleiden zoals voor het waterstofatoom (figuur a). Hieruit blijkt dat een gebonden elektron alleen discrete energiewaarden kan hebben en geen waarden ertussen in. Dit verschijnsel de zogenaamde quantisatie van de energie van deeltjes kan niet klassiek worden verklaard. Immers: volgens de klassieke natuurkunde kunnen voorwerpen (deeltjes) als een voetbal, fiets, of vliegtuig willekeurige energieën hebben, die continu variëren. Toch komt quantisatie ook in de klassieke natuurkunde voor: bij trillingen van een snaar, bv. van een gitaar. Alleen heel bepaalde golven en frequenties zijn mogelijk: grondtoon en boventonen. Quantisatie is dus niet nieuw, het is al bekend sinds Pythagoras (Bunge, 003a, b), en het heeft te maken met golven. Op dit punt in de introductie van het doosjesmodel, laten we altijd nog even de staande golven van een slinky zien, ook als die al eerder gedemonstreerd zijn. II. Deeltje in doos In PMN hoofdstuk over golven en deeltjes hebben leerlingen al kennis gemaakt met verschijnselen als elektrondiffractie en dus het golfkarakter van niet-gebonden deeltjes. Die kunnen als een lopende golf beschreven worden en zijn daarmee wiskundig identiek aan de lopende golf in een oneindig lang koord. Een snaar resoneert alleen bij bepaalde vaste frequenties, overeenkomend met de staande golven die erin kunnen optreden. Staande golven krijg je door golven op te sluiten, in dit geval door de snaar aan twee kanten in te klemmen. De golven worden bij de uiteinden teruggekaatst en door interferentie van de heenlopende en teruglopende golven ontstaat de staande golf. Staande golven treden op in ieder systeem waarin golven worden opgesloten. Ook het elektron in een atoom is opgesloten. Als elektronen zich in een atoom inderdaad gedragen als golven, dan moeten ook hier staande golven optreden, en hetzelfde moet gelden voor iedere quantumgolf in een afgesloten systeem, oftewel voor ieder gebonden deeltje. Nog even terug naar de snaar. Wanneer een snaar van lengte L aan beide kanten is ingeklemd, past er een halve sinus op (grondtoon), een hele sinus (1 ste boventoon), anderhalve sinus ( de boventoon), of n keer een halve sinus (figuur ). Daarmee correspondeert de volgende relatie tussen golflengte en snaarlengte: λ = L (1) n We nemen nu een ééndimensionaal doosje en sluiten een deeltje daarin op. Het model, dat we dan hebben is wiskundig identiek aan de ingeklemde snaar zoals het vrije quantumdeeltje wiskundig identiek is aan een lopende golf in een oneindig lang koord. In het doosjesmodel kan het deeltje dus beschreven worden door de staande golven, die we ook in een snaar krijgen (figuur 1). De natuurkundige betekenis van de golffuncties in figuur 1 is echter totaal anders dan die van de staande golven in de snaar. Leerlingen moeten echt beseffen dat er geen sprake is van een trillend deeltje. Wat er op en neer trilt is niet het 4
6 deeltje, maar het zogenaamde deeltjesveld, dat door de golffunctie wordt beschreven. Dit deeltjesveld speelt precies dezelfde rol als het elektromagnetisch veld bij fotonen. A B C Golffunctie Golffunctie Golffunctie Locatie in doos Locatie in doos Locatie in doos Figuur 1 Trillingen van een snaar als analogie voor golffuncties van een deeltje in een doos. Wat hebben die golffuncties van figuur 1 nu met het deeltje te maken? De gangbare interpretatie, die ook in het PMN wordt gebruikt, is die van de waarschijnlijkheid. Deze interpretatie is in het lesmateriaal al eerder aan de orde gekomen naar aanleiding van de bekende foto s van interferentiepatronen van het twee-spleten experiment. In de waarschijnlijkheidsinterpretatie geeft het kwadraat van amplitudo van de staande golffunctie de kans aan om het deeltje op een bepaalde plaats langs de x-as aan te treffen. We oefenen met een paar plaatjes zoals in figuur 1 en vragen leerlingen aan te geven waar de waarschijnlijkheid het grootst is om het deeltje aan te treffen. Soms is er een neiging om juist de knopen te kiezen i.p.v.de buiken (want daar komt het deeltje altijd langs ). Dat wijst op een typische begripsfout, die er echt even goed uitgeoefend moet worden. Wanneer voor leerlingen de betekenis van de staande golven in het doosje voldoende duidelijk is geworden leiden we een formule af voor de energie van een deeltje in een doos. Omdat het deeltje binnen de doos alleen kinetische energie heeft, mogen we het verband tussen kinetische energie en golflengte gebruiken, dat bij een vrij deeltje is afgeleid uit de relaties tussen impuls en golflengte en tussen impuls en kinetische energie: h p = (1) en λ 1 1 E mv ( mv ) m kin = = = p m dus E kin h = mλ () Als we nu het verband (formule (1)) tussen λ en L inbrengen voor de grondtoon en de diverse boventonen van de snaar (dit doen we samen met de leerlingen) dan krijgen we de bekende formule: E nh = 8mL kin, n (3) Hierin is n een geheel getal (n = 1,, 3,..) dat aangeeft om welke energietoestand het gaat; n =1 hoort bij de grondtoestand (grondtoon), n = bij de eerste aangeslagen toestand (eerste boventoon) enz. Als we de energie uitdrukken in eenheden van h²/(8m.l²) dan krijgen we als energiewaarden dus 1, 4 (²), 9, 16, enz. Figuur b laat een typisch energieniveauschema zien. Wat hebben we nu bereikt? Quantisatie! We hebben nu voor het elektron een discreet energiespectrum gevonden. Het getal n wordt quantumgetal genoemd; het is typerend voor het verschijnsel quantisatie, dat op zijn beurt weer een van de kernverschijnselen van de quantumfysica is. Quantisatie komt voor bij elk gebonden deeltje; alleen vrij deeltjes hebben geen quantisatie van hun energie. 5
7 III Vergelijking tussen het waterstofatoom en het deeltje-in-de-doos Figuur geeft een vergelijking van de energiespectra van het waterstofatoom en het deeltje-in-de-doos. Beide spectra zijn gekwantiseerd, maar bij het deeltje-in-de-doos liggen hogere energieniveaus steeds verder uit elkaar terwijl bij het waterstofatoom de niveaus juist dichter bij elkaar liggen. Verder kent het doosjesmodel, in tegenstelling tot het waterstofatoom geen ionisatieniveau. Het doosjesmodel geeft ons dus wel een discreet energiespectrum, maar het schiet tekort in de voorspelling van de juiste ligging van de niveaus. Dit hoeft ons niet te verbazen wanneer we de potentiële energiefunctie van het doosjesmodel met die van het waterstofatoom vergelijken (bijlage1). In bijlage 1 is een vergelijking gemaakt tussen het waterstofatoom en het deeltje-in-de-doos voor een kubusvormig doosje. Uit de tabel blijkt dat het doosjesmodel hoewel het in kwantitatief opzicht tekort schiet in kwalitatief opzicht wel degelijk inzicht verschaft in de eigenschappen van het waterstofatoom. Energie E n in h²/8.m.l² E 4 E 3 E E 1 Figuur a Energieniveaus waterstof Figuur b Energieniveaus deeltjein-de-doos In de volgende paragrafen bespreken we enkele toepassingen waarin het doosjesmodel niet alleen in kwalitatief opzicht, maar ook in kwantitatief opzicht redelijk tot goed werkt. IV. Covalente binding en metaalbinding Figuur 3 Kleine en grote doos, kleine en grote golflengte dus grote en kleine energie Wat gebeurt er bij molecuulvorming b.v als twee waterstofatomen samen H vormen? We vergelijken de waterstofatomen met doosjes. Links in figuur 3 is zo n doosje getekend. Rechts is een twee keer zo groot doosje getekend, een H molecuul. Waarom is een waterstofmolecuul energetisch voordeliger dan twee waterstofatomen? Welnu, de twee elektronen hebben nu een dubbel zo groot doosje beschikbaar. Een groter doosje betekent een grotere golflengte en dus een kleinere kinetische energie (formule ). 6
8 De beperking van het doosjesmodel blijkt wanneer we deze redenering op Helium loslaten en daarbij tevens gebruik maken van het Pauli-verbod, dat voorkomt dat de vier elektronen van een eventueel He molecuul allemaal in de grondtoestand gaan zitten. Dit werd op een van de PMN-scholen gedaan door twee leerlingen in het kader van een klein project over het PMN-quantumhoofdstuk. De leerlingen rekenden bindingsenergieën uit voor edelgassen in de hoop dat die negatief zouden zijn, dus geen voordeel bij delen van elektronen. In dat geval zou het Pauli-verbod meer energie hebben gekost dan het verdubbelen van de dooslengte zou hebben opgeleverd en zouden zij met het doosjesmodel hebben verklaard waarom edelgassen inderdaad geen molecuulbinding kunnen aangaan. Tot hun eigen (en aanvankelijk ook onze!) verrassing bleek echter ook bij edelgassen de bindingsenergie positief te zijn. De leerlingen hadden daarmee aan den lijve ervaren waarin het model tekort schoot. Zeer leerzaam! Figuur 4 Leerlingen presenteren over quantum mechanica. In de leerboeken lezen we dat er bij metaalbinding vrije elektronen zijn, die aan het metaalrooster gebonden zijn en niet aan individuele atomen. Het doosje van deze elektronen is dus het metaalrooster (een macropische doos) en i.p.v. het atoom. We kunnen nu dezelfde redenering toepassen als bij waterstof, dus groter doosje...lagere kinetische energie. Dat geeft dan de bindingsenergie van de metaalbinding. Door gebruik te maken van het Pauli-verbod en de doosjestoestanden vanaf de grondtoestand op te vullen totdat alle elektronen op zijn, vinden we bindingsenergieën van ongeveer 10 ev per vrij elektron. De werkelijke waarden zijn een orde van grootte kleiner (1 3 ev), maar we hebben dan ook geen enkele rekening gehouden met de aantrekking door de metaalionen. V. Energieverschillen binnen atomen, kernen en subatomaire deeltjes Verschillen in energieniveaus van elektronen in een atoom hebben typische waarden van enkele ev. Verschillen in energieniveaus in de atoomkern zijn in de orde van enkele MeV terwijl alfa-deeltjes die de kern uit tunnelen ook een energie van enkele MeV hebben. Kwalitatief kunnen we dit heel goed verklaren met grote en kleine doosjes. In het kleine doosje van de kern heeft het deeltje een kleinere golflengte en dus een hogere kinetische energie. Kwantitatief komen we ook redelijk ver. De orde van grootte van een atoom is m. De orde van grootte van een kern is m. Het energieverschil tussen het n = 1 niveau en het n = niveau in een doosjesatoom wordt dan: h 1 h h E E x 0 1 = = 310 8mL e 8mL e 8me (4) Het energieverschil tussen het n = 1 niveau en het n = niveau in een doosjeskern wordt: E kin h 1 h 3h h h = = = = 8mL 8mL 8mL 8m 8m x 1,6.10 e e p p e (5) waarbij in de laatste stap de massa van het proton is vervangen door de massa van het elektron. Het verschil tussen (5) en (4) is een factor Toch aardig, nietwaar? In een ander voorbeeld kunnen we uitrekenen wat voor energie elektronen moeten hebben om structuren kleiner dan de kern in kaart te brengen. Te denken valt aan de beroemde experimenten in de Stanford 7
9 lineaire versneller waaruit aanwijzingen kwamen voor het bestaan van quarks. Elektronen moeten voor dergelijke experimenten een golflengte hebben die kleiner is dan de afmetingen van de kern, b.v m. Volgens het doosjesmodel betekent dat een energie van 3, GeV. De experimenten waren gedaan met 0 30 GeV. Dat was blijkbaar genoeg om inelastische verstrooiing aan te tonen aan quarks in protonen. Lopen we nu weer tegen de grenzen van het doosjesmodel aan? Nee, toch niet. We zitten inmiddels bij energieën die relativistisch zijn. In plaats van E kin = ½.m.v² moeten we E kin = p.c gebruiken. In combinatie met p = h/λ en formule (1) krijgen we bij een ééndimensionaal model: E kin, n nhc = L (6) Passen we dit nu toe met L = m en n = 1, dan wordt E kin =, J = 6, GeV en dat is een redelijk orde van grootte. Bij elektronen van 0 GeV geeft dezelfde berekening een zeer acceptabele afstandsschaal van 3, m. Het laatste voorbeeld klopte kwantitatief toch al aardig, nietwaar? Het kan nog mooier! Laten we eens wat gaan rekenen aan een proton en zijn quarks. Een proton bestaat uit drie quarks: twee up-quarks (u) en een down-quark (d). De up-quarks hebben een massa van 3 MeV/c² en de down-quark heeft een massa van 6 MeV/c². De totale massa van de quarks komt daarmee op 1 MeV/c². De massa van het proton is echter 938 MeV/c². Het verschil van 96 MeV/c² zou het gevolg van de kinetische energie van de quarks moeten zijn. Laten we aannemen dat dit zo is. Dan is de kinetische energie van de quarks gelijk aan 96 MeV = 1, J. We beschouwen het proton nu als het doosje, waarin de drie quarks opgesloten zitten, en gebruiken formule (6) om uit de kinetische energie van de quarks de afmetingen van het proton te berekenen. Er geldt: E kin hc hc hc 3hc = + + = = 1, 5x10 L L L L 10 J voor de drie quarks samen. Hieruit vinden we L = 1, m. Alweer een aardig resultaat! We kunnen nog verder gaan. Er bestaan deeltjes met dezelfde quarksamenstelling als het proton. Ze hebben massa s vanaf ruim 100 MeV/c² en ze worden geïnterpreteerd als aangeslagen toestanden van het proton. Laten we dat eens uitproberen. Stel dat twee quarks zich in de n = 1 toestand bevinden en de derde in een n = toestand van het doosjesmodel. Kan dit de massa s van de genoemde deeltjes verklaren? De berekening gaat als volgt: hc hc hc 4hc 4 4 Ekin = + + = = x x J = x MeV = L L L L , Tellen we daar nog de massa s van de quarks bij op dan is het resultaat 147 MeV/c². Inderdaad zijn er aangeslagen toestanden van het proton in het MeV/c² interval. Het + - deeltje, dat samenstelling uud heeft en een massa van 13 MeV/c², is helaas een proton, waarin de spin combinatie van de quarks verschilt van die in het normale proton, en niet een proton met een quark in aangeslagen toestand. Dat zou ook bijna te mooi zijn geweest om waar te zijn! Het is goed dat we er even aan herinnerd worden dat het deeltje-in-doos model een simpel model is, MeV VI. Kleuren van een aantal stoffen met lange koolstofketens Dit onderdeel presenteren we in de vorm van een schoolexamenopgave die inderdaad redelijk gemaakt is door de leerlingen. Caroteen is een stof die voorkomt in bijvoorbeeld worteltjes en mango s. Het is een koolwaterstof met de molecuulformule C 40 H 56. Een model van het caroteenmolecuul is gegeven in figuur 5. 8
10 Figuur 5 Caroteen molecuul Volgens de theorie van moleculaire bindingen zijn er bij de bindingen in caroteen twee soorten elektrontoestanden betrokken. De zogenaamde σ-elektronen zitten op vaste plekken tussen de atomen. De π-elektronen bevinden zich in toestanden waarbij ze kunnen bewegen over de hele lengte van het molecuul 4. Op de π-elektronen is in goede benadering het (eendimensionale) deeltje-in-een-doos model van toepassing. Koolwaterstoffen ontstaan door de vorming van covalente bindingen tussen de koolstof- en waterstofatomen. Covalente bindingen komen tot stand doordat de totale energie lager wordt als atomen hun elektronen delen. p p 1 Leg uit hoe het delen van elektronen leidt tot het verlagen van de totale energie. Leg uit waarom helium, in tegenstelling tot waterstof, niet de neiging heeft om covalente bindingen aan te gaan. In figuur 6 is het absorptiespectrum van caroteen gegeven. Horizontaal staat de golflengte, vertikaal de mate van absorptie. Figuur 6 Absorptiespectrum caroteen 3p 3 Verklaar de kleur van worteltjes met behulp van dit spectrum. Bij caroteen blijkt dat er π-elektronen per molecuul zijn. Er is een energie nodig van,76 ev om het eerste π-elektron aan te slaan. 4 Meer informatie hierover kunt u vinden in prachtige kleurenplaatjes van moderne Algemene Chemie boeken zoals Brown et al (000) 9
11 3p 4p 4 5 Leg met behulp van het Pauli-principe uit welke energieniveaus betrokken zijn bij het aanslaan van het eerste π- elektron. Bereken de effectieve lengte waarlangs de elektronen volgens dit model vrij kunnen bewegen. Antwoorden: 1. Als atomen elektronen delen, komt er voor de elektronen een grotere ruimte ter beschikking, waardoor de golflengte groter kan worden. De kinetische energie per elektron wordt dan lager.. Bij helium zijn er twee elektronen in de grondtoestand. Volgens het uitsluitingsprincipe van Pauli passen er verder geen elektronen meer bij. Omdat de grondtoestand vol is kan het atoom pas elektronen delen als er een elektron naar een hoger energieniveau kan gaan en dat kost zoveel energie dat het niet leidt tot een energieverlaging. 3. Een groot deel van het licht met golflengten beneden de ~450 nm wordt geabsorbeerd, d.w.z. de blauwe kleur wordt weggefilterd. Wat gereflecteerd wordt, zijn de langere golflengten, d.w.z. in het rood tot groen. Samen geeft dit oranje. 4. In ieder energieniveau passen volgens het uitsluitingsprincipe van Pauli twee elektronen. Als er π-elektronen zijn, dan zijn er dus 11 niveaus volledig bezet. De minimale energie die nodig is om een elektron aan te slaan komt dan overeen met de overgang van n = 11 naar n = 1. nh 5. Volgens de energie van het deeltje in een doos geldt E = 8mL Voor de energieovergang van n = 11 naar n = 1 geldt dus dat: 19 h E =,76 ev = 4,78 10 J en tevens E = (1 11 ) 8 ml Hieruit volgt 34 (144 11)(6, ) L = = , ,80 10 m=1,80 nm In werkelijkheid is het antenne deel van het molecuul dit is het deel met de π bindingen:,4 nm lang. Wederom dus een verrassend aardige resultaat! Conclusie Het deeltje-in-de-doos is een uitstekend model om leerlingen vertrouwd te maken met de lastige conceptuele kant van de quantumfysica. Daarnaast stelt het ons in staat ook kwantitatieve quantumfysica te doen op het niveau van 6 VWO NT. Natuurlijk bestaat het gevaar dat het werken met het doosjesmodel verwordt tot een trucje dat PMN-leerlingen steeds uit de kast moeten toveren. Daarom proberen we rond de berekeningen ook steeds begripsvragen te stellen en besteden we in het lesmateriaal (zie website) veel aandacht aan golfaspecten en waarschijnlijkheidsinterpretaties van het deeltje/golf-in-de-doos. Een volgend artikel gaat over quantumputjes, waar het deeltje-in-doos-model niet slechts voor eerste orde benaderingen gebruikt wordt, maar voor echte berekeningen door onderzoekers. Noten 1. Waarom gebruiken we een sinus, dus met waarde 0 bij de wanden? Omdat de kans dat het deeltje buiten de doos is nul moet zijn (doos met oneindig hoge wanden) en omdat het kansverloop continu moet zijn.. Meer informatie hierover kunt u vinden in prachtige kleurenplaatjes van moderne boeken voor Algemene Chemie, zoals Brown et al (000). 3. Materiaal van het Project Moderne Natuurkunde vervangt domein F en wordt gebruikt op ongeveer 40 scholen. Er is een aangepast eindexamen. Geïnteresseerden kunnen contact opnemen met de auteurs via edberg51@planet.nl of d.j.hoekzema@phys.uu.nl. 10
12 Literatuur Brown, T.L., LeMay, H., Bursten, B.E. (000). Chemistry: The Central Science. Prentice Hall. Bunge, M., (003a). Twenty-five centuries of quantum physics. Science & Education, 1, Bunge, M. (003b). Quantons are quaint but basic and real, and the quantum theory explains much but not everything. Science & Education, 1, Lijnse, P.L. (1981). Kwantum mechanica: een eenvoudige inleiding. Utrecht, Het Spectrum (Aula paperback). The Nuffield Foundation. Waves, Particles, and Atoms; Nuffield Advanced Science, Physics, unit 10. Penguin Books Ltd., Harmondsworth, Middlesex, England,
13 Bijlage: Vergelijking tussen deeltje-in-de-doos en waterstofatoom Deeltje-in-de-doos potentiële energie in het midden oneindig veel lager dan aan de rand. E pot Waterstofatoom potentiële energiefunctie in het midden oneindig veel lager dan ver weg van de kern. 0 x 0 L x E pot 1/x (langs x-as) E pot is kubus-symmetrisch Discreet energiespectrum omdat golffunctie nul moet zijn aan de randen. Energietoestanden gekarakteriseerd door drie kubische quantumgetallen n x, n y, n z = 1,, 3,... Hoe hoger de quantumgetallen hoe meer knopen in de golffunctie in x-, y-, resp. z-richting Langs x-as: E pot is bolsymmetrisch Discreet energiespectrum omdat golffunctie nul moet zijn op grote afstand van de kern. Energietoestanden gekarakteriseerd door drie sferische quantumgetallen n, l, m Hoe hoger de quantumgetallen hoe meer knopen in de golffunctie in radiële richting (voor n), resp. tangentiële richting (voor l en m). Langs x-as (bij l = m = 0): n x = 1 n x = n x = 3 Omdat de kinetische energie in de doos volledig bepaald is heeft elke toestand een volledig bepaalde golflengte. Energieniveaus zijn te schrijven als: E n = (h²/8.m.l²).n², met n² = n x ² + n y ² + n z ² Er is dus ontaarding (meerdere toestanden met dezelfde energie). Ontaard zijn b.v.: (n x, n y, n z ) = (,1,1), (1,,1) en (1,1,) Orbitalen (kansplaatjes) geven een beeld van de waarschijnlijkheid het deeltje ergens aan te treffen. Hoe hoger de quantumgetallen, hoe hoger het aantal knooplijnen in de orbitalen. In het (x,y)-vlak: n = 1 n = n = 3 Omdat bij een gegeven toestand de potentiële energie toeneemt naar buiten toe, neemt de kinetische energie af en neemt de golflengte toe. Energieniveaus zijn te schrijven als: E n = (1 1/n²).13,6 ev Er is dus ontaarding (meerdere toestanden met dezelfde energie). Ontaard zijn alle toestanden (n,l,m) met dezelfde n. Orbitalen (kansplaatjes) geven een beeld van de waarschijnlijkheid het deeltje ergens aan te treffen. Hoe hoger de quantumgetallen, hoe hoger het aantal knooplijnen in de orbitalen. In het (x,z)-vlak: (1,1,1) (,1,1) (,,1) (1,0,0) (,0,0) (,1,0) 1s-orbitaal s-orbitaal p-orbitaal 1
14 Conceptuele Vragen I: Golven, deeltjes, doosjes, golffuncties O.a. uit Freedman/Young: University Physics, Addison-Wesley publishers. 1. Men laat een steen vallen van de bovenste verdieping van een gebouw. Verwaarloos het effect van luchtwrijving. Neemt de De Broglie golflengte toe of af gedurende de val of blijft deze golflengte hetzelfde? Leg uit.. Je moet een magnetensysteem ontwerpen dat een bundel elektronen met een energie van 54 ev naar een bepaalde plek stuurt. De elektron bundel mag niet meer dan 1,0 mm afwijken van die plek. Moet je in je ontwerp ook rekening houden met het golfkarakter van de elektronen? Leg uit. 3. Een elektron in een dubbele spleet experiment (zie figuur 1) landt op een afstand x van het centrale maximum. Als je die waarde x weet, kun je dan het pad van het elektron vaststellen? Figuur 1 Figuur 4. Waarom kan een elektronenmicroscoop een grotere vergroting hebben dan een gewone microscoop? 5. Het fosforescerende materiaal aan de binnenkant van een tl buis converteert UV (uitgezonden door de kwikdamp in de lamp) naar zichtbaar licht. Bestaan er ook stoffen die het omgekeerde kunnen doen, dus zichtbaar licht converteren naar UV? Leg uit. 6. Voor een deeltje in een doosje, hoe zou de klassieke kansverdeling eruit zien, als het deeltje zich gedroeg als een klassiek deeltje? Benadert de kansverdeling van een quantumdeeltje in een doos de klassieke verdeling wanneer n zeer groot wordt? 7. De golffunctie voor een deeltje in een doos is nul op bepaalde punten. Betekent dat dat het deeltje die punten niet kan passeren? Leg uit. 8. In het Bohr model van het waterstof atoom geldt dat hoe dichter een elektron bij de kern is, hoe kleiner de totale energie van het atoom. Is dat ook zo in het deeltje in doos model? 9. Een baan (Engels: orbit) is een duidelijk pad dat gevolgd wordt door een object. Een atomaire orbitaal is een gebiedje in de ruimte waar een elektron met een bepaalde energie gevonden kan worden. Wat zijn de overeenkomsten en verschillen tussen banen en orbitalen? 10. Als Planck s constante een biljoen maal groter zou zijn, wat zou dit dan betekenen voor ons atoommodel? Voor ons dagelijks leven? 11. Er zijn gebonden en vrije elektronen. Is de energie voor beiden gekwantiseerd of alleen voor een van de twee? Licht je antwoord toe door te denken aan de toepasbaarheid van ons deeltje-in-doos model. 1. De amplitudo van de golffunctie bepaalt de waarschijnlijkheid, en dit geeft het verband tussen de theorie en datgene wat je experimenteel kunt meten. Maar hoe zit het nu met het elektron als je niet meet? Waar is het dan? Of mag je dan helemaal niet van een deeltje spreken? 13. De kans een elektron in de kern van een atoom aan te treffen is heel klein. Beredeneer dit op twee manieren: a) m.b.v. figuur en b) door de golflengte van een typisch atomair elektron te vergelijken met de afmetingen van de kern. De toelichting op figuur vermeldt dat de omvang van de kern een factor 10 5 kleiner is dan de breedte van de grafiek. 13
15 Werkblad 3.: Deeltje in de Doos 5 Hieronder zie je een aantal kansplaatjes (zogenaamde orbitalen) van eigentoestanden van het deeltje in de doos. Hoe donkerder de kleur hoe kleiner de kans het deeltje aan te treffen. Omdat het hier een tweedimensionale doos betreft zou je kunnen spreken van een model voor tweedimensionale atomen. In werkelijkheid worden dit soort kunstmatige atomen ook echt gemaakt met halfgeleiders. Doe nu de volgende opdrachten en ga uit van een grondtoestandsenergie van ev 1. Bereken de lengte van het doosje.. Zet bij elke orbitaal de juiste quantumgetallen n x en n y (die aangeven om welke eigentoestand van het deeltje in de doos het gaat). 3. Zet bij elke orbitaal de juiste energie. 4. Maak een energieniveauschema voor het tweedimensionale deeltje in de doos en zet bij elk energieniveau hoeveel elektronen er maximaal in kunnen. Bereken ook de golflengte van een foton dat vrijkomt bij de overgang van het 3 e naar het 1 e energieniveau. 5. Bereken de grondtoestandsenergie voor de genoemde kunstmatige atomen met atoomnummers 1 t/m 10. Welke van deze atomen zijn edelgassen? Uitwerking 1. Uitwerking. en 3. (n x, n y ) = (n x, n y ) = (n x, n y ) = (n x, n y ) = (n x, n y ) = E = E = E = E = E = Uitwerking 4. (n x, n y ) aantal elektronen (max.) E (ev) Golflengte foton Uitwerking 5. (1,1) atoomnum. Z energie E (ev) edelgas ja/nee nee 5 Auteur: Dr. Leo van Dijk, RSG NO Veluwe, Epe. 14
16 opgave 38. (**) PMN Oefenopgaven 6 De kinetische energie van een deeltje wordt gegeven door E k =1/ mv. a) Laat zien dat dit ook geschreven kan worden als E k =p / m b) Gebruik p = h / λ om af te leiden dat E k =h / mλ Voor het deeltje in een doos met lengte L geldt dat λ n = L / n. c) Gebruik deze formule om af te leiden dat E k,n = n h /8mL. opgave 39. Een koperdraadje (***) Een gegeven koperdraadje heeft een lengte van 1,0 cm. In het draadje kunnen elektronen vrij bewegen van de ene kant van de draad naar de andere. a) Bereken de kinetische energie van een elektron in de grondtoestand, dat wil zeggen op het laagste energieniveau E 1. Stel dat je een heel kort draadje hebt, met een lengte van 1 nm. b) Bereken ook voor deze draad de kinetische energie E 1 van de grondtoestand en bereken bovendien de energie E van de eerste aangeslagen toestand. c) Een elektron in dit kleine draadje vervalt van E naar E 1, onder uitzending van een foton. Bereken de frequentie van dit foton. d) In welk deel van het spectrum zou deze straling worden uitgezonden? opgave 41. Ordes van grootte (***) De grootte van een atoom wordt bepaald door de ruimte die de elektronen innemen. De overgang tussen de grondtoestand en de eerste aangeslagen toestand van een atoom komt overeen met een belangrijke spectraallijn. Voor een aantal stoffen ligt deze spectraallijn in het nabije UV, met golflengten in de orde van grootte van 10 7 m. Dat wil zeggen dat het energieniveau van de eerste aangeslagen toestand in de buurt van 10 ev boven het niveau van de grondtoestand ligt. a) Bereken de orde van grootte van een dergelijk atoom. Op dezelfde manier beschouwen we een atoomkern als een doosje waarin protonen en neutronen opgesloten zitten. Ook voor de kerndeeltjes in een kern kan de energie alleen discrete waarden aannemen. De verschillen tussen deze energieniveaus zijn in het algemeen echter veel groter dan die van de elektronen in het atoom. De straling die ze uitzenden is γ-straling, met een foton-energie in de orde van grootte van 1 MeV. b) Bereken de orde van grootte van een kern. c) Beredeneer dat in een gebonden systeem de afstanden tussen de mogelijke energieniveaus steeds kleiner worden naarmate het systeem groter is. d) Wat verwacht je op grond hiervan voor de verschillen tussen de energieniveaus van de bindingselektronen in een molecuul? En voor de energieniveaus van een `vrij elektron' in een stuk metaal? opgave 4. Een knikkerdoosje (**) a) Als een gebonden systeem alleen in bepaalde energietoestanden kan voorkomen, waarom merken we daar in ons dagelijks leven dan zo weinig van? Beredeneer waarom dat het geval is voor een knikker in een doosje. opgave dim doosjes (1) (***) a) Schrijf de formule voor de energie op voor een doosje dat in de x-, en de y-richting een lengte L heeft, maar in de z-richting 10L. opgave dim doosjes () (***) Neem een kubusvormig doosje met ribben L. a) Laat zien dat het energieverschil tussen de grondtoestand en de eerste aangeslagen toestand wel gelijk is aan het resultaat bij het eendimensionale doosje. 6 Het aantal sterren geeft de relevantie aan van de opgave voor de eindtermen van PMN, *** is hoogste relevantie. 15
17 b) Laat zien dat er volgens het driedimensionale model energieniveaus bestaan die niet overeenkomen met toestanden in het eendimensionale model. (***) opgave 45. De buitenste elektronen van een bepaald type molecuul gedragen zich bij goede benadering als elektronen in een doosje. Het doosje is 4 nm lang en er bevinden zich 7 elektronen in. a) Bepaal de grondtoestand van het systeem, dat wil zeggen, leg uit hoe de elektronen zijn verdeeld over de energieniveaus als de totale energie minimaal is. b) Bereken de energie van deze grondtoestand. De belangrijkste spectraallijn van de stof komt overeen met het verschil tussen de grondtoestand en de eerste aangeslagen toestand. c) Bereken de golflengte van deze spectraallijn. opgave 46. (*) a) Aan welke voorwaarde moeten de energieniveaus in een stof voldoen zodat licht met een frequentie f kan worden geabsorbeerd? (**) opgave 47. a) Waarom kun je verwachten dat in grotere moleculen energieniveaus met kleinere verschillen bestaan? opgave 5. De bindingsenergie van twee doosjes (***) De kinetische energie van een elektron in de grondtoestand in een kubisch atomair doosje is 10 ev. De twee elektronen in twee afzonderlijke doosjes hebben samen dus een kinetische energie van 0 ev. Twee van deze doosjes worden tegen elkaar geplaatst, en de elektronen in dit doosjesmolecuul zijn vrij in de dubbel zo grote ruimte die hierdoor ontstaat. a) Toon met een berekening aan dat de gezamenlijke energie van de twee elektronen in de gebonden toestand 5 ev lager is dan in de afzonderlijke atomen. 16
18 Conceptuele vragen II De onderstaande vragen kunnen gebruikt worden voor discussie in kleine groepjes. De docent gaat rond en heeft een mooie gelegenheid om door luisteren erachter te komen waar de begripsknelpunten liggen. Daar kan dan ter plekke of later plenair op in worden gegaan. Bronnen: o.a. uit a) Hewitt: Conceptual Physics, 9 de editie (00), Addison-Wesley; b) Freedman/Young Physics 9th edition (1996), Addison-Wesley; c) Eisberg/Resnick Quantum Physics nd editie (1985), John Wiley; d) Osborne, Journal of Research in Science Teaching, 1983, p85-835; e) PMN materiaal. 1. Je kat wandelt door de tuin. Een uur later volgt de hond met de neus langs de grond. Leg dit uit met behulp van het deeltjesmodel. Gebonden deeltjes/golven, kwantisatie, waarschijnlijkheid. Een baan (Engels: orbit) is een duidelijk pad dat gevolgd wordt door een object. Een atomaire orbitaal is een gebiedje in de ruimte waar een elektron met een bepaalde energie gevonden kan worden. Wat zijn de overeenkomsten en verschillen tussen banen en orbitalen? 3. Teken drie golffuncties die in het doosje hiernaast passen. De horizontale as is een x-as. De verticale as geeft de amplitude van de golffunctie (voor de specialisten: neem aan dat de wanden van het doosje oneindig dik zijn). 4. De totale energie van een waterstofatoom in een watermolecuul is negatief. Wat betekent dat voor het waterstofatoom? 5. Kwantisatie is het verschijnsel dat allerlei fysische grootheden in de microwereld slechts bepaalde waarden aan kunnen nemen, bijvoorbeeld dat er discrete energieniveaus zijn. Waar kwam die kwantisatie precies vandaan in ons deeltje-in-doos model? 6. Wat is er niet-klassiek aan kwantisatie? 7. Maar waar vinden we kwantisatie in de klassieke natuurkunde? 8. Er zijn gebonden en vrije elektronen. Is de energie voor beiden gekwantiseerd of alleen voor een van de twee? Licht je antwoord toe door te denken aan de toepasbaarheid van ons deeltje-in-doos model. 9. De amplitudo van de golffunctie bepaalt de waarschijnlijkheid, en dit geeft het verband tussen de theorie en datgene wat je experimenteel kunt meten. Maar hoe zit het nu met het elektron als je niet meet? Waar is het dan? Of mag je dan helemaal niet van een deeltje spreken? Figuur Figuur 4 laat twee doosjes en twee golven zien. a) Gebruik dit model om uit te leggen dat het delen van elektronen tussen twee atomen kan leiden tot een lagere energie. b) Wat is bindingsenergie? 1. In figuur 5 staat links de golffunctie van deeltje L en rechts de golffunctie van deeltje R. De massa van beide deeltjes is gelijk. Welke uitspraak is juist? 17
19 Figuur 5 x (nm) A. Deeltje L heeft een hogere energie dan deeltje R. B. Deeltje R bevindt zich in de grondtoestand. C. Deeltje L bevindt zich in de grondtoestand. D. Deeltje L heeft een lagere energie dan deeltje R. 13. De reden voor mijn antwoord in vraag 1 is: A. Deeltje L zit in het kleinste doosje. B. De golffunctie van deeltje L heeft een hoger kwantum getal dan die van deeltje R (n L >n R ). C. De golffunctie van deeltje R heeft de grootste amplitudo. D. De golffunctie van deeltje L snijdt de x-as in het punt 0 E. A èn B F. B èn C PMN Examen de tijdvak 005 Quantumdots Met nanotechnologie kunnen quantumdots worden gemaakt. Een quantumdot is een klein systeem waarin zich twee soorten elektronen bevinden: elektronen die gebonden zijn aan atomen van het materiaal in de quantumdot een beperkt aantal zogenaamde geleidingselektronen, die vrij door de quantumdot kunnen bewegen. Op deze elektronen is het deeltje-in-een-doosmodel van toepassing. De eigenschappen van een quantumdot hangen vooral af van zijn vorm en grootte en van het aantal geleidingselektronen. De figuur links toont een bovenaanzicht van een paddestoelachtige structuur die een quantumdot bevat. De eigenlijke quantumdot is een dun laagje in de steel van de paddestoel, zie figuur rechts. Er zijn drie elektroden op aangesloten: een negatieve pool, een positieve pool en een stuurelektrode. De potentiaal van de stuurelektrode bepaalt het aantal geleidingselektronen. 18
20 In de quantumdot in de figuur hiernaast is 1 geleidingselektron aangebracht. De quantumgetallen n x, n y en n z geven voor de x-,y- en z-richting het aantal maxima in de golffunctie van dit elektron. De grondtoestand van het elektron wordt gegeven door ( n x, n y, n z ) = ( 1, 1, 1 ) Quantumdots kunnen worden toegepast als nano -lichtbronnen van iedere gewenste kleur. 1 Bereken de minimale frequentie van een foton dat door de quantumdot in figuur 3 wordt uitgezonden. Leg uit op welke twee manieren deze vijf elektronen verdeeld kunnen zijn over de beschikbare toestanden. Gebruik voor het antwoord de tabel op de uitwerkbijlage. Volgens de klassieke fysica kan een deeltje in een doos op elke locatie (x,y,z) in de doos worden aangetroffen. Volgens de quantum fysica kan dat niet en heb je alleen bij de maxima van de golffunctie een grote kans het deeltje aan te treffen. Nu wordt er gezegd dat bij hoge quantum getallen (n x, n y, n z ) de quantum oplossing en de klassieke oplossing bijna gelijk zijn. 3. (Was niet onderdeel van de oorspronkelijke examenvraag) Schets de golffunctie voor een deeltje in een 1-dimensionaal doosje voor een hoog quantum getal (neem n = 10) en leg uit waarom voor nog een veel groter quantum getal de klassieke en de quantum fysica hetzelfde voorspellen. Het aantal geleidingselektronen in de quantumdot wordt verhoogd tot 5. De verdeling van de elektronen over de energietoestanden is zodanig dat de totale energie minimaal is. De quantumdot gedraagt zich ook als een nano -condensator met een capaciteit C van F. Men verwacht dat zulke condensatoren in toekomstige computerchips een rol als schakelaar kunnen spelen. e Voor de benodigde schakelenergie geldt Es =, waarin e de ladingseenheid is. Zo n schakelaar werkt C echter alleen betrouwbaar als de thermische energie veel kleiner is dan de schakelenergie. Voor de thermische energie geldt Et = kt, waarin k de constante van Boltzmann is (zie BINAS tabel 7) en T de absolute temperatuur. 4 Bereken de maximale temperatuur die een quantumdot mag hebben als de thermische energie niet meer dan 1% van de schakelenergie mag bedragen. Correctievoorschrift: De Quantum dot Antwoorden Deelscores Maximumscore 5 1 uitkomst: f =, Hz voorbeeld van een berekening: De laagste frequentie hoort bij de overgang (,1,1) (1,1,1) of equivalent (wegens de x,y-symmetrie) bij (1,,1) (1,1,1). Invullen in de formule voor de energie in een rechthoekige doos geeft: 19
21 h h E = = 8 m (10 ) (10 ) (10 ) 8 (10 ) (10 ) (10 ) E 1 f = =, 7.10 Hz h 1 ( ) ( 1,80.10 J e m e h n n x y n z gebruik van E = ( + + ) 8me Lx Ly Lz 1 opzoeken van de getalswaarden van h en m e 1 inzicht dat (,1,1) (1,1,1) de juiste overgang is 1 berekenen van E 1 completeren van de berekening 1 h 4 1 Opmerking: Gebruik van E = m e (10 ) (10 ) zonder expliciete vermelding van n x en n y : goedrekenen. Maximumscore 3 antwoord: toestand ( n x, n y, n z ) mogelijkheid 1 mogelijkheid aantal elektronen toestand ( n x, n y, n z ) aantal elektronen (1,1,1) (1,1,1) (,1,1) 1 (,1,1) (1,,1) (1,,1) 1 Uitleg: De elektronen hebben minimale energie maar kunnen er maar in (1,1,1) zitten, in verband met het Pauli-verbod. Er moeten dus drie elektronen worden verdeeld over (,1,1) en (1,,1). Omdat deze toestanden dezelfde energie hebben zijn beide bovenstaande configuraties mogelijk. Completeren van regel (1,1,1) met elektronen bij beide mogelijkheden 1 Bij beide mogelijkheden gekozen voor (,1,1) en (1,,1) 1 Completeren van het model 1 3. (Geen score, was niet onderdeel van de oorspronkelijke examenvraag) De schets is een sinusfunctie met 5 bergen en 5 dalen. Bij grotere quantumgetallen wordt de dichtheid van bergen en dalen zo groot dat de kans het deeltje aan te treffen overal even groot is zoals men klassiek zou verwachten. Maximumscore 4 4 uitkomst: T = 10 1 K voorbeeld van een berekening: 19 e (1,60.10 ) E = = = C 18 1,0.10 0,6.10 J 0
22 geëist wordt: kt 0,01 E dus T 0 0,01,6 10 = 3 1, K berekenen van E 1 gebruik van kt 0,01 ES 1 invullen van de getalswaarden 1 completeren van de berekening 1 Geleiding tussen nanodraden, hoe kijk je daar met een deeltje-in-doos model naar? Nanowetenschap is een gebied dat zich snel ontwikkelt en waar verrassende verschijnselen ontdekt worden. Lees bijvoorbeeld de volgende fragmenten uit het artikel Elektronen op de rails dat is overgenomen van kennisnet: artikel Ongeveer anderhalf jaar geleden ontdekten de onderzoeksgroepen van hoogleraren Harold Zandvliet en Bene Poelsema van het MESA+ Instituut bij toeval dat nanodraden spontaan ontstaan als je een laag platina-atomen op een germaniumoppervlak verwarmt tot boven de 75 graden Celsius, en daarna weer afkoelt tot kamertemperatuur*). Na de temperatuurbehandeling bleken de platina-atomen zich spontaan te ordenen in perfecte nanodraden met een doorsnede van één atoom, lengtes tot wel duizend atomen, en een onderlinge afstand van 1,6 nanometer (zie figuur 1). De nanodraden die op deze manier ontstaan zijn nagenoeg vrij van fouten en verontreinigingen, en hebben geen knikken. [...] "Normaal gesproken zou je verwachten dat het elektronentransport in de metallische gebieden plaatsvindt door de metallische nanodraden", zegt hoogleraar Zandvliet. Maar de nieuwe metingen met behulp van een hoge-resolutie scanning tunneling microscoop laten zien dat de elektronen zich tussen twee naast elkaar gelegen nanodraden bewegen (zie figuur ). "Een totaal contra-intuïtief resultaat", aldus Zandvliet. [...] Ook ontdekten de onderzoekers dat de elektronen zich gedragen als een bekend theoretisch schoolvoorbeeld uit de quantummechanica, namelijk een quantummechanisch deeltje in een eendimensionale put. De nanodraden fungeren als een soort barrières voor de vrije elektronen. Ze zorgen ervoor dat de elektronen niet over het hele oppervlak kunnen bewegen (zoals in een tweedimensionale quantumtoestand), maar dwingen ze te bewegen langs een lijn (de eendimensionale quantumtoestand). De elektronen in deze quantumtoestand hebben specifieke energieniveaus, die bepaald worden door de afstand tussen de draden. De gemeten energieniveaus blijken perfect overeen te komen met het eenvoudige theoretische model van een quantummechanisch deeltje in een put. Bron: FOM 1
Deeltjes (of golven?) in dozen (1)
 Dick Hoekzema, Ed van den Berg 1 Leo van Dijk 2 Gert Schooten 3 1 Project Moderne Natuurkunde, Centrum voor Bètadidactiek, Universiteit Utrecht 2 RSG NO Veluwe, Epe 3 Agnieten College locatie Carolus Clusius,
Dick Hoekzema, Ed van den Berg 1 Leo van Dijk 2 Gert Schooten 3 1 Project Moderne Natuurkunde, Centrum voor Bètadidactiek, Universiteit Utrecht 2 RSG NO Veluwe, Epe 3 Agnieten College locatie Carolus Clusius,
Correctievoorschrift Schoolexamen Moderne Natuurkunde
 Correctievoorschrift Schoolexamen Moderne Natuurkunde Natuurkunde 1, VWO 6 9 maart 004 Tijdsduur: 90 minuten Regels voor de beoordeling: In zijn algemeenheid geldt dat het werk wordt nagekeken volgens
Correctievoorschrift Schoolexamen Moderne Natuurkunde Natuurkunde 1, VWO 6 9 maart 004 Tijdsduur: 90 minuten Regels voor de beoordeling: In zijn algemeenheid geldt dat het werk wordt nagekeken volgens
7. Hoofdstuk 7 : De Elektronenstructuur van Atomen
 7. Hoofdstuk 7 : De Elektronenstructuur van Atomen 7.1. Licht: van golf naar deeltje Frequentie (n) is het aantal golven dat per seconde passeert door een bepaald punt (Hz = 1 cyclus/s). Snelheid: v =
7. Hoofdstuk 7 : De Elektronenstructuur van Atomen 7.1. Licht: van golf naar deeltje Frequentie (n) is het aantal golven dat per seconde passeert door een bepaald punt (Hz = 1 cyclus/s). Snelheid: v =
In de figuur hieronder zie je een Elektromagnetische golf: een golf die bestaat uit elektrische en magnetische trillingen.(zie figuur).
 2.1 Wat is licht? In de figuur hieronder zie je een Elektromagnetische golf: een golf die bestaat uit elektrische en magnetische trillingen.(zie figuur). Licht is een elektromagnetische golf. Andere voorbeelden
2.1 Wat is licht? In de figuur hieronder zie je een Elektromagnetische golf: een golf die bestaat uit elektrische en magnetische trillingen.(zie figuur). Licht is een elektromagnetische golf. Andere voorbeelden
De Broglie. N.G. Schultheiss
 De Broglie N.G. Schultheiss Inleiding Deze module volgt op de module Detecteren en gaat vooraf aan de module Fluorescentie. In deze module wordt de kleur van het geabsorbeerd of geëmitteerd licht gekoppeld
De Broglie N.G. Schultheiss Inleiding Deze module volgt op de module Detecteren en gaat vooraf aan de module Fluorescentie. In deze module wordt de kleur van het geabsorbeerd of geëmitteerd licht gekoppeld
Tentamen. Kwantumchemie & Fysica (4051QCHFY-1314FWN) Datum: 10 April Tijd/tijdsduur: 3 uur
 Tentamen Kwantumchemie & Fysica (4051QCHFY-1314FWN) Datum: 10 April 2014 Tijd/tijdsduur: 3 uur Docent(en) en/of tweede lezer: Dr. F.C. Grozema Prof. dr. L.D.A. Siebbeles Dit tentamen bestaat uit 5 opgaven:
Tentamen Kwantumchemie & Fysica (4051QCHFY-1314FWN) Datum: 10 April 2014 Tijd/tijdsduur: 3 uur Docent(en) en/of tweede lezer: Dr. F.C. Grozema Prof. dr. L.D.A. Siebbeles Dit tentamen bestaat uit 5 opgaven:
Exact Periode 5. Dictaat Licht
 Exact Periode 5 Dictaat Licht 1 1 Wat is licht? In de figuur hieronder zie je een elektromagnetische golf: een golf die bestaat uit elektrische en magnetische trillingen.(zie figuur). Licht is een elektromagnetische
Exact Periode 5 Dictaat Licht 1 1 Wat is licht? In de figuur hieronder zie je een elektromagnetische golf: een golf die bestaat uit elektrische en magnetische trillingen.(zie figuur). Licht is een elektromagnetische
Exact Periode 5 Niveau 3. Dictaat Licht
 Exact Periode 5 Niveau 3 Dictaat Licht 1 1 Wat is licht? In de figuur hieronder zie je een elektromagnetische golf: een golf die bestaat uit elektrische en magnetische trillingen.(zie figuur). Licht is
Exact Periode 5 Niveau 3 Dictaat Licht 1 1 Wat is licht? In de figuur hieronder zie je een elektromagnetische golf: een golf die bestaat uit elektrische en magnetische trillingen.(zie figuur). Licht is
Tentamen Inleiding Quantumchemie (MST1171)
 Datum: 3 April 7 Tentamen Inleiding Quantumchemie (MST1171) *** Schrijf duidelijk je naam, je Leidse studienummer en studierichting op je antwoordblad *** *** Het tentamen bestaat uit vijf opgaven. Maak
Datum: 3 April 7 Tentamen Inleiding Quantumchemie (MST1171) *** Schrijf duidelijk je naam, je Leidse studienummer en studierichting op je antwoordblad *** *** Het tentamen bestaat uit vijf opgaven. Maak
2.1 Wat is licht? 2.2 Fotonen
 2.1 Wat is licht? In de figuur hieronder zie je een Elektromagnetische golf: een golf die bestaat uit elektrische en magnetische trillingen.(zie figuur). Licht is een elektromagnetische golf. Andere voorbeelden
2.1 Wat is licht? In de figuur hieronder zie je een Elektromagnetische golf: een golf die bestaat uit elektrische en magnetische trillingen.(zie figuur). Licht is een elektromagnetische golf. Andere voorbeelden
Werkblad 2.2: Doppelspalt Simulatie voor Fysische Optica en voor Quantum Verschijnselen 1
 Werkblad 2.2: Doppelspalt Simulatie voor Fysische Optica en voor Quantum Verschijnselen 1 Vandaag doe je: I. De simulatie van quantum golven/deeltjes op http://phet.colorado.edu (geen gedetailleerde instructies,
Werkblad 2.2: Doppelspalt Simulatie voor Fysische Optica en voor Quantum Verschijnselen 1 Vandaag doe je: I. De simulatie van quantum golven/deeltjes op http://phet.colorado.edu (geen gedetailleerde instructies,
QUANTUM- & ATOOMFYSICA VWO
 QUANTUM- & ATOOMFYSICA VWO Foton is een opgavenverzameling voor het nieuwe eindexamenprogramma natuurkunde. Foton is gratis te downloaden via natuurkundeuitgelegd.nl/foton Uitwerkingen van alle opgaven
QUANTUM- & ATOOMFYSICA VWO Foton is een opgavenverzameling voor het nieuwe eindexamenprogramma natuurkunde. Foton is gratis te downloaden via natuurkundeuitgelegd.nl/foton Uitwerkingen van alle opgaven
EXAMEN HOGER ALGEMEEN VOORTGEZET ONDERWIJS IN 1975
 2 H-11 EXAMEN HOGER ALGEMEEN VOORTGEZET ONDERWJS N 1975 Woensdag 27 augustus, 14.00-17.00 uur NATUURKUNDE Zie ommezijde Deze opgaven zijn vastgesteld door de commissie bedoeld in artikel 24 van het Besluit
2 H-11 EXAMEN HOGER ALGEMEEN VOORTGEZET ONDERWJS N 1975 Woensdag 27 augustus, 14.00-17.00 uur NATUURKUNDE Zie ommezijde Deze opgaven zijn vastgesteld door de commissie bedoeld in artikel 24 van het Besluit
De golfvergelijking van Schrödinger
 De golfvergelijking van Schrödinger De golfvergelijking van Schrödinger beschrijft het gedrag van het elektron in het atoom. De oplossing van die vergelijking? i bevat informatie over de energie in de
De golfvergelijking van Schrödinger De golfvergelijking van Schrödinger beschrijft het gedrag van het elektron in het atoom. De oplossing van die vergelijking? i bevat informatie over de energie in de
Statistiek voor Natuurkunde Opgavenserie 4: Lineaire regressie
 Statistiek voor Natuurkunde Opgavenserie 4: Lineaire regressie Inleveren: Uiterlijk 15 februari voor 16.00 in mijn postvakje Afspraken Overleg is toegestaan, maar iedereen levert zijn eigen werk in. Overschrijven
Statistiek voor Natuurkunde Opgavenserie 4: Lineaire regressie Inleveren: Uiterlijk 15 februari voor 16.00 in mijn postvakje Afspraken Overleg is toegestaan, maar iedereen levert zijn eigen werk in. Overschrijven
Exact Periode 5.2. Licht
 Exact Periode 5.2 Licht 1 1 Wat is licht? In de figuur hieronder zie je een elektromagnetische golf: een golf die bestaat uit elektrische en magnetische trillingen.(zie figuur). Licht is een elektromagnetische
Exact Periode 5.2 Licht 1 1 Wat is licht? In de figuur hieronder zie je een elektromagnetische golf: een golf die bestaat uit elektrische en magnetische trillingen.(zie figuur). Licht is een elektromagnetische
Samenvatting PMN. Golf en deeltje.
 Samenvatting PMN Golf en deeltje. Het foto-elektrisch effect: Licht als energiepakketjes (deeltjes) Foton (ã) impuls: en energie Deeltje (m) impuls en energie en golflengte Zowel materie als golven (fotonen)
Samenvatting PMN Golf en deeltje. Het foto-elektrisch effect: Licht als energiepakketjes (deeltjes) Foton (ã) impuls: en energie Deeltje (m) impuls en energie en golflengte Zowel materie als golven (fotonen)
Tentamen Quantum Mechanica 2
 Tentamen Quantum Mechanica 9 juni 5 Het tentamen bestaat uit 4 opgaven, waarmee in totaal 9 punten zijn te verdienen. Schrijf op elk vel dat je inlevert je naam, voorletters en studentnummer.. (a) (5 punten)
Tentamen Quantum Mechanica 9 juni 5 Het tentamen bestaat uit 4 opgaven, waarmee in totaal 9 punten zijn te verdienen. Schrijf op elk vel dat je inlevert je naam, voorletters en studentnummer.. (a) (5 punten)
NATUURKUNDE PROEFWERK
 ATUURKUNDE 1 KLAS 5 10/05/06 NATUURKUNDE PROEFWERK N1V2 2.6-2.8 EN EN HOOFDSTUK 3 Proefwerk bestaat uit 2 opgaven. Geef duidelijke uitleg en berekeningen. Totaal: 33 punten. Opgave 1: een tl-buis Een tl-buis
ATUURKUNDE 1 KLAS 5 10/05/06 NATUURKUNDE PROEFWERK N1V2 2.6-2.8 EN EN HOOFDSTUK 3 Proefwerk bestaat uit 2 opgaven. Geef duidelijke uitleg en berekeningen. Totaal: 33 punten. Opgave 1: een tl-buis Een tl-buis
Fluorescentie. dr. Th. W. Kool, N.G. Schultheiss
 1 Fluorescentie dr. Th. W. Kool, N.G. Schultheiss 1 Inleiding Deze module volgt op de module de Broglie. Het detecteren van kosmische straling in onze ski-boxen geschiedt met behulp van het organische
1 Fluorescentie dr. Th. W. Kool, N.G. Schultheiss 1 Inleiding Deze module volgt op de module de Broglie. Het detecteren van kosmische straling in onze ski-boxen geschiedt met behulp van het organische
Hierin is λ de golflengte in m, v de golfsnelheid in m/s en T de trillingstijd in s.
 Inhoud... 2 Opgave: Golf in koord... 3 Interferentie... 4 Antigeluid... 5 Staande golven... 5 Snaarinstrumenten... 6 Blaasinstrumenten... 7 Opgaven... 8 Opgave: Gitaar... 8 Opgave: Kerkorgel... 9 1/10
Inhoud... 2 Opgave: Golf in koord... 3 Interferentie... 4 Antigeluid... 5 Staande golven... 5 Snaarinstrumenten... 6 Blaasinstrumenten... 7 Opgaven... 8 Opgave: Gitaar... 8 Opgave: Kerkorgel... 9 1/10
Voorbereidend Wetenschappelijk Onderwijs Tijdvak 1 Vrijdag 27 mei totale examentijd 3 uur
 natuurkunde 1,2 Examen VWO - Compex Voorbereidend Wetenschappelijk Onderwijs Tijdvak 1 Vrijdag 27 mei totale examentijd 3 uur 20 05 Vragen 1 tot en met 17. In dit deel staan de vragen waarbij de computer
natuurkunde 1,2 Examen VWO - Compex Voorbereidend Wetenschappelijk Onderwijs Tijdvak 1 Vrijdag 27 mei totale examentijd 3 uur 20 05 Vragen 1 tot en met 17. In dit deel staan de vragen waarbij de computer
4) De verhouding bereken van de straal en de ringen van Saturnus en dus is het veel kleiner dan een DVD => 1punt analoog antwoordmodel.
 Notulen examenbespreking Nina examen vwo 2012 VWO Natuurkunde pilot 2012 I 22 mei 2012 Steekproef nagekeken examens: Sted Gym Nijmegen: 13 lln 45 punten 3 onv Coornhert Gym Gouda: 11 lln 50 punten 0 onv
Notulen examenbespreking Nina examen vwo 2012 VWO Natuurkunde pilot 2012 I 22 mei 2012 Steekproef nagekeken examens: Sted Gym Nijmegen: 13 lln 45 punten 3 onv Coornhert Gym Gouda: 11 lln 50 punten 0 onv
1 Een lichtbron zendt licht uit met een golflengte van 589 nm in vacuüm.
 Domein F: Moderne fysica Subdomein: Atoomfysica 1 Een lichtbron zendt licht uit met een golflengte van 589 nm in vacuüm. Bereken de energie van het foton in ev. E = h c/λ (1) E = (6,63 10-34 3 10 8 )/(589
Domein F: Moderne fysica Subdomein: Atoomfysica 1 Een lichtbron zendt licht uit met een golflengte van 589 nm in vacuüm. Bereken de energie van het foton in ev. E = h c/λ (1) E = (6,63 10-34 3 10 8 )/(589
Opgave 1 Golven op de bouwplaats ( 20 punten, ) Een staalkabel met lengte L hangt verticaal aan een torenkraan.
 TECHNISCHE UNIVERSITEIT DELFT Faculteit Elektrotechniek, Wiskunde en Informatica Opleiding Elektrotechniek EE1200-B - Klassieke en Kwantummechanica - deel B Hertentamen 13 maart 2014 14:00-17:00 Aanwijzingen:
TECHNISCHE UNIVERSITEIT DELFT Faculteit Elektrotechniek, Wiskunde en Informatica Opleiding Elektrotechniek EE1200-B - Klassieke en Kwantummechanica - deel B Hertentamen 13 maart 2014 14:00-17:00 Aanwijzingen:
Beste leerling, Om een zo duidelijk mogelijk verslag te maken, hebben we de examenvragen onderverdeeld in 4 categorieën.
 Beste leerling, Dit document bevat het examenverslag van het vak Natuurkunde vwo, eerste tijdvak (2016). In dit examenverslag proberen we zo goed mogelijk antwoord te geven op de volgende vraag: In hoeverre
Beste leerling, Dit document bevat het examenverslag van het vak Natuurkunde vwo, eerste tijdvak (2016). In dit examenverslag proberen we zo goed mogelijk antwoord te geven op de volgende vraag: In hoeverre
TECHNISCHE UNIVERSITEIT EINDHOVEN Faculteit Technische Natuurkunde
 TECHNISCHE UNIVERSITEIT EINDHOVEN Faculteit Technische Natuurkunde Uitwerking Tentamen Quantumfysica van 15 april 010. 1. (a) De ket α is een vector in de Hilbertruimte H, en de bra β een co-variante vector
TECHNISCHE UNIVERSITEIT EINDHOVEN Faculteit Technische Natuurkunde Uitwerking Tentamen Quantumfysica van 15 april 010. 1. (a) De ket α is een vector in de Hilbertruimte H, en de bra β een co-variante vector
Schoolexamen Moderne Natuurkunde
 Schoolexamen Moderne Natuurkunde herkansing Natuurkunde 1,2 VWO 6 18 april 2005 Tijdsduur: 90 minuten Deze toets bestaat uit twee delen (I en II). In deel I wordt basiskennis getoetst via meerkeuzevragen
Schoolexamen Moderne Natuurkunde herkansing Natuurkunde 1,2 VWO 6 18 april 2005 Tijdsduur: 90 minuten Deze toets bestaat uit twee delen (I en II). In deel I wordt basiskennis getoetst via meerkeuzevragen
De wonderen van de quantumwereld
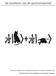 De wonderen van de quantumwereld If quantum mechanics hasn't profoundly shocked you, you haven't understood it yet. - Niels Bohr (één van de grondleggers van de quantum mechanica) Inhoud 1 Inleiding...
De wonderen van de quantumwereld If quantum mechanics hasn't profoundly shocked you, you haven't understood it yet. - Niels Bohr (één van de grondleggers van de quantum mechanica) Inhoud 1 Inleiding...
natuurkunde 1,2 (Project Moderne Natuurkunde)
 Examen VWO 009 tijdvak 1 woensdag 0 mei 13.30-16.30 uur natuurkunde 1, (Project Moderne Natuurkunde) Bij dit examen hoort een bijlage en een uitwerkbijlage. Dit examen bestaat uit 4 vragen. Voor dit examen
Examen VWO 009 tijdvak 1 woensdag 0 mei 13.30-16.30 uur natuurkunde 1, (Project Moderne Natuurkunde) Bij dit examen hoort een bijlage en een uitwerkbijlage. Dit examen bestaat uit 4 vragen. Voor dit examen
2. (regulier vraag 3) 10-6 vergeten bij opzoeken ρ: eerste bolletje weg. bij werken met de dichtheid kan de berekening nog wel worden gecompleteerd.
 Verslag examenbespreking pilot-examen VWO 2014 (eerste tijdvak) Utrecht, 19 mei 2015 Eerste resultaten: Totaal 62 kandidaten. Gemiddeld 40,3 punten. 5 lln 32+37+28+39+26 punten. (32,4 gemiddeld). 16 lln
Verslag examenbespreking pilot-examen VWO 2014 (eerste tijdvak) Utrecht, 19 mei 2015 Eerste resultaten: Totaal 62 kandidaten. Gemiddeld 40,3 punten. 5 lln 32+37+28+39+26 punten. (32,4 gemiddeld). 16 lln
ANTWOORDEN EN UITWERKINGEN TENTAMEN QUANTUMMECHANICA 2 VAN 8 JUNI e +" 1 = 1. e (" )=(k BT )
 ANTWOORDEN EN UITWERKINGEN TENTAMEN QUANTUMMECHANICA VAN 8 JUNI ) (Andere antwoorden zijn niet noodzakelijk (geheel) incorrect) (a) Volgens het Pauli-principe kunnen fermionen zich niet in dezelfde quantumtoestand
ANTWOORDEN EN UITWERKINGEN TENTAMEN QUANTUMMECHANICA VAN 8 JUNI ) (Andere antwoorden zijn niet noodzakelijk (geheel) incorrect) (a) Volgens het Pauli-principe kunnen fermionen zich niet in dezelfde quantumtoestand
QUANTUMFYSICA FOTOSYNTHESE. Naam: Klas: Datum:
 FOTOSYNTHESE QUANTUMFYSICA FOTOSYNTHESE Naam: Klas: Datum: FOTOSYNTHESE FOTOSYNTHESE ANTENNECOMPLEXEN Ook in sommige biologische processen speelt quantummechanica een belangrijke rol. Een van die processen
FOTOSYNTHESE QUANTUMFYSICA FOTOSYNTHESE Naam: Klas: Datum: FOTOSYNTHESE FOTOSYNTHESE ANTENNECOMPLEXEN Ook in sommige biologische processen speelt quantummechanica een belangrijke rol. Een van die processen
TECHNISCHE UNIVERSITEIT EINDHOVEN. Tentamen Stralingsfysica (3D100) d.d. 21 januari 2005 van 14:00 17:00 uur
 TECHNISCHE UNIVERSITEIT EINDHOVEN Tentamen Stralingsfysica (3D) d.d. januari 5 van 4: 7: uur Vul de presentiekaart in blokletters in en onderteken deze. Gebruik van boek, aantekeningen of notebook is niet
TECHNISCHE UNIVERSITEIT EINDHOVEN Tentamen Stralingsfysica (3D) d.d. januari 5 van 4: 7: uur Vul de presentiekaart in blokletters in en onderteken deze. Gebruik van boek, aantekeningen of notebook is niet
NATUURKUNDE 8 29/04/2011 KLAS 5 INHAALPROEFWERK HOOFDSTUK
 NATUURKUNDE KLAS 5 INHAALPROEFWERK HOOFDSTUK 8 29/04/2011 Deze toets bestaat uit 3 opgaven (32 punten). Gebruik eigen grafische rekenmachine en BINAS toegestaan. Veel succes! Opgave 1: Afbuigen van geladen
NATUURKUNDE KLAS 5 INHAALPROEFWERK HOOFDSTUK 8 29/04/2011 Deze toets bestaat uit 3 opgaven (32 punten). Gebruik eigen grafische rekenmachine en BINAS toegestaan. Veel succes! Opgave 1: Afbuigen van geladen
Eindexamen natuurkunde 1-2 vwo I
 Eindexamen natuurkunde - vwo 009 - I Beoordelingsmodel Opgave Mondharmonica maximumscore 3 In figuur 3 zijn minder trillingen te zien dan in figuur De frequentie in figuur 3 is dus lager Het lipje bij
Eindexamen natuurkunde - vwo 009 - I Beoordelingsmodel Opgave Mondharmonica maximumscore 3 In figuur 3 zijn minder trillingen te zien dan in figuur De frequentie in figuur 3 is dus lager Het lipje bij
TECHNISCHE UNIVERSITEIT EINDHOVEN. Tentamen Stralingsfysica (3D100) d.d. 16 januari 2006 van 14:00 17:00 uur
 TECHNISCHE UNIVERSITEIT EINDHOVEN Tentamen Stralingsfysica (3D d.d. 6 januari 6 van 4: 7: uur Vul de presentiekaart in blokletters in en onderteken deze. Gebruik van boek, aantekeningen of notebook is
TECHNISCHE UNIVERSITEIT EINDHOVEN Tentamen Stralingsfysica (3D d.d. 6 januari 6 van 4: 7: uur Vul de presentiekaart in blokletters in en onderteken deze. Gebruik van boek, aantekeningen of notebook is
Tentamen TCl l8 januari 2008' 9-12uur, zaal Cl (Gorlaeus).
 I Tentamen TCl l8 januari 2008' 9-12uur, zaal Cl (Gorlaeus). 1. Basisinzichten Geef van de onderstaande beweringen aan of zewaar of niet waar zijn (er hoeven geen argumenten gegeven te worden; het mag
I Tentamen TCl l8 januari 2008' 9-12uur, zaal Cl (Gorlaeus). 1. Basisinzichten Geef van de onderstaande beweringen aan of zewaar of niet waar zijn (er hoeven geen argumenten gegeven te worden; het mag
PMN Planner: Een voorbeeld gebaseerd op 2 contacturen per week
 PMN Planner: Een voorbeeld gebaseerd op 2 contacturen per week 2003 2004 De volgende planner is afkomstig van Lieke Heimel (met dank!) en gebruikt in 2002-2003. We hebben de school specifieke informatie
PMN Planner: Een voorbeeld gebaseerd op 2 contacturen per week 2003 2004 De volgende planner is afkomstig van Lieke Heimel (met dank!) en gebruikt in 2002-2003. We hebben de school specifieke informatie
1 Welk van onderstaande schakelingen is geschikt om de remspanning te meten?
 Domein F: Moderne Fysica Subdomein: Atoomfysica 1 Welk van onderstaande schakelingen is geschikt om de remspanning te meten? 2 Bekijk de volgende beweringen. 1 In een fotocel worden elektronen geëmitteerd
Domein F: Moderne Fysica Subdomein: Atoomfysica 1 Welk van onderstaande schakelingen is geschikt om de remspanning te meten? 2 Bekijk de volgende beweringen. 1 In een fotocel worden elektronen geëmitteerd
Zon en Sterren. Elektromagnetische straling en materie voor 5 VWO. Paul Feldbrugge Kirsten Stadermann
 Zon en Sterren Elektromagnetische straling en materie voor 5 VWO Paul Feldbrugge Kirsten Stadermann Context Concept Voor hele goede leerlingen t/m minder goede leerlingen Moeilijk onderwerp: ligt ver uit
Zon en Sterren Elektromagnetische straling en materie voor 5 VWO Paul Feldbrugge Kirsten Stadermann Context Concept Voor hele goede leerlingen t/m minder goede leerlingen Moeilijk onderwerp: ligt ver uit
Geleid herontdekken van de golffunctie
 Geleid herontdekken van de golffunctie Nascholingscursus Quantumwereld Lodewijk Koopman lkoopman@dds.nl januari-maart 2013 1 Dubbel-spleet experiment Er wordt wel eens gezegd dat elektronen interfereren.
Geleid herontdekken van de golffunctie Nascholingscursus Quantumwereld Lodewijk Koopman lkoopman@dds.nl januari-maart 2013 1 Dubbel-spleet experiment Er wordt wel eens gezegd dat elektronen interfereren.
Quantumvloeistoffen voor electronen en koude atomen
 Quantumvloeistoffen voor electronen en koude atomen Kareljan Schoutens Instituut voor Theoretische Fysica Universiteit van Amsterdam VIVA FYSICA ---- 23 januari 2004 quantumvloeistoffen voor electronen
Quantumvloeistoffen voor electronen en koude atomen Kareljan Schoutens Instituut voor Theoretische Fysica Universiteit van Amsterdam VIVA FYSICA ---- 23 januari 2004 quantumvloeistoffen voor electronen
TENTAMEN. Van Quantum tot Materie
 TENTMEN Van Quantum tot Materie Prof. Dr. C. Gooijer en Prof. Dr. R. Griessen Vrijdag 22 december 2006 12.00-14.45 Q105/ M143/ C121 Dit schriftelijk tentamen bestaat uit 5 opdrachten. Naast de titel van
TENTMEN Van Quantum tot Materie Prof. Dr. C. Gooijer en Prof. Dr. R. Griessen Vrijdag 22 december 2006 12.00-14.45 Q105/ M143/ C121 Dit schriftelijk tentamen bestaat uit 5 opdrachten. Naast de titel van
1. Langere vraag over de theorie
 1. Langere vraag over de theorie a) Bereken, vertrekkend van de definitie van capaciteit, de capaciteit van een condensator die bestaat uit twee evenwijdige vlakke platen waarbij de afstand tussen de platen
1. Langere vraag over de theorie a) Bereken, vertrekkend van de definitie van capaciteit, de capaciteit van een condensator die bestaat uit twee evenwijdige vlakke platen waarbij de afstand tussen de platen
TECHNISCHE UNIVERSITEIT EINDHOVEN. Tentamen Stralingsfysica (3D100) d.d. 16 november 2004 van 14:00 17:00 uur
 TECHNISCHE UNIVERSITEIT EINDHOVEN Tentamen Stralingsfysica (3D) d.d. 6 november 4 van 4: 7: uur Vul de presentiekaart in blokletters in en onderteken deze. Gebruik van boek, aantekeningen of notebook is
TECHNISCHE UNIVERSITEIT EINDHOVEN Tentamen Stralingsfysica (3D) d.d. 6 november 4 van 4: 7: uur Vul de presentiekaart in blokletters in en onderteken deze. Gebruik van boek, aantekeningen of notebook is
Opgave 1 Vervormd vierkant kristal en elektronische structuur (totaal 24 punten)
 3NC2 Gecondenseerde materie 215 Extra tentamen, 1 april 215 Algemeen: Beargumenteer je antwoorden. Vermeld zowel de gebruikte basisformules als de tussenstappen in de afleiding. Mogelijk te gebruiken formules:
3NC2 Gecondenseerde materie 215 Extra tentamen, 1 april 215 Algemeen: Beargumenteer je antwoorden. Vermeld zowel de gebruikte basisformules als de tussenstappen in de afleiding. Mogelijk te gebruiken formules:
(Permitiviteit van vacuüm)
 TECHNISCHE UNIVERSITEIT EINDHOVEN Tentamen Stralingsfysica (3D1) d.d. 5 juni 1 van 9: 1: uur Vul de presentiekaart in blokletters in en onderteken deze. Gebruik van boek, aantekeningen of notebook is niet
TECHNISCHE UNIVERSITEIT EINDHOVEN Tentamen Stralingsfysica (3D1) d.d. 5 juni 1 van 9: 1: uur Vul de presentiekaart in blokletters in en onderteken deze. Gebruik van boek, aantekeningen of notebook is niet
Eindexamen moderne natuurkunde 1-2 vwo 2009 - I
 Opgave 1 Mondharmonica Van een mondharmonica is de beschermkap weggehaald. Zie figuur 1. figuur 1 Deze mondharmonica heeft tien gaatjes. Onder elk gaatje zit een metalen lipje. Als een speler lucht door
Opgave 1 Mondharmonica Van een mondharmonica is de beschermkap weggehaald. Zie figuur 1. figuur 1 Deze mondharmonica heeft tien gaatjes. Onder elk gaatje zit een metalen lipje. Als een speler lucht door
Begripsvragen: Elektromagnetische straling
 Handboek natuurkundedidactiek Hoofdstuk 4: Leerstofdomeinen 4.2 Domeinspecifieke leerstofopbouw 4.2.8 Astrofysica Begripsvragen: Elektromagnetische straling 1 Meerkeuzevragen Stralingskromme 1 [H/V] Het
Handboek natuurkundedidactiek Hoofdstuk 4: Leerstofdomeinen 4.2 Domeinspecifieke leerstofopbouw 4.2.8 Astrofysica Begripsvragen: Elektromagnetische straling 1 Meerkeuzevragen Stralingskromme 1 [H/V] Het
6 Het atoommodel van Bohr. banner. CC Naamsvermelding-GelijkDelen 3.0 Nederland licentie. https://maken.wikiwijs.nl/51935
 banner Auteur Laatst gewijzigd Licentie Webadres Its Academy 08 mei 2015 CC Naamsvermelding-GelijkDelen 3.0 Nederland licentie https://maken.wikiwijs.nl/51935 Dit lesmateriaal is gemaakt met Wikiwijs van
banner Auteur Laatst gewijzigd Licentie Webadres Its Academy 08 mei 2015 CC Naamsvermelding-GelijkDelen 3.0 Nederland licentie https://maken.wikiwijs.nl/51935 Dit lesmateriaal is gemaakt met Wikiwijs van
QUANTUMFYSICA DE EPR-PARADOX. Naam: Klas: Datum:
 DE EPR-PARADOX QUANTUMFYSICA DE EPR-PARADOX Naam: Klas: Datum: DE EPR-PARADOX DE EPR-PARADOX EEN GEDACHTE-EXPERIMENT Volgens de wetten van de quantummechanica kunnen bepaalde deeltjes spontaan vervallen.
DE EPR-PARADOX QUANTUMFYSICA DE EPR-PARADOX Naam: Klas: Datum: DE EPR-PARADOX DE EPR-PARADOX EEN GEDACHTE-EXPERIMENT Volgens de wetten van de quantummechanica kunnen bepaalde deeltjes spontaan vervallen.
Eindexamen vwo natuurkunde pilot 2012 - I
 Eindexamen vwo natuurkunde pilot 0 - I Opgave Lichtpracticum maximumscore De buis is aan beide kanten afgesloten om licht van buitenaf te voorkomen. maximumscore 4 De weerstanden verhouden zich als de
Eindexamen vwo natuurkunde pilot 0 - I Opgave Lichtpracticum maximumscore De buis is aan beide kanten afgesloten om licht van buitenaf te voorkomen. maximumscore 4 De weerstanden verhouden zich als de
Constante van Planck bepalen met LED s. Doel: Constante van Planck bepalen
 Constante van Planck bepalen met LED s Doel: Constante van Planck bepalen Apparatuur & materialen: Voeding Snoeren Gevoelige stroom meter (multimeter) Kastje met LED s en variabele weerstand (potmeter)
Constante van Planck bepalen met LED s Doel: Constante van Planck bepalen Apparatuur & materialen: Voeding Snoeren Gevoelige stroom meter (multimeter) Kastje met LED s en variabele weerstand (potmeter)
Eindexamen natuurkunde pilot vwo II
 Beoordelingsmodel Opgave Sopraansaxofoon maximumscore 4 uitkomst: F d = 7, N voorbeeld van een bepaling: Er geldt: Fr z z= Fr d d. Opmeten in de figuur levert: rz =,7 cm en rd= 5,4 cm. Invullen levert:,
Beoordelingsmodel Opgave Sopraansaxofoon maximumscore 4 uitkomst: F d = 7, N voorbeeld van een bepaling: Er geldt: Fr z z= Fr d d. Opmeten in de figuur levert: rz =,7 cm en rd= 5,4 cm. Invullen levert:,
Fysica 2 Practicum. Er bestaan drie types van spectra voor lichtbronnen: lijnen-, banden- en continue spectra.
 Fysica 2 Practicum Atoomspectroscopie 1. Theoretische uiteenzetting Wat hebben vuurwerk, lasers en neonverlichting gemeen? Ze zenden licht uit met mooie heldere kleuren. Dat doen ze doordat elektronen
Fysica 2 Practicum Atoomspectroscopie 1. Theoretische uiteenzetting Wat hebben vuurwerk, lasers en neonverlichting gemeen? Ze zenden licht uit met mooie heldere kleuren. Dat doen ze doordat elektronen
Voorbeeld 1: Oneindig diepe potentiaalput
 Voorbeeld : Oneindig diepe potentiaalput In de onderstaande figuren bevindt zich een deeltje in een eendimensionale ruimte tussen x 0 en x a. Binnen dat gebied is de potentiële energie van het deeltje
Voorbeeld : Oneindig diepe potentiaalput In de onderstaande figuren bevindt zich een deeltje in een eendimensionale ruimte tussen x 0 en x a. Binnen dat gebied is de potentiële energie van het deeltje
13 Zonnestelsel en heelal
 13 Zonnestelsel en heelal Astrofysica vwo Werkblad 53 PLANCKKROMMEN In deze opdracht ontdek je met een computermodel hoe de formule achter de planckkrommen eruit ziet. De theoretische planckkrommen zijn
13 Zonnestelsel en heelal Astrofysica vwo Werkblad 53 PLANCKKROMMEN In deze opdracht ontdek je met een computermodel hoe de formule achter de planckkrommen eruit ziet. De theoretische planckkrommen zijn
GEEF STERRENKUNDE DE RUIMTE! SPECTROSCOPISCH ONDERZOEK VAN STERLICHT INTRODUCTIE
 LESBRIEF GEEF STERRENKUNDE DE RUIMTE! Deze NOVAlab-oefening gaat over spectroscopisch onderzoek van sterlicht. Het is een vervolg op de lesbrief Onderzoek de Zon. De oefening is bedoeld voor de bovenbouw
LESBRIEF GEEF STERRENKUNDE DE RUIMTE! Deze NOVAlab-oefening gaat over spectroscopisch onderzoek van sterlicht. Het is een vervolg op de lesbrief Onderzoek de Zon. De oefening is bedoeld voor de bovenbouw
Biofysische Scheikunde: NMR-Spectroscopie
 Inleiding & Kernmagnetisme Vrije Universiteit Brussel 19 maart 2012 Outline 1 Overzicht en Context 2 3 Outline 1 Overzicht en Context 2 3 Doelstelling Eiwitten (en andere biologische macromoleculen) Functionele
Inleiding & Kernmagnetisme Vrije Universiteit Brussel 19 maart 2012 Outline 1 Overzicht en Context 2 3 Outline 1 Overzicht en Context 2 3 Doelstelling Eiwitten (en andere biologische macromoleculen) Functionele
NATUURKUNDE. a) Bereken voor alle drie kleuren licht de energie van een foton in ev.
 NATUURKUNDE KLAS 5, INHAALPROEFWERK H7, 02/12/10 Het proefwerk bestaat uit 2 opgaven met samen 32 punten. (NB. Je mag GEEN gebruik maken van de CALC-intersect-functie van je GRM!) Opgave 1: Kwiklamp (17
NATUURKUNDE KLAS 5, INHAALPROEFWERK H7, 02/12/10 Het proefwerk bestaat uit 2 opgaven met samen 32 punten. (NB. Je mag GEEN gebruik maken van de CALC-intersect-functie van je GRM!) Opgave 1: Kwiklamp (17
Samenvatting Scheikunde H3 Door: Immanuel Bendahan
 Samenvatting Scheikunde H3 Door: Immanuel Bendahan Inhoudsopgave 1 Atoommodel... 1 Moleculen... 1 De ontwikkeling van het atoommodel... 1 Atoommodel van Bohr... 2 Indicatoren van atomen... 3 2 Periodiek
Samenvatting Scheikunde H3 Door: Immanuel Bendahan Inhoudsopgave 1 Atoommodel... 1 Moleculen... 1 De ontwikkeling van het atoommodel... 1 Atoommodel van Bohr... 2 Indicatoren van atomen... 3 2 Periodiek
Mooie opgaven met mooie contexten. Maar je moet het wel snappen. Standaard aanpak van bekende opgaven werkt hier niet. Je moet de aanpak wel zien.
 Verslag examenbespreking pilot-examen VWO 2014 (eerste tijdvak) Utrecht, 20 mei 2014 Eerste resultaten: Totaal 36 kandidaten. Gemiddeld 39,7 punten. Algemene opmerkingen: Slechts twee leerlingen van te
Verslag examenbespreking pilot-examen VWO 2014 (eerste tijdvak) Utrecht, 20 mei 2014 Eerste resultaten: Totaal 36 kandidaten. Gemiddeld 39,7 punten. Algemene opmerkingen: Slechts twee leerlingen van te
Spectroscopie. ... de kunst van het lichtlezen... Karolien Lefever. u gebracht door. Instituut voor Sterrenkunde, K.U. Leuven
 Spectroscopie... de kunst van het lichtlezen... u gebracht door Instituut voor Sterrenkunde, K.U. Leuven Spectroscopie en kunst... Het kleurenpalet van het elektromagnetisch spectrum... Het fingerspitzengefühl
Spectroscopie... de kunst van het lichtlezen... u gebracht door Instituut voor Sterrenkunde, K.U. Leuven Spectroscopie en kunst... Het kleurenpalet van het elektromagnetisch spectrum... Het fingerspitzengefühl
Eindronde Natuurkunde Olympiade 2015 theorietoets deel 1
 Eindronde Natuurkunde Olympiade 2015 theorietoets deel 1 Opgave 1 Botsend blokje (5p) Een blok met een massa van 10 kg glijdt over een glad oppervlak. Hoek D botst tegen een klein vastzittend blokje S
Eindronde Natuurkunde Olympiade 2015 theorietoets deel 1 Opgave 1 Botsend blokje (5p) Een blok met een massa van 10 kg glijdt over een glad oppervlak. Hoek D botst tegen een klein vastzittend blokje S
Later heeft men ook nog een ongeladen deeltje met praktisch dezelfde massa als een proton ontdekt (1932). Dit deeltje heeft de naam neutron gekregen.
 Atoombouw 1.1 onderwerpen: Elektrische structuur van de materie Atoommodel van Rutherford Elementaire deeltjes Massagetal en atoomnummer Ionen Lading Twee (met een metalen laagje bedekte) balletjes,, die
Atoombouw 1.1 onderwerpen: Elektrische structuur van de materie Atoommodel van Rutherford Elementaire deeltjes Massagetal en atoomnummer Ionen Lading Twee (met een metalen laagje bedekte) balletjes,, die
Trillingen en geluid wiskundig. 1 De sinus van een hoek 2 Uitwijking van een trilling berekenen 3 Macht en logaritme 4 Geluidsniveau en amplitude
 Trillingen en geluid wiskundig 1 De sinus van een hoek 2 Uitwijking van een trilling berekenen 3 Macht en logaritme 4 Geluidsniveau en amplitude 1 De sinus van een hoek Eenheidscirkel In de figuur hiernaast
Trillingen en geluid wiskundig 1 De sinus van een hoek 2 Uitwijking van een trilling berekenen 3 Macht en logaritme 4 Geluidsniveau en amplitude 1 De sinus van een hoek Eenheidscirkel In de figuur hiernaast
Eindexamen havo natuurkunde II
 Eindexamen havo natuurkunde 0 - II Opgave Parasaurolophus maximumscore antwoord: resonantie maximumscore voorbeeld van een berekening: Voor de grondtoon bij een halfgesloten pijp geldt dat de lengte van
Eindexamen havo natuurkunde 0 - II Opgave Parasaurolophus maximumscore antwoord: resonantie maximumscore voorbeeld van een berekening: Voor de grondtoon bij een halfgesloten pijp geldt dat de lengte van
Begripsvragen: Elektrisch veld
 Handboek natuurkundedidactiek Hoofdstuk 4: Leerstofdomeinen 4.2 Domeinspecifieke leerstofopbouw 4.2.4 Elektriciteit en magnetisme Begripsvragen: Elektrisch veld 1 Meerkeuzevragen Elektrisch veld 1 [V]
Handboek natuurkundedidactiek Hoofdstuk 4: Leerstofdomeinen 4.2 Domeinspecifieke leerstofopbouw 4.2.4 Elektriciteit en magnetisme Begripsvragen: Elektrisch veld 1 Meerkeuzevragen Elektrisch veld 1 [V]
Hoofdstuk 3: Licht. Natuurkunde VWO 2011/2012. www.lyceo.nl
 Hoofdstuk 3: Licht Natuurkunde VWO 2011/2012 www.lyceo.nl Hoofdstuk 3: Licht Natuurkunde 1. Mechanica 2. Golven en straling 3. Elektriciteit en magnetisme 4. Warmteleer Rechtlijnige beweging Trilling en
Hoofdstuk 3: Licht Natuurkunde VWO 2011/2012 www.lyceo.nl Hoofdstuk 3: Licht Natuurkunde 1. Mechanica 2. Golven en straling 3. Elektriciteit en magnetisme 4. Warmteleer Rechtlijnige beweging Trilling en
Eindexamen natuurkunde 1 vwo 2001-I
 Eindexamen natuurkunde vwo 200-I 4 Antwoordmodel Opgave Hoogspanningskabel uitkomst:,4 0 3 (draden) methode ρl ρl 7 0-9 3,0 0 3 Uit R = volgt A kabel = = = 7,08 0-4 m 2. A R 7,2 0-2 Er geldt A draad =
Eindexamen natuurkunde vwo 200-I 4 Antwoordmodel Opgave Hoogspanningskabel uitkomst:,4 0 3 (draden) methode ρl ρl 7 0-9 3,0 0 3 Uit R = volgt A kabel = = = 7,08 0-4 m 2. A R 7,2 0-2 Er geldt A draad =
Quantum Chemie II 2e/3e jaar
 Quantum Chemie II e/3e jaar Universiteit Utrecht Faculteit Bèta Wetenschappen Departement Scheikunde Vakgroep Theoretische Chemie 008 Het college Quantumchemie wordt met wisselende omvang en naam, al sinds
Quantum Chemie II e/3e jaar Universiteit Utrecht Faculteit Bèta Wetenschappen Departement Scheikunde Vakgroep Theoretische Chemie 008 Het college Quantumchemie wordt met wisselende omvang en naam, al sinds
Helium atoom = kern met 2 protonen en 2 neutronen met eromheen draaiend 2 elektronen
 Cursus Chemie 1-1 Hoofdstuk 1 : De atoombouw en het Periodiek Systeem 1. SAMENSTELLING VAN HET ATOOM Een atoom bestaat uit: een positief geladen kern, opgebouwd uit protonen en neutronen en (een of meer)
Cursus Chemie 1-1 Hoofdstuk 1 : De atoombouw en het Periodiek Systeem 1. SAMENSTELLING VAN HET ATOOM Een atoom bestaat uit: een positief geladen kern, opgebouwd uit protonen en neutronen en (een of meer)
Examen VWO. natuurkunde 1,2 Compex. Vragen 1 tot en met 14. In dit deel van het examen staan de vragen waarbij de computer niet wordt gebruikt.
 Examen VWO 2009 tijdvak 1 woensdag 20 mei totale examentijd 3 uur natuurkunde 1,2 Compex Vragen 1 tot en met 14 In dit deel van het examen staan de vragen waarbij de computer niet wordt gebruikt. Bij dit
Examen VWO 2009 tijdvak 1 woensdag 20 mei totale examentijd 3 uur natuurkunde 1,2 Compex Vragen 1 tot en met 14 In dit deel van het examen staan de vragen waarbij de computer niet wordt gebruikt. Bij dit
Eindexamen natuurkunde 1 vwo 2004-I
 - + Eindexamen natuurkunde vwo 2004-I 4 Beoordelingsmodel Opgave Valentijnshart Maximumscore 4 uitkomst: b 2,9 mm Bij het fotograferen van een voorwerp in het oneindige geldt: b f Bij het fotograferen
- + Eindexamen natuurkunde vwo 2004-I 4 Beoordelingsmodel Opgave Valentijnshart Maximumscore 4 uitkomst: b 2,9 mm Bij het fotograferen van een voorwerp in het oneindige geldt: b f Bij het fotograferen
TECHNISCHE UNIVERSITEIT EINDHOVEN. Tentamen Stralingsfysica (3D100) d.d. 9 januari 2008 van 9:00 12:00 uur
 TECHNISCHE UNIVERSITEIT EINDHOVEN Tentamen Stralingsfysica (3D d.d. 9 januari 8 van 9: : uur Vul de presentiekaart in blokletters in en onderteken deze. Gebruik van boek, aantekeningen of notebook is niet
TECHNISCHE UNIVERSITEIT EINDHOVEN Tentamen Stralingsfysica (3D d.d. 9 januari 8 van 9: : uur Vul de presentiekaart in blokletters in en onderteken deze. Gebruik van boek, aantekeningen of notebook is niet
Trillingen en geluid wiskundig
 Trillingen en geluid wiskundig 1 De sinus van een hoek 2 Radialen 3 Uitwijking van een harmonische trilling 4 Macht en logaritme 5 Geluidsniveau en amplitude 1 De sinus van een hoek Sinus van een hoek
Trillingen en geluid wiskundig 1 De sinus van een hoek 2 Radialen 3 Uitwijking van een harmonische trilling 4 Macht en logaritme 5 Geluidsniveau en amplitude 1 De sinus van een hoek Sinus van een hoek
Schoolexamen Moderne Natuurkunde
 Schoolexamen Moderne Natuurkunde Natuurkunde 1,2 VWO 6 6 april 2009 Tijdsduur: 90 minuten eze toets bestaat uit twee delen (I en II). eel I bestaat uit meerkeuzevragen, deel II uit open vragen. e meerkeuzevragen
Schoolexamen Moderne Natuurkunde Natuurkunde 1,2 VWO 6 6 april 2009 Tijdsduur: 90 minuten eze toets bestaat uit twee delen (I en II). eel I bestaat uit meerkeuzevragen, deel II uit open vragen. e meerkeuzevragen
Schriftelijk examen 2e Ba Biologie Fysica: elektromagnetisme 2011-2012
 - Biologie Schriftelijk examen 2e Ba Biologie 2011-2012 Naam en studierichting: Aantal afgegeven bladen, deze opgaven niet meegerekend: Gebruik voor elke nieuwe vraag een nieuw blad. Zet op elk blad de
- Biologie Schriftelijk examen 2e Ba Biologie 2011-2012 Naam en studierichting: Aantal afgegeven bladen, deze opgaven niet meegerekend: Gebruik voor elke nieuwe vraag een nieuw blad. Zet op elk blad de
vwo: Het maken van een natuurkunde-verslag vs 21062011
 Het maken van een verslag voor natuurkunde, vwo versie Deze tekst vind je op www.agtijmensen.nl: Een voorbeeld van een verslag Daar vind je ook een po of pws verslag dat wat uitgebreider is. Gebruik volledige
Het maken van een verslag voor natuurkunde, vwo versie Deze tekst vind je op www.agtijmensen.nl: Een voorbeeld van een verslag Daar vind je ook een po of pws verslag dat wat uitgebreider is. Gebruik volledige
Atoom theorie. Inleiding
 Atoom theorie Inleiding Democritus Democritus van Abdera (ca. 460 v. Chr.-380/370 v. Chr.) was een Grieks geleerde, filosoof astronoom en reiziger. Materie bestaat uit zeer kleine ondeelbare eenheden (a-tomos
Atoom theorie Inleiding Democritus Democritus van Abdera (ca. 460 v. Chr.-380/370 v. Chr.) was een Grieks geleerde, filosoof astronoom en reiziger. Materie bestaat uit zeer kleine ondeelbare eenheden (a-tomos
Om een zo duidelijk mogelijk verslag te maken, hebben we de vragen onderverdeeld in 4 categorieën.
 Beste leerling, Dit document bevat het examenverslag voor leerlingen van het vak natuurkunde havo, tweede tijdvak (2018). In dit examenverslag proberen we een zo goed mogelijk antwoord te geven op de volgende
Beste leerling, Dit document bevat het examenverslag voor leerlingen van het vak natuurkunde havo, tweede tijdvak (2018). In dit examenverslag proberen we een zo goed mogelijk antwoord te geven op de volgende
d.j. hoekzema g.j. schooten versie 2005 e. van den berg project Moderne Natuurkunde op het VWO http://www.phys.uu.nl/~wwwpmn
 d.j. hoekzema g.j. schooten versie 2005 e. van den berg project Moderne Natuurkunde op het VWO Opgaven Links Antwoorden http://www.phys.uu.nl/~wwwpmn Opgaven I Opgaven Hoofdstuk 1 opgave 1 ** a q ) Neem
d.j. hoekzema g.j. schooten versie 2005 e. van den berg project Moderne Natuurkunde op het VWO Opgaven Links Antwoorden http://www.phys.uu.nl/~wwwpmn Opgaven I Opgaven Hoofdstuk 1 opgave 1 ** a q ) Neem
- KLAS 5. c) Bereken de snelheid waarmee een elektron vrijkomt als het groene licht op de Rbkathode
 NATUURKUNDE - KLAS 5 PROEFWERK H7 --- 26/11/10 Het proefwerk bestaat uit 3 opgaven; totaal 32 punten. Opgave 1: gasontladingsbuis (4 p) In een gasontladingsbuis (zoals een TL-buis) zijn het gassen die
NATUURKUNDE - KLAS 5 PROEFWERK H7 --- 26/11/10 Het proefwerk bestaat uit 3 opgaven; totaal 32 punten. Opgave 1: gasontladingsbuis (4 p) In een gasontladingsbuis (zoals een TL-buis) zijn het gassen die
Eindexamen havo natuurkunde pilot II
 Eindexamen havo natuurkunde pilot 0 - II Aan het juiste antwoord op een meerkeuzevraag worden scorepunten toegekend. Opgave Parasaurolophus maximumscore antwoord: resonantie maximumscore Voor de grondtoon
Eindexamen havo natuurkunde pilot 0 - II Aan het juiste antwoord op een meerkeuzevraag worden scorepunten toegekend. Opgave Parasaurolophus maximumscore antwoord: resonantie maximumscore Voor de grondtoon
Inleiding stralingsfysica
 Inleiding stralingsfysica Historie 1896: Henri Becquerel ontdekt het verschijnsel radioactiviteit 1895: Wilhelm Conrad Röntgen ontdekt Röntgenstraling RadioNucliden: Inleiding Stralingsfysica 1 Wat maakt
Inleiding stralingsfysica Historie 1896: Henri Becquerel ontdekt het verschijnsel radioactiviteit 1895: Wilhelm Conrad Röntgen ontdekt Röntgenstraling RadioNucliden: Inleiding Stralingsfysica 1 Wat maakt
Cover Page. The handle holds various files of this Leiden University dissertation.
 Cover Page The handle http://hdl.handle.net/1887/35972 holds various files of this Leiden University dissertation. Author: Wang, Qiang Title: Photon detection at subwavelength scales Issue Date: 2015-10-27
Cover Page The handle http://hdl.handle.net/1887/35972 holds various files of this Leiden University dissertation. Author: Wang, Qiang Title: Photon detection at subwavelength scales Issue Date: 2015-10-27
Om een zo duidelijk mogelijk verslag te maken, hebben we de vragen onderverdeeld in 4 categorieën.
 Beste leerling, Dit document bevat het examenverslag voor leerlingen van het vak natuurkunde vwo, tweede tijdvak (2019). In dit examenverslag proberen we een zo goed mogelijk antwoord te geven op de volgende
Beste leerling, Dit document bevat het examenverslag voor leerlingen van het vak natuurkunde vwo, tweede tijdvak (2019). In dit examenverslag proberen we een zo goed mogelijk antwoord te geven op de volgende
QUANTUM FYSICA 1 3NB50. donderdag 28 oktober uur. Dit tentamen omvat 2 opgaven.
 1 QUANTUM FYSICA 1 3NB5 donderdag 8 oktober 1 14. 17. uur Dit tentamen omvat opgaven. Bij ieder onderdeel wordt aangegeven wat de maximale score is op een schaal van 1 punten. Het formuleblad voor dit
1 QUANTUM FYSICA 1 3NB5 donderdag 8 oktober 1 14. 17. uur Dit tentamen omvat opgaven. Bij ieder onderdeel wordt aangegeven wat de maximale score is op een schaal van 1 punten. Het formuleblad voor dit
Schoolexamen Moderne Natuurkunde
 Schoolexamen Moderne Natuurkunde Natuurkunde 1,2 VWO 6 31 maart 2008 Tijdsduur: 90 minuten Deze toets bestaat uit twee delen (I en II). Deel I bestaat uit meerkeuzevragen, deel II uit open vragen. De meerkeuzevragen
Schoolexamen Moderne Natuurkunde Natuurkunde 1,2 VWO 6 31 maart 2008 Tijdsduur: 90 minuten Deze toets bestaat uit twee delen (I en II). Deel I bestaat uit meerkeuzevragen, deel II uit open vragen. De meerkeuzevragen
Tentamen Natuurkunde 1A 09.00 uur - 12.00 uur vrijdag 14 januari 2011 docent drs.j.b. Vrijdaghs
 Tentamen Natuurkunde 1A 09.00 uur - 12.00 uur vrijdag 14 januari 2011 docent drs.j.b. Vrijdaghs Aanwijzingen: Dit tentamen omvat 6 opgaven met totaal 20 deelvragen Begin elke opgave op een nieuwe kant
Tentamen Natuurkunde 1A 09.00 uur - 12.00 uur vrijdag 14 januari 2011 docent drs.j.b. Vrijdaghs Aanwijzingen: Dit tentamen omvat 6 opgaven met totaal 20 deelvragen Begin elke opgave op een nieuwe kant
Schrödinger vergelijking. Tous Spuijbroek Cursus Quantumwereld Najaar 2013
 Schrödinger vergelijking Tous Spuijbroek Cursus Quantumwereld Najaar 2013 Inhoud presentatie Algemene opmerkingen Aannemelijk maken van de vergelijking Oplossingen van de vergelijking De situatie rond
Schrödinger vergelijking Tous Spuijbroek Cursus Quantumwereld Najaar 2013 Inhoud presentatie Algemene opmerkingen Aannemelijk maken van de vergelijking Oplossingen van de vergelijking De situatie rond
MINISTERIE VAN ONDERWIJS, WETENSCHAP EN CULTUUR UNIFORM EXAMEN VWO 2015
 MINISTERIE VAN ONDERWIJS, WETENSCHAP EN CULTUUR VAK : NATUURKUNDE DATUM : VRIJDAG 19 JUNI 2015 TIJD : 07.45 10.45 UNIFORM EXAMEN VWO 2015 Aantal opgaven: 5 Aantal pagina s: 6 Controleer zorgvuldig of alle
MINISTERIE VAN ONDERWIJS, WETENSCHAP EN CULTUUR VAK : NATUURKUNDE DATUM : VRIJDAG 19 JUNI 2015 TIJD : 07.45 10.45 UNIFORM EXAMEN VWO 2015 Aantal opgaven: 5 Aantal pagina s: 6 Controleer zorgvuldig of alle
QUARK_5-Thema-01-elektrische kracht Blz. 1
 QUARK_5-Thema-01-elektrische kracht Blz. 1 THEMA 1: elektrische kracht Elektriciteit Elektrische lading Lading van een voorwerp Fenomeen: Sommige voorwerpen krijgen een lading door wrijving. Je kan aan
QUARK_5-Thema-01-elektrische kracht Blz. 1 THEMA 1: elektrische kracht Elektriciteit Elektrische lading Lading van een voorwerp Fenomeen: Sommige voorwerpen krijgen een lading door wrijving. Je kan aan
Kwantummechanica HOVO cursus. Jo van den Brand Lecture 2: September 29, 2016
 Kwantummechanica HOVO cursus Jo van den Brand Lecture 2: September 29, 2016 Copyright (C) VU University Amsterdam 2016 Overzicht Algemene informatie Jo van den Brand Email: jo@nikhef.nl 0620 539 484 /
Kwantummechanica HOVO cursus Jo van den Brand Lecture 2: September 29, 2016 Copyright (C) VU University Amsterdam 2016 Overzicht Algemene informatie Jo van den Brand Email: jo@nikhef.nl 0620 539 484 /
natuurkunde 1,2 Compex
 Examen HAVO 2007 tijdvak 1 woensdag 23 mei totale examentijd 3,5 uur natuurkunde 1,2 Compex Vragen 1 tot en met 17 In dit deel van het examen staan de vragen waarbij de computer niet wordt gebruikt. Bij
Examen HAVO 2007 tijdvak 1 woensdag 23 mei totale examentijd 3,5 uur natuurkunde 1,2 Compex Vragen 1 tot en met 17 In dit deel van het examen staan de vragen waarbij de computer niet wordt gebruikt. Bij
Atoomfysica uitwerkingen opgaven
 Atoomfysica uitwerkingen opgaven Opgave 1.1 Wat zijn golven? a Geef nog een voorbeeld van een golf waaraan je kunt zien dat de golf zich wel zijwaarts verplaatst maar de bewegende delen niet. de wave in
Atoomfysica uitwerkingen opgaven Opgave 1.1 Wat zijn golven? a Geef nog een voorbeeld van een golf waaraan je kunt zien dat de golf zich wel zijwaarts verplaatst maar de bewegende delen niet. de wave in
TECHNISCHE UNIVERSITEIT EINDHOVEN. Tentamen Stralingsfysica (3D100) d.d. 27 november 2003 van 09:00 12:00 uur
 TECHNISCHE UNIVERSITEIT EINDHOVEN Tentamen Stralingsfysica (3D1) d.d. 7 november 3 van 9: 1: uur Vul de presentiekaart in blokletters in en onderteken deze. Gebruik van boek, aantekeningen of notebook
TECHNISCHE UNIVERSITEIT EINDHOVEN Tentamen Stralingsfysica (3D1) d.d. 7 november 3 van 9: 1: uur Vul de presentiekaart in blokletters in en onderteken deze. Gebruik van boek, aantekeningen of notebook
Eindexamen natuurkunde 1-2 vwo 2002-II
 Eindexamen natuurkunde - vwo 00-II Opgave Sellafield Maximumscore voorbeeld van een antwoord: U ( n) Cs ( x n) Rb. 9 0 55 0 7 (Het andere element is dus Rb.) berekenen van het atoomnummer consequente keuze
Eindexamen natuurkunde - vwo 00-II Opgave Sellafield Maximumscore voorbeeld van een antwoord: U ( n) Cs ( x n) Rb. 9 0 55 0 7 (Het andere element is dus Rb.) berekenen van het atoomnummer consequente keuze
Opgave Zonnestelsel 2005/2006: 7. 7 Het viriaal theorema en de Jeans Massa: Stervorming. 7.1 Het viriaal theorema
 Opgave Zonnestelsel 005/006: 7 7 Het viriaal theorema en de Jeans Massa: Stervorming 7. Het viriaal theorema Het viriaal theorema is van groot belang binnen de sterrenkunde: bij stervorming, planeetvorming
Opgave Zonnestelsel 005/006: 7 7 Het viriaal theorema en de Jeans Massa: Stervorming 7. Het viriaal theorema Het viriaal theorema is van groot belang binnen de sterrenkunde: bij stervorming, planeetvorming
