Redoxreacties; een aanvulling op hoofdstuk 13
|
|
|
- Edith de Ridder
- 8 jaren geleden
- Aantal bezoeken:
Transcriptie
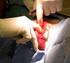
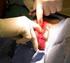
1 Redoxreacties; een aanvulling op hoofdstuk Elektronenoverdracht In dit hoofdstuk maken we kennis met zogenaamde redoxreacties. Dit zijn reacties waarbij elektronenoverdracht plaatsvindt. De naam redoxreactie is een samentrekking van reductie- en oxidatiereactie. Dit type reactie komt veel in de praktijk voor. Bijvoorbeeld bij verbrandingen, maar ook in een batterij of accu en bij het galvaniseren (verzinken, vertinnen, verzilveren, vergulden). Bij de zoutvorming en de geleiding van elektrische stroom in een oplossing van een zout heb je in feite al kennis gemaakt met een tweetal redoxreacties. Zo heb je eerder geleerd dat bijvoorbeeld het zout NaCl uit de elementen Na en Cl 2 kan worden gevormd volgens: 2 Na(s) + Cl 2 (g) 2 NaCl(s) (eerdere notatie: Na + Cl - ) Hierbij is sprake van elektronenoverdracht; elk Na atoom draagt een elektron over aan Cl-atoom onder vorming van een ionrooster. Je kunt deze reactie opsplitsen in twee zogenaamde halfreacties (die opgeteld weer de reactievergelijking opleveren). Tenslotte schrijf je voor 2 Na Cl - weer gewoon 2 Na + Cl - of 2 NaCl. 2 Na 2 Na + + e Cl e 2 Cl 2 Na + Cl 2 2 Na Cl 2 Na + Cl 2 2 NaCl Bij deze reacties verandert de lading van de atomen. Het aantal afgestane en opgenomen elektronen is altijd gelijk. Bovendien moet de lading van de deeltjes in de reactievergelijking links van de pijl gelijk zijn aan de lading rechts. Het deeltje dat elektronen opneemt noemt men de oxidator en wordt daarbij gereduceerd; de reductor staat elektronen af en wordt geoxideerd. Een oxidatie is dus het proces waarbij een deeltje elektronen afstaat en een reductie is het proces waarbij een deeltje elektronen opneemt. Een ander voorbeeld is de oxidatie van magnesium door zuurstof. Zuurstof treedt op als oxidator en magnesium als reductor: Mg Mg e oxidatie O e 2 O 2 reductie Oxidatie en reductie gaan altijd samen. Het aantal afgestane en opgenomen elektronen is altijd gelijk, dus moeten we de eerste halfreactie met twee vermenigvuldigen. Na optelling van beide halfreacties ontstaat de totale reactievergelijking van de redoxreactie. Tenslotte schrijf je voor 2 Mg O weer gewoon 2 Mg 2+ O of beter 2 MgO. 2 x [Mg Mg e ] O e 2 O 2 2 Mg + O 2 2 Mg O 2 2 Mg + O 2 2 MgO 1
2 Samenvattend: reductie = elektronenopname; oxidatie = elektronenafgifte; reductor (red) = deeltje dat elektronen kan afstaan; oxidator (ox) = deeltje dat elektronen kan opnemen. 2. Redoxreacties met metalen Bij de opdrachten 25 en 26 was sprake van redoxreacties waarbij een element reageerde met een ion van een ander element. Het ion werd daarbij ontladen terwijl het element zelf een ion werd. Het ging om de volgende redoxreacties: 1. Fe(s) + Cu 2+ (aq) Cu(s) + Fe 2+ (aq) (aan een CuSO 4 -oplossing werd staalwol toegevoegd) 2. Zn(s) + Pb 2+ (aq) Pb(s) + Zn 2+ (aq) (een korrel Zn werd in een Pb(NO 3 ) 2 -oplossing gebracht) 3. Cu(s) + 2 Ag + Cu 2+ (aq) + Ag(s) (een stukje koper werd in een AgNO 3 -oplossing gebracht) Uit het eerste en derde voorbeeld blijkt dat halfreacties omkeerbaar zijn. Bij 1 is Cu 2+ de oxidator, terwijl bij 3 Cu als reductor optreedt. Bovendien zijn het evenwichtsreacties, maar dat tonen we hier niet aan. Het algemene schema voor een redoxreactie kan als volgt worden weergegeven: oxidator 1 + elektron(en) reductor 1 of: ox 1 + n e red 1 reductor 2 oxidator 2 + elektron(en) red 2 ox 2 + n e oxidator 1 + reductor 2 oxidator 2 + reductor 1 ox 1 + red 2 ox 2 + red 1 We hebben bij opdracht 12 ook gezien dat, in het geval aan Fe 2+ ionen (in de vorm van een FeSO 4 - oplossing) een stukje koper wordt toegevoegd, geen reactie optreedt, terwijl Cu (kan elektronen afstaan) een reductor en Fe 2+ (kan elektronen opnemen) een oxidator is. Hieruit kun je concluderen dat Fe een sterkere reductor is dan Cu en dat Cu 2+ een sterkere oxidator is dan Fe 2+. Meer algemeen geformuleerd: Bij een redoxreactie zijn de reductor en de oxidator voor de pijl sterker dan de reductor en oxidator na de pijl. Aan de hand van soortgelijke proeven als 12, 14 en 15 kun je een reeks opstellen waarbij de metalen zowel als element (reductor) als ion (oxidator) naar sterkte gerangschikt staan. De belangrijkste staan hieronder weergegeven. Afbeelding 1: Rangschikking van een aantal metalen in de vorm van oxidatoren en reductoren. 2
3 In de tweede kolom is van boven naar beneden de mate waarin het metaal elektronen kan afstaan groter. Bijvoorbeeld Fe staat gemakkelijker elektronen af dan Cu. Dit betekent dat Cu 2+ ionen door Fe uit de oplossing worden verdrongen (onder vorming van Fe 2+ ionen en het metaal Cu). Zo is uit de eerste kolom af te lezen dat bijvoorbeeld Cu 2+ gemakkelijker elektronen opneemt dan de metaalionen die er onder staan. Deze rangschikking geeft tevens de indeling van de metalen in edel en onedel weer. Het meest edele metaal (in de tweede kolom) van de reeks (Au) staat boven aan en het meest onedele metaal onder aan. Goud wordt niet snel aangetast (staat niet snel elektronen af), terwijl van bijvoorbeeld natrium bekend is dat het zeer heftig met water reageert (onder vorming van Na+ ionen, dus gemakkelijk elektronen afstaat). In deze zogenaamde verdringingsreeks is ook het element waterstof opgenomen; alle metalen die in de reeks onder waterstof staan, reageren met H + ionen onder waterstofontwikkeling. Een voorbeeld (zie opdracht 1 blz. 32) is de reactie van magnesium met zoutzuur: Mg(s) Mg 2+ (aq) + 2 e red 1 ox 1 2 H e H 2 (g) ox 2 red 2 Mg(s) + 2 H + (aq) Mg 2+ (aq) + H 2 (g) red 1 ox 2 ox 1 red 2 3. Redoxreacties met niet-metalen In opdracht 38 (blz. 129) is de oxidatorsterkte van de halogenen chloor, broom en jood onderzocht. Daarbij viel op dat de oxidatorsterkte overeenkomt met de volgorde van de halogenen in groep 17 van het periodiek systeem; fluor is de sterkste en jood de zwakte oxidator. De verdringingsreeks van de halogenen kan als volgt worden weergegeven: Afbeelding 2: Rangschikking van de halogenen in de vorm van oxidatoren en reductoren. Net zoals bij de verdringingsreeks van de metalen kun je hieruit aflezen dat een halogeen een ion van een ander halogeen dat er onder staat verdringt (omdat het een zwakkere oxidator is dan het daarboven). Zo heb je gezien dat chloorwater (Cl 2 (aq)) reageert met een KBr- en een KI-oplossing en dat broomwater (Br 2 (aq)) ook met een KI-oplossing reageert. De vergelijkingen van de eerste en laatste reactie kunnen als volgt worden weergegeven. Cl e 2 Cl Br e 2 Br 2 Br - Br e 2 I I e Cl 2 (aq) + 2 Br (aq) 2 Cl (aq) + Br 2 (aq) Br 2 (aq) + 2 I (aq) 2 Br - (aq) + I 2 (aq) 4. Het opstellen van redoxreacties Redoxreacties kunnen plaatsvinden in zowel zuur als in neutraal of basisch milieu. Als de halfreacties niet bekend zijn, kun je met behulp van de volgende regels, die aan de hand van twee voorbeelden stap voor stap zullen worden toegelicht, de redoxreactie opstellen. 3
4 Voorbeeld 1 Wanneer zwaveldioxide in een met azijnzuur aangezuurde oplossing van kaliumdichromaat (K 2 Cr 2 O 7 ) wordt geleid, verandert de kleur van de oplossing van oranje veroorzaakt door de dichromaationen in groen, de kleur van chroom(iii)ionen. Tevens kunnen na de reactie in de oplossing sulfaationen worden aangetoond. Voor het opstellen van de redoxreacties worden de volgende regels toegepast: 1. Stel de redoxkoppels op en zorg dat het aantal atomen van elk element, met uitzondering van waterstof- en zuurstofatomen, links en rechts even groot is. Cr 2 O 7 2 Cr 3+ SO 2 SO 4 2. Maak de zuurstofbalans kloppend met H 2 O-moleculen. Cr 2 O 7 2 Cr H 2 O SO H 2 O SO 4 3a. Maak de waterstofbalans kloppend met H + -ionen. Cr 2 O H + 2 Cr H 2 O SO H 2 O SO H + (3b. Voeg in neutraal of basisch milieu aan beide kanten van de halfreacties evenveel OH -ionen toegevoegd als er H + -ionen in de vergelijking staan.) 4. Vul de ontbrekende lading aan met elektronen. Cr 2 O H + + 6e 2 Cr H 2 O SO H 2 O SO H + + 2e 5. Vermenigvuldig de halfreacties zodanig dat het aantal opgenomen elektronen gelijk is aan het aantal afgestane elektronen en tel tenslotte beide halreacties op. Vermeld ook de toestanden. Cr 2 O H + + 6e 2 Cr H 2 O 1 SO H 2 O SO H + + 2e 3 Cr 2 O 7 (aq) + 3 SO 2 (g) + 2 H + (aq) 2 Cr 3+ (aq) + 3 SO 4 (aq) + H 2 O(l) Voorbeeld 2 Bij het inleiden van zwaveldioxide in een basische oplossing van kaliumpermanganaat (KMnO 4 ) verdwijnt de paarse kleur van de permanganaationen en ontstaat een bruin neerslag van bruinsteen (MnO 2 ). Tevens kunnen na de reactie in de oplossing sulfaationen worden aangetoond. Het opstellen van de redoxvergelijking gaat nu als volgt. 1. MnO - 4 MnO 2 SO 2 SO 4 2. MnO - 4 MnO H 2 O SO H 2 O SO 4 3a. MnO H + MnO H 2 O SO H 2 O SO H + 3b. MnO H OH - MnO H 2 O + 4 OH - SO H 2 O + 4 OH - SO H OH - daar H + + OH - H 2 O volgt: 4
5 MnO H 2 O MnO OH - SO OH - SO H 2 O 4. MnO H 2 O + 3e MnO OH - SO OH - SO H 2 O + 2e 5. MnO H 2 O + 3e MnO OH - 2 SO OH - SO H 2 O + 2e 3 2 MnO - 4 (aq) + 3 SO 2 (g) + 4 OH - (aq) 2 MnO SO H 2 O Opgaven Stel, als de reactie verloopt, de redoxreacties op voor de volgende reacties: 1. Een aangezuurde oplossing van kaliumpermanganaat reageert met een magnesiumsulfietoplossing. 2. Een verdunde oplossing van salpeterzuur reageert met een oplossing van ijzer(ii)sulfaat. 3. Een joodoplossing reageert met een oplossing van natriumthiosulfaat. 4. Waterstofperoxide reageert met een met zoutzuur aangezuurde kaliumjodideoplossing. 5. Een oplossing van kaliumpermanganaat reageert met een aangezuurde oplossing van kaliumnitriet. 6. Chloor wordt in een met geconcentreerd zoutzuur aangezuurde tin(ii)chloride-oplossing geleid. 7. Geconcentreerd zwavelzuur reageert met een kaliumbromide-oplossing. Stel de redoxreacties op voor de volgende reacties: 8. Door koken, in aanwezigheid van zinkpoeder, wordt het nitraation in basische oplossing g e- reduceerd tot ammoniak; uit zink ontstaat het complexe Zn(OH) 4 2 -ion. 9. In basisch milieu reageert een oplossing van mangaan(ii)sulfaat met een oplossing van natriumperchloraat (NaClO 3 ) tot bruinsteen (MnO 2 ) en chloordioxide. 10. Een oplossing van natriumhypochloriet (NaClO) reageert in basisch milieu met het chromietion (Cr(OH) 4 ) tot het chromaation (Cr 2 O 7 2 ) en het chloride-ion. 5. Het voorspellen van redoxreacties met behulp van standaard elektrodepotentialen In tabel 48 is ook een kolom opgenomen met zogenaamde standaard elektrodepotentialen 1, uitgedrukt in volt. De getalwaarden hiervan kun je gebruiken als maat voor de sterkte van oxidatoren en reductoren. Voor oxidatoren geldt dat een hoge waarde van V 0 overeenkomt met een grote oxidatorsterkte. Een grote reductorsterkte daarentegen correspondeert met een lage waarde van V 0. Hoe groter V 0, hoe sterker de oxidator is en hoe zwakker zijn bijbehorende reductor. Van de volgende redoxreacties weten we al dat ze verlopen (zie punt 2.1 en 3): Fe(s) + Cu 2+ (aq) Cu(s) + Fe 2+ (aq) (aan een CuSO 4 -oplossing werd staalwol toegevoegd; de staalwol werd rood gekleurd door afzetting van een laagje Cu)) Cl 2 (aq) + 2 Br - (aq) 2 Cl - (aq) + Br 2 (aq) (aan een kleurloze KBr oplossing is chloorwater toegevoegd; de oplossing kleurde bruin) De standaard elektrodepotentialen van de redoxkoppels zijn: 1 De standaard elektrodepotentialen gelden bij concentratie van 1 mol L 1 5
6 Cu e Cu Fe Fe e Fe(s) + Cu 2+ (aq) Cu(s) + Fe 2+ (aq) V 0 = + 0,34 V V 0 = 0,44 V ΔV 0 = + 0,77 V Cl e 2 Cl V 0 = + 1,36 V 2 Br Br e V 0 = + 1,07 V Cl 2 (aq) + 2 Br (aq) 2 Cl (aq) + Br 2 (aq) ΔV 0 = + 0,29 V Het blijkt dat en aflopende reactie optreedt als het verschil tussen de betreffende elektrodepotentialen, ΔV 0, groter is dan 0,3 V. De volgende vuistregel blijkt te gelden voor elke combinatie van een oxidator en een reductor: de reactie is aflopend als V 0 (ox 1, red 1 ) > V 0 (ox 2, red 2 ), in de praktijk moet het verschil ΔV 0 0,3 V zijn; de reactie verloopt niet als V 0 (ox 1, red 1 ) < V 0 (ox 2, red 2 ), in de praktijk moet het verschil ΔV 0 0,3 V zijn; er stelt zich een evenwicht in als 0,3 V ΔV 0 0,3 V. Let erop dat je bij deze methode altijd de reductie (elektronenopname) bovenaan zet. Laten we de eerder gegeven voorbeelden a, b en c ook eens op deze manier bekijken. a. Mg + HF 2 H e H 2 V 0 = + 0,00 V Mg Mg e V 0 = 2,37 V Mg(s) + 2 H + (aq) Mg 2+ (aq) + H 2 (g) ΔV 0 = + 2,37 V Deze reactie is aflopend omdat ΔV 0 > 0,3 V. b. Br 2 + FeCl 2 Br e 2 Br V 0 = + 1,09 V 2 Fe 2+ 2 Fe e ] V 0 = + 0,77 V Mg(s) + 2 H + (aq) Mg 2+ (aq) + H 2 (g) ΔV 0 = + 0,32 V Ook deze reactie is aflopend omdat ΔV 0 > 0,3 V. c. Ag + HCl 2 H e H 2 V 0 = + 0,00 V 2 Ag 2 Ag e V 0 = + 0,80 V 2 Ag(s) +2 H + (aq) geen reactie, omdat ΔV 0 = 0,80 V De volgende reactie is een voorbeeld van een redoxreactie waarbij zich een evenwicht instelt: Tin wordt overgoten met geconcentreerd zoutzuur. 1 Inventariseer welke deeltjes aanwezig zijn: Sn(s), H + (aq) en Cl - (aq) 2 Zoek de (sterkste) oxidator: H + (aq) 3 Zoek de (sterkste) reductor: Sn, omdat V 0 (Sn 2+ /Sn) < V 0 (Cl 2 /Cl - ) (respectievelijk 0,14 en1,36 V) 4 Schrijf de halfreacties met V 0 waarden op: 2 H e H 2 V 0 = + 0,00 V Sn Sn e V 0 = 0,14 V Sn(s) + 2 H + (aq) Sn 2+ (aq) + H 2 (g) ΔV 0 = + 0,14 V 5 Ga na of de redoxreactie aflopend, een evenwicht is of niet verloopt Er stelt zich een evenwicht in, omdat 0,3 V ΔV 0 0,3 V 6
Hierbij is sprake van elektronenoverdracht; elk Na atoom draagt een elektron over aan Cl-atoom onder vorming van een ionrooster.
 Redoxreacties 1. Elektronenoverdracht In dit hoofdstuk maken we kennis met zogenaamde redoxreacties. Dit zijn reacties waarbij elektronenoverdracht plaatsvindt. De naam redoxreactie is een samentrekking
Redoxreacties 1. Elektronenoverdracht In dit hoofdstuk maken we kennis met zogenaamde redoxreacties. Dit zijn reacties waarbij elektronenoverdracht plaatsvindt. De naam redoxreactie is een samentrekking
Elektronenoverdracht (1)
 Redoxreacties 1 Elektronenoverdracht (1) Een bekende reactie is: 2 Na(s) + Cl 2 (g) 2 NaCl(s) (oude notatie: Na + Cl - ) Hierbij is sprake van elektronenoverdracht. Dit kan als volgt worden voorgesteld:
Redoxreacties 1 Elektronenoverdracht (1) Een bekende reactie is: 2 Na(s) + Cl 2 (g) 2 NaCl(s) (oude notatie: Na + Cl - ) Hierbij is sprake van elektronenoverdracht. Dit kan als volgt worden voorgesteld:
Reacties en stroom 1
 Reacties en stroom 1 Elektronenoverdracht (1) Een bekende reactie is: 2 Na(s) + Cl 2 (g) 2 NaCl(s) (oude notatie: Na + Cl - ) Hierbij is sprake van elektronenoverdracht. Dit kan als volgt worden voorgesteld:
Reacties en stroom 1 Elektronenoverdracht (1) Een bekende reactie is: 2 Na(s) + Cl 2 (g) 2 NaCl(s) (oude notatie: Na + Cl - ) Hierbij is sprake van elektronenoverdracht. Dit kan als volgt worden voorgesteld:
Reacties en stroom; een aanvulling op hoofdstuk 9
 Reacties en stroom; een aanvulling op hoofdstuk 9 1. Elektronenoverdracht In dit hoofdstuk maken we kennis met zogenaamde redoxreacties. Dit zijn reacties waarbij elektronenoverdracht plaatsvindt. De naam
Reacties en stroom; een aanvulling op hoofdstuk 9 1. Elektronenoverdracht In dit hoofdstuk maken we kennis met zogenaamde redoxreacties. Dit zijn reacties waarbij elektronenoverdracht plaatsvindt. De naam
Inleiding in de RedOx chemie
 Even opfrissen: Drie hoofdcategorieën stoffen: Inleiding in de RedOx chemie Moleculaire stoffen: Atoombinding in molecuul (sterk), Van der Waals binding tussen moleculen (zwak), polaire/apolaire (atoom)bindingen,
Even opfrissen: Drie hoofdcategorieën stoffen: Inleiding in de RedOx chemie Moleculaire stoffen: Atoombinding in molecuul (sterk), Van der Waals binding tussen moleculen (zwak), polaire/apolaire (atoom)bindingen,
Oxidator = het deeltje dat elektronen onttrekt aan een ander deeltje Reductor = het deeltje dat elektronen afstaat aan een ander deeltje
 Cursus Chemie 6-1 Hoofdstuk 6: REDOX REACTIES 1. INLEIDING In vroegere tijden werd de term oxideren gebruikt om een reactie met zuurstof aan te geven. Bvb. de reactie waarbij koolstof verbrandt is C +
Cursus Chemie 6-1 Hoofdstuk 6: REDOX REACTIES 1. INLEIDING In vroegere tijden werd de term oxideren gebruikt om een reactie met zuurstof aan te geven. Bvb. de reactie waarbij koolstof verbrandt is C +
Hoofdstuk 17 Redoxreacties
 Hoofdstuk 17 Redoxreacties bladzijde 1 Opgave 1 Bepaal de oxidatiegetallen van alle atomen in: Waterstof H: altijd +1 Zuurstof O: altijd 2 Som ladingen steeds 0 a H 2O H: +1 O: 2 2 x +1 + 2 = 0 b SO 2
Hoofdstuk 17 Redoxreacties bladzijde 1 Opgave 1 Bepaal de oxidatiegetallen van alle atomen in: Waterstof H: altijd +1 Zuurstof O: altijd 2 Som ladingen steeds 0 a H 2O H: +1 O: 2 2 x +1 + 2 = 0 b SO 2
Hoofdstuk 8. Redoxreacties. Chemie 6 (2u)
 Hoofdstuk 8 Redoxreacties Chemie 6 (2u) Deze slides voor de lesbegeleiding worden ter beschikking gesteld, maar ze zijn te beperkt om als samenvatting van de cursus te kunnen dienen. Oxidatie / Reductie
Hoofdstuk 8 Redoxreacties Chemie 6 (2u) Deze slides voor de lesbegeleiding worden ter beschikking gesteld, maar ze zijn te beperkt om als samenvatting van de cursus te kunnen dienen. Oxidatie / Reductie
Curie Hoofdstuk 11 HAVO 5
 Redoxreacties Curie Hoofdstuk 11 HAVO 5 11.11 Wat zijn redoxreacties? 11.2 Voorspellen van redoxreacties 11.3 Elektrische stroom uit reacties 114Corrosie 11.4 11.5 Elektrolyse 11.6 Metaalwinning 11.1 Wat
Redoxreacties Curie Hoofdstuk 11 HAVO 5 11.11 Wat zijn redoxreacties? 11.2 Voorspellen van redoxreacties 11.3 Elektrische stroom uit reacties 114Corrosie 11.4 11.5 Elektrolyse 11.6 Metaalwinning 11.1 Wat
Basisscheikunde voor het hbo ISBN e druk Uitgeverij Syntax media
 Hoofdstuk 13 Redoxreacties bladzijde 1 Opgave 1 In de volgende halfreacties zijn de elektronen weggelaten. Zet zelf de elektronen erbij en vermeld of het deeltje geoxideerd of gereduceerd wordt. Links
Hoofdstuk 13 Redoxreacties bladzijde 1 Opgave 1 In de volgende halfreacties zijn de elektronen weggelaten. Zet zelf de elektronen erbij en vermeld of het deeltje geoxideerd of gereduceerd wordt. Links
Oefenopgaven REDOXREACTIES vwo Reactievergelijkingen en halfreacties
 Oefenopgaven REDOXREACTIES vwo Reactievergelijkingen en halfreacties OPGAVE 1 Geef de halfreactie waarbij 01 P 2 O 5 wordt omgezet in PH 3. 02 Jodaat, IO 3 - in neutraal milieu wordt omgezet in H 5 IO
Oefenopgaven REDOXREACTIES vwo Reactievergelijkingen en halfreacties OPGAVE 1 Geef de halfreactie waarbij 01 P 2 O 5 wordt omgezet in PH 3. 02 Jodaat, IO 3 - in neutraal milieu wordt omgezet in H 5 IO
Uitwerkingen van de opgaven uit: CHEMISCHE ANALYSE ISBN , 1 e druk, Uitgeverij Syntax Media Hoofdstuk 15 Elektrochemie bladzijde 1
 Hoofdstuk 15 Elektrochemie bladzijde 1 Opgave 1 Welke halfreactie kan men verwachten in de volgende gevallen? a Br ionen bij een positieve elektrode Br kan gemakkelijk elektronen afstaan, is dan reductor:
Hoofdstuk 15 Elektrochemie bladzijde 1 Opgave 1 Welke halfreactie kan men verwachten in de volgende gevallen? a Br ionen bij een positieve elektrode Br kan gemakkelijk elektronen afstaan, is dan reductor:
Oefenopgaven REDOX vwo
 Oefenopgaven REDOX vwo OPGAVE 1 Geef de halfreactie waarbij 01 P 2 O 5 wordt omgezet in PH 3. 02 Jodaat, IO 3 - in neutraal milieu wordt omgezet in H 5 IO 6. 03 Methanol in zuur milieu wordt omgezet in
Oefenopgaven REDOX vwo OPGAVE 1 Geef de halfreactie waarbij 01 P 2 O 5 wordt omgezet in PH 3. 02 Jodaat, IO 3 - in neutraal milieu wordt omgezet in H 5 IO 6. 03 Methanol in zuur milieu wordt omgezet in
1. Geef bij de volgende reactievergelijkingen steeds aan:
 Antwoorden Bijlage VI Oxidatiegetallen 1. Geef bij de volgende reactievergelijkingen steeds aan: welke stof wordt er geoxideerd +II +I II +I 0 +III +I +III II II +I +I II C 2 H 5 OH + O 2 CH 3 COOH + H
Antwoorden Bijlage VI Oxidatiegetallen 1. Geef bij de volgende reactievergelijkingen steeds aan: welke stof wordt er geoxideerd +II +I II +I 0 +III +I +III II II +I +I II C 2 H 5 OH + O 2 CH 3 COOH + H
Hans Vanhoe Katrien Strubbe Universiteit Gent SLO Chemie
 Chemie in druppels Hans Vanhoe Katrien Strubbe Universiteit Gent SLO Chemie 2 Oxidatie en reductie 2.1 Redoxreacties Een redoxreactie is een reactie waarbij elektronen uitgewisseld worden tussen reagentia.
Chemie in druppels Hans Vanhoe Katrien Strubbe Universiteit Gent SLO Chemie 2 Oxidatie en reductie 2.1 Redoxreacties Een redoxreactie is een reactie waarbij elektronen uitgewisseld worden tussen reagentia.
Redoxreacties. Gegeven zijn de volgende reactievergelijkingen: Reactie 1: Pd Cl - 2- PdCl 4 Reactie 2: 2 Cu I - -
 Redoxreacties 5vwo Opgave 1 Redox of niet? Gegeven zijn de volgende reactievergelijkingen: Reactie 1: Pd 2+ + 4 Cl - 2- PdCl 4 Reactie 2: 2 Cu 2+ + 5 I - - 2 CuI + I 3 Leg voor elk van beide reacties uit
Redoxreacties 5vwo Opgave 1 Redox of niet? Gegeven zijn de volgende reactievergelijkingen: Reactie 1: Pd 2+ + 4 Cl - 2- PdCl 4 Reactie 2: 2 Cu 2+ + 5 I - - 2 CuI + I 3 Leg voor elk van beide reacties uit
5 Formules en reactievergelijkingen
 5 Formules en reactievergelijkingen Stoffen bestaan uit moleculen en moleculen uit atomen (5.1) Stoffen bestaan uit moleculen. Een zuivere stof bestaat uit één soort moleculen. Een molecuul is een groepje
5 Formules en reactievergelijkingen Stoffen bestaan uit moleculen en moleculen uit atomen (5.1) Stoffen bestaan uit moleculen. Een zuivere stof bestaat uit één soort moleculen. Een molecuul is een groepje
Module 5 Reductoren en Oxidatoren Antwoorden
 2 Reductoren en oxidatoren Opmerking: informatie over reductoren en oxidatoren vind je in tabel 48. 1 De metalen vind je in de rechter kolom (reductoren). 2 Metaal-ionen: in de linker kolom (oxidatoren).
2 Reductoren en oxidatoren Opmerking: informatie over reductoren en oxidatoren vind je in tabel 48. 1 De metalen vind je in de rechter kolom (reductoren). 2 Metaal-ionen: in de linker kolom (oxidatoren).
Stoffen en Reacties 2
 Stoffen en Reacties 2 Practicum Metalen Naam student 1. Naam student2..... Pagina 2 van 13 Inleiding Reageert metaal met zuurstof? Sinds de mensheid metalen kent worden ze voor allerlei toepassingen gebruikt
Stoffen en Reacties 2 Practicum Metalen Naam student 1. Naam student2..... Pagina 2 van 13 Inleiding Reageert metaal met zuurstof? Sinds de mensheid metalen kent worden ze voor allerlei toepassingen gebruikt
leerlingenpracticum: met eenvoudige materiaal een eenvoudige redoxreactie uitvoeren;
 Leergebied: redoxreactie Leerplannen LP Chemie 2e gr KSO GO Lp 8 - oxidatie- en reductiereacties (redoxreacties) uitvoeren. LP Chemie 3e gr KSO GO Lp 14 - leerlingenpracticum 2: met eenvoudig materiaal
Leergebied: redoxreactie Leerplannen LP Chemie 2e gr KSO GO Lp 8 - oxidatie- en reductiereacties (redoxreacties) uitvoeren. LP Chemie 3e gr KSO GO Lp 14 - leerlingenpracticum 2: met eenvoudig materiaal
EXAMEN MIDDELBAAR ALGEMEEN VOORTGEZET ONDERWIJS IN Dit examen bestaat voor iedere kandidaat uit 8 OPGAVEN
 MAVO-4 I EXAMEN MIDDELBAAR ALGEMEEN VOORTGEZET ONDERWIJS IN 1973 MAVO-4 Woensdag 9 mei, 9.00 11.00 NATUUR-EN SCHEIKUNDE II (Scheikunde) OPEN VRAGEN Dit examen bestaat voor iedere kandidaat uit 8 OPGAVEN
MAVO-4 I EXAMEN MIDDELBAAR ALGEMEEN VOORTGEZET ONDERWIJS IN 1973 MAVO-4 Woensdag 9 mei, 9.00 11.00 NATUUR-EN SCHEIKUNDE II (Scheikunde) OPEN VRAGEN Dit examen bestaat voor iedere kandidaat uit 8 OPGAVEN
6 VWO EXTRA OPGAVEN + OEFENTENTAMENOPGAVEN SCHEIKUNDE 1 H4, H5, H7, H13 en H14
 6 VWO EXTRA OPGAVEN + OEFENTENTAMENOPGAVEN SCHEIKUNDE 1 H4, H5, H7, H13 en H14 1. Bij de reactie tussen ijzer en chloor ontstaat ijzer(iii)chloride, FeCl 3. Men laat 111,7 gram ijzer reageren met voldoende
6 VWO EXTRA OPGAVEN + OEFENTENTAMENOPGAVEN SCHEIKUNDE 1 H4, H5, H7, H13 en H14 1. Bij de reactie tussen ijzer en chloor ontstaat ijzer(iii)chloride, FeCl 3. Men laat 111,7 gram ijzer reageren met voldoende
Uitwerkingen van de opgaven uit: BASISCHEMIE voor het MLO ISBN , 3 e druk, Uitgeverij Syntax Media Hoofdstuk 18 Oxidimetrie bladzijde 1
 Hoofdstuk 18 Oxidimetrie bladzijde 1 Opgave 1 Bepaal met behulp van tabel II de reactie tussen kaliumpermanganaat in zuur milieu met: a Sn 2+ ionen MnO 4 + 8 H 3O + + 5 e Mn 2+ + 12 H 2O x 2 Sn 2+ Sn 4+
Hoofdstuk 18 Oxidimetrie bladzijde 1 Opgave 1 Bepaal met behulp van tabel II de reactie tussen kaliumpermanganaat in zuur milieu met: a Sn 2+ ionen MnO 4 + 8 H 3O + + 5 e Mn 2+ + 12 H 2O x 2 Sn 2+ Sn 4+
Samenvatting Scheikunde Boek 2
 Samenvatting Scheikunde Boek 2 Samenvatting door een scholier 2661 woorden 26 april 2005 6,2 89 keer beoordeeld Vak Methode Scheikunde Chemie overal Hoofdstuk 1 1.1 -> Reactie en molverhouding M Vm NA
Samenvatting Scheikunde Boek 2 Samenvatting door een scholier 2661 woorden 26 april 2005 6,2 89 keer beoordeeld Vak Methode Scheikunde Chemie overal Hoofdstuk 1 1.1 -> Reactie en molverhouding M Vm NA
Uitwerkingen van de opgaven uit: CHEMISCHE ANALYSE ISBN , 1 e druk, Uitgeverij Syntax Media Hoofdstuk 4 Oxidimetrie bladzijde 1
 Hoofdstuk 4 Oxidimetrie bladzijde 1 Opgave 1 Hoe groot is het oxidatiegetal van elk atoom in de onderstaande deeltjes? Uitgangspunten: H = +1 O = 2 metaalion (K + ) krijgt ionlading. som van de ladingen
Hoofdstuk 4 Oxidimetrie bladzijde 1 Opgave 1 Hoe groot is het oxidatiegetal van elk atoom in de onderstaande deeltjes? Uitgangspunten: H = +1 O = 2 metaalion (K + ) krijgt ionlading. som van de ladingen
EXAMEN MIDDELBAAR ALGEMEEN VOORTGEZET ONDERWIJS IN Dit examen bestaat voor iedere kandidaat uit 5 OPGAVEN
 MAVO-4 I EXAMEN MIDDELBAAR ALGEMEEN VOORTGEZET ONDERWIJS IN 1974 MAVO-4 Woensdag 8 mei, 9.00 11.00 NATUUR-EN SCHEIKUNDE II (Scheikunde) OPEN VRAGEN Dit examen bestaat voor iedere kandidaat uit 5 OPGAVEN
MAVO-4 I EXAMEN MIDDELBAAR ALGEMEEN VOORTGEZET ONDERWIJS IN 1974 MAVO-4 Woensdag 8 mei, 9.00 11.00 NATUUR-EN SCHEIKUNDE II (Scheikunde) OPEN VRAGEN Dit examen bestaat voor iedere kandidaat uit 5 OPGAVEN
EXAMEN MIDDELBAAR ALGEMEEN VOORTGEZET ONDERWIJS IN Dit examen bestaat voor iedere kandidaat uit 5 OPGAVEN
 MAVO-4 II EXAMEN MIDDELBAAR ALGEMEEN VOORTGEZET ONDERWIJS IN 1974 MAVO-4 Dinsdag 11 juni, 9.00 11.00 NATUUR-EN SCHEIKUNDE II (Scheikunde) OPEN VRAGEN Dit examen bestaat voor iedere kandidaat uit 5 OPGAVEN
MAVO-4 II EXAMEN MIDDELBAAR ALGEMEEN VOORTGEZET ONDERWIJS IN 1974 MAVO-4 Dinsdag 11 juni, 9.00 11.00 NATUUR-EN SCHEIKUNDE II (Scheikunde) OPEN VRAGEN Dit examen bestaat voor iedere kandidaat uit 5 OPGAVEN
PbSO 4(s) d NH 4Cl + KOH KCl + H 2O + NH 3(g) NH 4. + OH - NH 3(g) + H 2O e 2 NaOH + CuCl 2 Cu(OH) 2(s) + 2 NaCl
 Hoofdstuk 11 Chemische reacties bladzijde 1 Opgave 1 De ionen die in water ontstaan: a NaCl Na Cl - b AgNO 3 Ag - NO 3 c (NH 4) 2SO 4 2 NH 4 SO 4 d KOH K OH - e NiSO 4 Ni 2 SO 4 Opgave 2 Schrijf de volgende
Hoofdstuk 11 Chemische reacties bladzijde 1 Opgave 1 De ionen die in water ontstaan: a NaCl Na Cl - b AgNO 3 Ag - NO 3 c (NH 4) 2SO 4 2 NH 4 SO 4 d KOH K OH - e NiSO 4 Ni 2 SO 4 Opgave 2 Schrijf de volgende
Scheikunde Samenvatting H4+H5
 Scheikunde Samenvatting H4+H5 Hoofdstuk 4 4.2 Stoffen worden ingedeeld op grond van hun eigenschappen. Er zijn niet-ontleedbare stoffen en ontleedbare stoffen. De niet-ontleedbare stoffen zijn verdeeld
Scheikunde Samenvatting H4+H5 Hoofdstuk 4 4.2 Stoffen worden ingedeeld op grond van hun eigenschappen. Er zijn niet-ontleedbare stoffen en ontleedbare stoffen. De niet-ontleedbare stoffen zijn verdeeld
4. Van twee stoffen is hieronder de structuurformule weergegeven.
 MAVO Herexamen 1976 1. Beantwoord de volgende vragen over het element calcium. a. Hoeveel protonen bevat een atoom van dit element? Licht het antwoord toe. b. Hoe zijn de elektronen over de schillen verdeeld?
MAVO Herexamen 1976 1. Beantwoord de volgende vragen over het element calcium. a. Hoeveel protonen bevat een atoom van dit element? Licht het antwoord toe. b. Hoe zijn de elektronen over de schillen verdeeld?
Stoffen, structuur en bindingen
 Hoofdstuk 1: Stoffen, structuur en bindingen Scheikunde vwo 2011/2012 www.lyceo.nl Onderwerpen Scheikunde 2011 2012 Stoffen, structuur en binding Kenmerken van Reacties Zuren en base Redox Chemische technieken
Hoofdstuk 1: Stoffen, structuur en bindingen Scheikunde vwo 2011/2012 www.lyceo.nl Onderwerpen Scheikunde 2011 2012 Stoffen, structuur en binding Kenmerken van Reacties Zuren en base Redox Chemische technieken
Fosfor kan met waterstof reageren. d Geef de vergelijking van de reactie van fosfor met waterstof.
 1 Een oplossing van zwavelzuur en een oplossing van bariumhydroxide geladen beide elektriciteit. Wordt bij de zwavelzuuroplossing een oplossing van bariumhydroxide gedruppeld, dan neemt het elektrisch
1 Een oplossing van zwavelzuur en een oplossing van bariumhydroxide geladen beide elektriciteit. Wordt bij de zwavelzuuroplossing een oplossing van bariumhydroxide gedruppeld, dan neemt het elektrisch
1 Verdringingsreacties niet-metalen met lucifers
 Verdringingsreacties niet-metalen met lucifers Plaats in de leerplannen VVKSO leerplan derde graad ASO Chemie LICAP Brussel D20060279040:. Oriënteren Achtergrondinformatie Herhaal de begrippen oxidator-
Verdringingsreacties niet-metalen met lucifers Plaats in de leerplannen VVKSO leerplan derde graad ASO Chemie LICAP Brussel D20060279040:. Oriënteren Achtergrondinformatie Herhaal de begrippen oxidator-
ZUIVERE STOF één stof, gekenmerkt door welbepaalde fysische constanten zoals kooktemperatuur, massadichtheid,.
 PARATE KENNIS CHEMIE 4 e JAAR SCHEMA ZUIVERE STOF één stof, gekenmerkt door welbepaalde fysische constanten zoals kooktemperatuur, massadichtheid,. MENGSEL bestaat uit meerdere zuivere stoffen, de kooktemperatuur,
PARATE KENNIS CHEMIE 4 e JAAR SCHEMA ZUIVERE STOF één stof, gekenmerkt door welbepaalde fysische constanten zoals kooktemperatuur, massadichtheid,. MENGSEL bestaat uit meerdere zuivere stoffen, de kooktemperatuur,
CCVS-tentamen 16 mei 2014 - Uitwerking
 CCVStentamen 16 mei 2014 Uitwerking door Frank Povel NB. De puntentoekenning is door mij gedaan op grond van de totalen per opgave zoals weergegeven op bij het tentamen behorende voorblad. OPGAVE 1 koper
CCVStentamen 16 mei 2014 Uitwerking door Frank Povel NB. De puntentoekenning is door mij gedaan op grond van de totalen per opgave zoals weergegeven op bij het tentamen behorende voorblad. OPGAVE 1 koper
NATIONALE SCHEIKUNDEOLYMPIADE
 NATIONALE SCHEIKUNDEOLYMPIADE CORRECTIEMODEL VOORRONDE af te nemen in de periode van januari tot en met 5 februari 04 Deze voorronde bestaat uit 0 meerkeuzevragen verdeeld over 8 onderwerpen en open opgaven
NATIONALE SCHEIKUNDEOLYMPIADE CORRECTIEMODEL VOORRONDE af te nemen in de periode van januari tot en met 5 februari 04 Deze voorronde bestaat uit 0 meerkeuzevragen verdeeld over 8 onderwerpen en open opgaven
Elektrochemie voor VWO
 Elektrochemie voor VWO 0. Inleiding Wanneer scheikundige processen gepaard gaan met elektrische verschijnselen zoals elektrische spanning en elektrische stroom wordt dit aangeduid met de algemene term
Elektrochemie voor VWO 0. Inleiding Wanneer scheikundige processen gepaard gaan met elektrische verschijnselen zoals elektrische spanning en elektrische stroom wordt dit aangeduid met de algemene term
Heavy metal. CC Naamsvermelding 3.0 Nederland licentie.
 Auteur Laatst gewijzigd Licentie Webadres Dick Naafs 11 February 2015 CC Naamsvermelding 3.0 Nederland licentie http://maken.wikiwijs.nl/57859 Dit lesmateriaal is gemaakt met Wikiwijs Maken van Kennisnet.
Auteur Laatst gewijzigd Licentie Webadres Dick Naafs 11 February 2015 CC Naamsvermelding 3.0 Nederland licentie http://maken.wikiwijs.nl/57859 Dit lesmateriaal is gemaakt met Wikiwijs Maken van Kennisnet.
Sk-13 Redoxreacties. Jan Lutgerink ; Dick Naafs. CC Naamsvermelding-GelijkDelen 3.0 Nederland licentie.
 Auteurs Laatst gewijzigd Licentie Webadres Jan Lutgerink ; Dick Naafs 03 februari 2016 CC Naamsvermelding-GelijkDelen 3.0 Nederland licentie https://maken.wikiwijs.nl/45855 Dit lesmateriaal is gemaakt
Auteurs Laatst gewijzigd Licentie Webadres Jan Lutgerink ; Dick Naafs 03 februari 2016 CC Naamsvermelding-GelijkDelen 3.0 Nederland licentie https://maken.wikiwijs.nl/45855 Dit lesmateriaal is gemaakt
Stabilisator voor PVC
 Stabilisator voor PVC 1 maximumscore 2 Voorbeelden van een juist antwoord zijn: Als chlooretheen polymeriseert ontstaan lange ketens zonder dwarsverbindingen. De ketens kunnen langs elkaar bewegen (bij
Stabilisator voor PVC 1 maximumscore 2 Voorbeelden van een juist antwoord zijn: Als chlooretheen polymeriseert ontstaan lange ketens zonder dwarsverbindingen. De ketens kunnen langs elkaar bewegen (bij
UITWERKING CCVS-TENTAMEN 16 mei 2014 Frank Povel
 UITWERKING CCVSTENTAMEN 16 mei 2014 Frank Povel NB. Deze uitwerking is door mij gemaakt en is niet de uitwerking die de CCVS hanteert. Er kunnen dan ook op geen enkele wijze rechten aan deze uitwerking
UITWERKING CCVSTENTAMEN 16 mei 2014 Frank Povel NB. Deze uitwerking is door mij gemaakt en is niet de uitwerking die de CCVS hanteert. Er kunnen dan ook op geen enkele wijze rechten aan deze uitwerking
OEFENOPGAVEN MOLBEREKENINGEN
 OEFENOPGAVEN MOLBEREKENINGEN * = voor VWO Salmiak, NH 4 Cl(s), kan gemaakt worden door waterstofchloride, HCl(g), te laten reageren met ammoniak, NH 3 (g) 01 Wat is de chemische naam voor salmiak? 02 Geef
OEFENOPGAVEN MOLBEREKENINGEN * = voor VWO Salmiak, NH 4 Cl(s), kan gemaakt worden door waterstofchloride, HCl(g), te laten reageren met ammoniak, NH 3 (g) 01 Wat is de chemische naam voor salmiak? 02 Geef
Sk-13 redoxreacties. Jan Lutgerink; Dick Naafs. CC Naamsvermelding-GelijkDelen 3.0 Nederland licentie.
 Auteurs Laatst gewijzigd Licentie Webadres Jan Lutgerink; Dick Naafs 04 october 2018 CC Naamsvermelding-GelijkDelen 3.0 Nederland licentie https://maken.wikiwijs.nl/45855 Dit lesmateriaal is gemaakt met
Auteurs Laatst gewijzigd Licentie Webadres Jan Lutgerink; Dick Naafs 04 october 2018 CC Naamsvermelding-GelijkDelen 3.0 Nederland licentie https://maken.wikiwijs.nl/45855 Dit lesmateriaal is gemaakt met
Eindexamen scheikunde havo 2007-II
 Beoordelingsmodel Kwik 1 maximumscore 2 aantal protonen: 160 aantal elektronen: 158 aantal protonen: 160 1 aantal elektronen: het gegeven aantal protonen verminderd met 2 1 2 maximumscore 2 g 2 Cl 2 Indien
Beoordelingsmodel Kwik 1 maximumscore 2 aantal protonen: 160 aantal elektronen: 158 aantal protonen: 160 1 aantal elektronen: het gegeven aantal protonen verminderd met 2 1 2 maximumscore 2 g 2 Cl 2 Indien
Overzicht van reactievergelijkingen Scheikunde
 verzicht van reactievergelijkingen Scheikunde Algemeen Verbranding Een verbranding is een reactie met zuurstof. ierbij ontstaan de oxiden van de elementen. Volledige verbranding Bij volledige verbranding
verzicht van reactievergelijkingen Scheikunde Algemeen Verbranding Een verbranding is een reactie met zuurstof. ierbij ontstaan de oxiden van de elementen. Volledige verbranding Bij volledige verbranding
Rekenen aan reacties (de mol)
 Rekenen aan reacties (de mol) 1. Reactievergelijkingen oefenen: Scheikunde Deze opgaven zijn bedoeld voor diegenen die moeite hebben met rekenen aan reacties 1. Reactievergelijkingen http://www.nassau-sg.nl/scheikunde/tutorials/deeltjes/deeltjes.html
Rekenen aan reacties (de mol) 1. Reactievergelijkingen oefenen: Scheikunde Deze opgaven zijn bedoeld voor diegenen die moeite hebben met rekenen aan reacties 1. Reactievergelijkingen http://www.nassau-sg.nl/scheikunde/tutorials/deeltjes/deeltjes.html
7. Chemische reacties
 7. Chemische reacties 1. Definitie Bij een chemische reactie verdwijnen één of meer stoffen en ontstaan één of meer nieuwe stoffen. De stoffen die verdwijnen noemen we de uitgangsstoffen of reagentia.
7. Chemische reacties 1. Definitie Bij een chemische reactie verdwijnen één of meer stoffen en ontstaan één of meer nieuwe stoffen. De stoffen die verdwijnen noemen we de uitgangsstoffen of reagentia.
Hieronder zie je een schema van een eenvoudige chemische cel met koper/zink elektroden. Bestudeer dit schema met aandacht:
 Cursus Chemie 7-1 Hoofdstuk 7 : INDIREKTE REDOXREACTIES (met elektrodes) Naast de directe zijn er ook indirecte redoxreacties. Dat wil zeggen: er is geen direct contact tussen de deeltjes van de oxidator
Cursus Chemie 7-1 Hoofdstuk 7 : INDIREKTE REDOXREACTIES (met elektrodes) Naast de directe zijn er ook indirecte redoxreacties. Dat wil zeggen: er is geen direct contact tussen de deeltjes van de oxidator
Dit examen bestaat voor iedere kandidaat uit 20 vragen
 MAVO-4 II EXAMEN MIDDELBAAR ALGEMEEN VOORTGEZET ONDERWIJS IN 1982 MAVO-4 Woensdag 15 juni, 9.00 11.00 NATUUR-EN SCHEIKUNDE II (Scheikunde) MEERKEUZETOETS Dit examen bestaat voor iedere kandidaat uit 20
MAVO-4 II EXAMEN MIDDELBAAR ALGEMEEN VOORTGEZET ONDERWIJS IN 1982 MAVO-4 Woensdag 15 juni, 9.00 11.00 NATUUR-EN SCHEIKUNDE II (Scheikunde) MEERKEUZETOETS Dit examen bestaat voor iedere kandidaat uit 20
Elektrochemie (versie 18-5-2015) Inhoud
 Elektrochemie (versie 18-5-2015) Je kunt bij een onderwerp komen door op de gewenste rubriek in de inhoud te klikken. Wil je vanuit een rubriek terug naar de inhoud, klik dan op de tekst van de rubriek
Elektrochemie (versie 18-5-2015) Je kunt bij een onderwerp komen door op de gewenste rubriek in de inhoud te klikken. Wil je vanuit een rubriek terug naar de inhoud, klik dan op de tekst van de rubriek
Elektrochemie (versie 18-5-2015) Inhoud
 Elektrochemie (versie 18-5-2015) Je kunt bij een onderwerp komen door op de gewenste rubriek in de inhoud te klikken. Wil je vanuit een rubriek terug naar de inhoud, klik dan op de tekst van de rubriek
Elektrochemie (versie 18-5-2015) Je kunt bij een onderwerp komen door op de gewenste rubriek in de inhoud te klikken. Wil je vanuit een rubriek terug naar de inhoud, klik dan op de tekst van de rubriek
1. Elementaire chemie en chemisch rekenen
 In onderstaande zelftest zijn de vragen gebundeld die als voorbeeldvragen zijn opgenomen in het bijhorend overzicht van de verwachte voorkennis chemie. 1. Elementaire chemie en chemisch rekenen 1.1 Grootheden
In onderstaande zelftest zijn de vragen gebundeld die als voorbeeldvragen zijn opgenomen in het bijhorend overzicht van de verwachte voorkennis chemie. 1. Elementaire chemie en chemisch rekenen 1.1 Grootheden
Basisscheikunde voor het hbo ISBN e druk Uitgeverij Syntax media
 Hoofdstuk 5 Chemische reacties bladzijde 1 Opgave 1 Maak de volgende reactievergelijkingen kloppend: a C 3H 8O 2 4 O 2 3 CO 2 4 H 2O b P 4 5 O 2 6 H 2O 4 H 3PO 4 c 4 Al 3 O 2 2 Al 2O 3 d 2 Fe 3 Cl 2 2
Hoofdstuk 5 Chemische reacties bladzijde 1 Opgave 1 Maak de volgende reactievergelijkingen kloppend: a C 3H 8O 2 4 O 2 3 CO 2 4 H 2O b P 4 5 O 2 6 H 2O 4 H 3PO 4 c 4 Al 3 O 2 2 Al 2O 3 d 2 Fe 3 Cl 2 2
OEFENOPGAVEN VWO EVENWICHTEN
 OPGAVE 1 OEFENOPGAVEN VWO EVENWICHTEN In een ruimte van 5,00 liter brengt men 9,50 mol HCl(g) en 2,60 mol O 2 (g). Na evenwichtsinstelling is 40,0% van de beginstoffen omgezet en is er Cl 2 (g) en H 2
OPGAVE 1 OEFENOPGAVEN VWO EVENWICHTEN In een ruimte van 5,00 liter brengt men 9,50 mol HCl(g) en 2,60 mol O 2 (g). Na evenwichtsinstelling is 40,0% van de beginstoffen omgezet en is er Cl 2 (g) en H 2
Uitwerkingen Basischemie hoofdstuk 2
 Uitwerkingen Basischemie hoofdstuk 2 Opgave 2.1 Opgave 2.2 Elementen leren Maak met de afbeeldingen 2.1A en 2.1B kaartjes met aan de ene kant de naam van het element en aan de andere kant het symbool en
Uitwerkingen Basischemie hoofdstuk 2 Opgave 2.1 Opgave 2.2 Elementen leren Maak met de afbeeldingen 2.1A en 2.1B kaartjes met aan de ene kant de naam van het element en aan de andere kant het symbool en
Oefenopgaven TITRATIES
 Oefenopgaven TITRATIES vwo ZUURBASE-TITRATIES OPGAVE 1 Tijdens een titratie wordt 10,00 ml 3,00 10-4 M zwavelzuur getitreerd met natronloog van onbekende molariteit. Er is 21,83 ml natronloog nodig om
Oefenopgaven TITRATIES vwo ZUURBASE-TITRATIES OPGAVE 1 Tijdens een titratie wordt 10,00 ml 3,00 10-4 M zwavelzuur getitreerd met natronloog van onbekende molariteit. Er is 21,83 ml natronloog nodig om
Atoommodel van Rutherford
 Samenvatting scheikunde havo 4 hoofdstuk 2 bouwstenen van stoffen 2.2 de bouw van een atoom Atoommodel val Een atoom is een massief bolletje. Elk atoomsoort heeft zijn eigen Dalton afmetingen Ook gaf hij
Samenvatting scheikunde havo 4 hoofdstuk 2 bouwstenen van stoffen 2.2 de bouw van een atoom Atoommodel val Een atoom is een massief bolletje. Elk atoomsoort heeft zijn eigen Dalton afmetingen Ook gaf hij
ßCalciumChloride oplossing
 Samenvatting door R. 1673 woorden 17 februari 2013 8 1 keer beoordeeld Vak Methode Scheikunde Pulsar chemie Additiereactie Bij een reactie tussen hexeen en broom springt de C=C binding open. Aan het molecuul
Samenvatting door R. 1673 woorden 17 februari 2013 8 1 keer beoordeeld Vak Methode Scheikunde Pulsar chemie Additiereactie Bij een reactie tussen hexeen en broom springt de C=C binding open. Aan het molecuul
Opgave 1. n = m / M. e 500 mg soda (Na 2CO 3) = 0,00472 mol. Opgave 2. m = n x M
 Hoofdstuk 8 Rekenen met de mol bladzijde 1 Opgave 1 n = m / M a 64,0 g zuurstofgas (O 2) = 2,00 mol (want n = 64,0 / 32,0) enz b 10,0 g butaan (C 4H 10) = 0,172 mol c 1,00 g suiker (C 12H 22O 11) = 0,00292
Hoofdstuk 8 Rekenen met de mol bladzijde 1 Opgave 1 n = m / M a 64,0 g zuurstofgas (O 2) = 2,00 mol (want n = 64,0 / 32,0) enz b 10,0 g butaan (C 4H 10) = 0,172 mol c 1,00 g suiker (C 12H 22O 11) = 0,00292
1. Elementaire chemie en chemisch rekenen
 In onderstaande zelftest zijn de vragen gebundeld die als voorbeeldvragen zijn opgenomen in het bijhorend overzicht van de verwachte voorkennis chemie. 1. Elementaire chemie en chemisch rekenen 1.1 Grootheden
In onderstaande zelftest zijn de vragen gebundeld die als voorbeeldvragen zijn opgenomen in het bijhorend overzicht van de verwachte voorkennis chemie. 1. Elementaire chemie en chemisch rekenen 1.1 Grootheden
!"#$%&#'()')##'*#'"#)#"'
 !"#$%&#'()')##'*#'"#)#"' Een module over batterijen. Onderstaande artikelen zijn van internet geplukt. Pagina 1 van 14 Pagina 2 van 14 Ook Wubbo Ockels neemt graag zijn eigen energie mee in de boot Ecolution
!"#$%&#'()')##'*#'"#)#"' Een module over batterijen. Onderstaande artikelen zijn van internet geplukt. Pagina 1 van 14 Pagina 2 van 14 Ook Wubbo Ockels neemt graag zijn eigen energie mee in de boot Ecolution
Hoofdstuk 6: Zure en base oplossingen / ph
 Hoofdstuk 6: Zure en base oplossingen / ph 6.1 Herhaling: zure en basische oplossingen Arrhenius definieerde zuren als volgt: zuren zijn polaire covalente verbindingen die bij het oplossen in water H +
Hoofdstuk 6: Zure en base oplossingen / ph 6.1 Herhaling: zure en basische oplossingen Arrhenius definieerde zuren als volgt: zuren zijn polaire covalente verbindingen die bij het oplossen in water H +
Je kunt de ph van een oplossing meten met een ph-meter, met universeelindicatorpapier of met behulp van zuur-base-indicatoren.
 Boekverslag door Merel 797 woorden 22 januari 2017 6.9 14 keer beoordeeld Vak Methode Scheikunde Chemie overal Zie de bijlage voor de grafiek en alle tabellen. H8 Zuren en en Basen Chemie Overal 8.2 De
Boekverslag door Merel 797 woorden 22 januari 2017 6.9 14 keer beoordeeld Vak Methode Scheikunde Chemie overal Zie de bijlage voor de grafiek en alle tabellen. H8 Zuren en en Basen Chemie Overal 8.2 De
Eindexamen scheikunde havo 2002-II
 4 Antwoordmodel Zuurstofvoorziening 1 aantal protonen: 16 aantal elektronen: 17 aantal protonen: 16 1 aantal elektronen: aantal protonen vermeerderd met 1 1 2 4 KO 2 2 K 2 O + 3 O 2 alleen KO 2 voor de
4 Antwoordmodel Zuurstofvoorziening 1 aantal protonen: 16 aantal elektronen: 17 aantal protonen: 16 1 aantal elektronen: aantal protonen vermeerderd met 1 1 2 4 KO 2 2 K 2 O + 3 O 2 alleen KO 2 voor de
Voorbereiding toelatingsexamen arts/tandarts
 Voorbereiding toelatingsexamen arts/tandarts Oplossingen van 2018 Tandarts Geel 21 juli 2018 Brenda Casteleyn, PhD Vraag 1 De samenstelling van een oplossing wordt in volgende tabel weergegeven: Ionsoort
Voorbereiding toelatingsexamen arts/tandarts Oplossingen van 2018 Tandarts Geel 21 juli 2018 Brenda Casteleyn, PhD Vraag 1 De samenstelling van een oplossing wordt in volgende tabel weergegeven: Ionsoort
7.0 Enkele belangrijke groepen van verbindingen
 7.0 Enkele belangrijke groepen van verbindingen 7.1 Oxiden Vrijwel alle elementen kunnen, min of meer heftig reageren met zuurstof. De gevormde verbindingen worden oxiden genoemd. In een van de voorafgaande
7.0 Enkele belangrijke groepen van verbindingen 7.1 Oxiden Vrijwel alle elementen kunnen, min of meer heftig reageren met zuurstof. De gevormde verbindingen worden oxiden genoemd. In een van de voorafgaande
Eindexamen scheikunde havo 2008-II
 Beoordelingsmodel Forams 1 maximumscore 2 aantal protonen: 14 aantal neutronen: 16 aantal protonen: 14 1 aantal neutronen: 30 verminderd met het aantal protonen 1 Indien het juiste aantal protonen (7)
Beoordelingsmodel Forams 1 maximumscore 2 aantal protonen: 14 aantal neutronen: 16 aantal protonen: 14 1 aantal neutronen: 30 verminderd met het aantal protonen 1 Indien het juiste aantal protonen (7)
OEFENTOETS Zuren en basen 5 VWO
 OEFENTOETS Zuren en basen 5 VWO Gesloten vragen 1. Carolien wil de zuurgraad van een oplossing onderzoeken met twee verschillende zuur-baseindicatoren en neemt hierbij het volgende waar: I de oplossing
OEFENTOETS Zuren en basen 5 VWO Gesloten vragen 1. Carolien wil de zuurgraad van een oplossing onderzoeken met twee verschillende zuur-baseindicatoren en neemt hierbij het volgende waar: I de oplossing
Deze Informatie is gratis en mag op geen enkele wijze tegen betaling aangeboden worden
 Vraag 1 Welke van volgende formules stemt overeen met magnesiumchloriet? MgCl Mg(ClO 2 ) 2 Mg(ClO 3 ) 2 Mg3(ClO 3 ) 2 Optie A: Hier is wat kennis over het periodiek systeem der elementen
Vraag 1 Welke van volgende formules stemt overeen met magnesiumchloriet? MgCl Mg(ClO 2 ) 2 Mg(ClO 3 ) 2 Mg3(ClO 3 ) 2 Optie A: Hier is wat kennis over het periodiek systeem der elementen
Dit examen bestaat voor iedere kandidaat uit 20 vragen
 MV0-3 EXMEN MELR LGEMEEN VOORTGEZET ONERWJS N 1982 MV0-3 onderdag 6 mei, 9.00-11.00 uur NTUUR- EN SHEKUNE (Scheikunde) MEERKEUZETOETS it examen bestaat voor iedere kandidaat uit 20 vragen ij het examen
MV0-3 EXMEN MELR LGEMEEN VOORTGEZET ONERWJS N 1982 MV0-3 onderdag 6 mei, 9.00-11.00 uur NTUUR- EN SHEKUNE (Scheikunde) MEERKEUZETOETS it examen bestaat voor iedere kandidaat uit 20 vragen ij het examen
4. In een bakje met natriumjodide-oplossing worden 2 loden elektroden gehangen. Deze twee elektroden worden aangesloten op een batterij.
 Test Scheikunde Havo 5 Periode 1 Geef voor de volgende redoxreacties de halfreacties: a Mg + S MgS b Na + Cl NaCl c Zn + O ZnO Geef de halfreacties en de reactievergelijking voor de volgende redoxreacties:
Test Scheikunde Havo 5 Periode 1 Geef voor de volgende redoxreacties de halfreacties: a Mg + S MgS b Na + Cl NaCl c Zn + O ZnO Geef de halfreacties en de reactievergelijking voor de volgende redoxreacties:
gelijk aan het aantal protonen in de kern. hebben allemaal hetzelfde aantal protonen in de kern.
 1 Atoombouw 1.1 Atoomnummer en massagetal Er bestaan vele miljoenen verschillende stoffen, die allemaal zijn opgebouwd uit ongeveer 100 verschillende atomen. Deze atomen zijn zelf ook weer opgebouwd uit
1 Atoombouw 1.1 Atoomnummer en massagetal Er bestaan vele miljoenen verschillende stoffen, die allemaal zijn opgebouwd uit ongeveer 100 verschillende atomen. Deze atomen zijn zelf ook weer opgebouwd uit
ZUREN EN BASEN. Samenvatting voor het VWO. versie mei 2013
 ZUREN EN BASEN Samenvatting voor het VWO versie mei 2013 INHOUDSOPGAVE 1. Vooraf 2. Algemeen 3. Zuren 4. Basen 5. Het waterevenwicht 6. Definities ph en poh 7. ph BEREKENINGEN 7.1. Algemeen 7.2. Water
ZUREN EN BASEN Samenvatting voor het VWO versie mei 2013 INHOUDSOPGAVE 1. Vooraf 2. Algemeen 3. Zuren 4. Basen 5. Het waterevenwicht 6. Definities ph en poh 7. ph BEREKENINGEN 7.1. Algemeen 7.2. Water
Niet-metalen + metalen. Uit welk soort atomen is een ionbinding opgebouwd? Geef de chemische formule van gedemineraliseerd water.
 Uit welk soort atomen is een ionbinding opgebouwd? Niet-metalen + metalen. Geef de chemische formule van gedemineraliseerd water. H2O. Wat is de structuur van een metaalbinding? Metaalrooster. Geef een
Uit welk soort atomen is een ionbinding opgebouwd? Niet-metalen + metalen. Geef de chemische formule van gedemineraliseerd water. H2O. Wat is de structuur van een metaalbinding? Metaalrooster. Geef een
Zelfstudiepakket Leerkracht (Correctiesleutel) Industrieel Ingenieur Chemie, Biochemie, Milieukunde
 @ KORTRIJK Zelfstudiepakket Leerkracht (Correctiesleutel) REDOX Industrieel Ingenieur Chemie, Biochemie, Milieukunde Graaf Karel de Goedelaan 5-8500 Kortrijk Info.Kortrijk@UGent.be Voorwoord Dit zelfstudiepakket
@ KORTRIJK Zelfstudiepakket Leerkracht (Correctiesleutel) REDOX Industrieel Ingenieur Chemie, Biochemie, Milieukunde Graaf Karel de Goedelaan 5-8500 Kortrijk Info.Kortrijk@UGent.be Voorwoord Dit zelfstudiepakket
Oefenvraagstukken 5 VWO Hoofdstuk 11. Opgave 1 [HCO ] [H O ] x x. = 4,5 10 [CO ] 1,00 x 10
![Oefenvraagstukken 5 VWO Hoofdstuk 11. Opgave 1 [HCO ] [H O ] x x. = 4,5 10 [CO ] 1,00 x 10 Oefenvraagstukken 5 VWO Hoofdstuk 11. Opgave 1 [HCO ] [H O ] x x. = 4,5 10 [CO ] 1,00 x 10](/thumbs/19/200750.jpg) Oefenvraagstukken 5 VWO Hoofdstuk 11 Zuren en basen Opgave 1 1 Ga na of de volgende zuren en basen met elkaar kunnen reageren. Zo ja, geef de reactievergelijking. Zo nee, leg duidelijk uit waarom niet.
Oefenvraagstukken 5 VWO Hoofdstuk 11 Zuren en basen Opgave 1 1 Ga na of de volgende zuren en basen met elkaar kunnen reageren. Zo ja, geef de reactievergelijking. Zo nee, leg duidelijk uit waarom niet.
1. Elementaire chemie en chemisch rekenen
 In onderstaande zelftest zijn de vragen gebundeld die als voorbeeldvragen zijn opgenomen in het bijhorend overzicht van de verwachte voorkennis chemie. 1. Elementaire chemie en chemisch rekenen 1.1 Grootheden
In onderstaande zelftest zijn de vragen gebundeld die als voorbeeldvragen zijn opgenomen in het bijhorend overzicht van de verwachte voorkennis chemie. 1. Elementaire chemie en chemisch rekenen 1.1 Grootheden
Samenvatting Scheikunde Hoofdstuk 9, 10, 11 Zuren/Basen, Evenwichtsconstanten
 Samenvatting Scheikunde Hoofdstuk 9, 10, 11 Zuren/Basen, Evenwichtsconstanten Samenvatting door een scholier 1087 woorden 22 januari 2009 6 42 keer beoordeeld Vak Methode Scheikunde Pulsar chemie Scheikunde
Samenvatting Scheikunde Hoofdstuk 9, 10, 11 Zuren/Basen, Evenwichtsconstanten Samenvatting door een scholier 1087 woorden 22 januari 2009 6 42 keer beoordeeld Vak Methode Scheikunde Pulsar chemie Scheikunde
Eindexamen havo scheikunde II
 Radon 1 maximumscore 1 edelgassen 2 maximumscore 1 2+ Indien het antwoord positieve lading is gegeven 0 3 maximumscore 3 aantal protonen: 84 aantal neutronen: 134 naam element X: polonium aantal protonen:
Radon 1 maximumscore 1 edelgassen 2 maximumscore 1 2+ Indien het antwoord positieve lading is gegeven 0 3 maximumscore 3 aantal protonen: 84 aantal neutronen: 134 naam element X: polonium aantal protonen:
Eindexamen scheikunde havo 2006-II
 4 Beoordelingsmodel Element 115 1 Calcium heeft atoomnummer 20 en americium heeft atoomnummer 95. Dus samen hebben ze 115 protonen. calcium heeft atoomnummer 20 en americium heeft atoomnummer 95 1 2 Een
4 Beoordelingsmodel Element 115 1 Calcium heeft atoomnummer 20 en americium heeft atoomnummer 95. Dus samen hebben ze 115 protonen. calcium heeft atoomnummer 20 en americium heeft atoomnummer 95 1 2 Een
Eindexamen scheikunde havo 2008-I
 Beoordelingsmodel Uraan 1 maximumscore 2 aantal protonen: 92 aantal neutronen: 146 aantal protonen: 92 1 aantal neutronen: 238 verminderen met het aantal protonen 1 2 maximumscore 2 UO 2 + 4 HF UF 4 +
Beoordelingsmodel Uraan 1 maximumscore 2 aantal protonen: 92 aantal neutronen: 146 aantal protonen: 92 1 aantal neutronen: 238 verminderen met het aantal protonen 1 2 maximumscore 2 UO 2 + 4 HF UF 4 +
Oefenvragen Hoofdstuk 7 Een indeling van stoffen. moleculaire stoffen zouten metalen
 Oefenvragen oofdstuk 7 Een indeling van stoffen Vraag 1 Kruis bij de onderstaande stoffen de juiste groep aan. NaCl C612O6 CO2 Pb Fe Cl2 KNO3 CaBr2 moleculaire stoffen zouten metalen Vraag 2 Maak de volgende
Oefenvragen oofdstuk 7 Een indeling van stoffen Vraag 1 Kruis bij de onderstaande stoffen de juiste groep aan. NaCl C612O6 CO2 Pb Fe Cl2 KNO3 CaBr2 moleculaire stoffen zouten metalen Vraag 2 Maak de volgende
1) Stoffen, moleculen en atomen
 Herhaling leerstof klas 3 1) Stoffen, moleculen en atomen Scheikundigen houden zich bezig met stoffen. Betekenissen van stof zijn onder andere: - Het materiaal waar kleding van gemaakt is; - Fijne vuildeeltjes;
Herhaling leerstof klas 3 1) Stoffen, moleculen en atomen Scheikundigen houden zich bezig met stoffen. Betekenissen van stof zijn onder andere: - Het materiaal waar kleding van gemaakt is; - Fijne vuildeeltjes;
Frank Povel. a1. De twee factoren zijn: 1. er moeten geladen deeltjes zijn; 2. de geladen deeltjes moeten zich kunnen verplaatsen.
 UITWERKING CCVS-TENTAMEN 26 november 2014 Frank Povel NB. Deze uitwerking is door mij gemaakt en is niet de uitwerking die de CCVS hanteert. Er kunnen dan ook op geen enkele wijze rechten aan deze uitwerking
UITWERKING CCVS-TENTAMEN 26 november 2014 Frank Povel NB. Deze uitwerking is door mij gemaakt en is niet de uitwerking die de CCVS hanteert. Er kunnen dan ook op geen enkele wijze rechten aan deze uitwerking
Eindexamen scheikunde 1-2 vwo 2004-I
 Eindexamen scheikunde 1- vwo 004-I 4 Beoordelingsmodel Haarkleuring 1 Het juiste antwoord kan als volgt zijn genoteerd: H N CH C en H N CH C CH CH structuurformule van serine juist 1 structuurformule van
Eindexamen scheikunde 1- vwo 004-I 4 Beoordelingsmodel Haarkleuring 1 Het juiste antwoord kan als volgt zijn genoteerd: H N CH C en H N CH C CH CH structuurformule van serine juist 1 structuurformule van
Eindexamen scheikunde 1-2 vwo 2007-II
 Beoordelingsmodel EcoEthanol TM 1 maximumscore 2 Voorbeelden van juiste argumenten zijn: Er komt minder broeikasgas / de toename van het CO 2 gehalte in de atmosfeer wordt minder / het gaat de opwarming
Beoordelingsmodel EcoEthanol TM 1 maximumscore 2 Voorbeelden van juiste argumenten zijn: Er komt minder broeikasgas / de toename van het CO 2 gehalte in de atmosfeer wordt minder / het gaat de opwarming
Het smelten van tin is géén reactie.
 3 Reacties Reacties herkennen (3.1 en 3.2 ) Een chemische reactie is een gebeurtenis waarbij stoffen verdwijnen en nieuwe stoffen ontstaan. Bij een reactie verdwijnen de beginstoffen. Er ontstaan nieuwe
3 Reacties Reacties herkennen (3.1 en 3.2 ) Een chemische reactie is een gebeurtenis waarbij stoffen verdwijnen en nieuwe stoffen ontstaan. Bij een reactie verdwijnen de beginstoffen. Er ontstaan nieuwe
Eindexamen scheikunde havo 2001-II
 Eindexamen scheikunde havo 00-II 4 Antwoordmodel Energievoorziening in de ruimte et (uiteenvallen van de Pu-38 atomen) levert energie dus het is een exotherm proces. er komt energie vrij aantal protonen:
Eindexamen scheikunde havo 00-II 4 Antwoordmodel Energievoorziening in de ruimte et (uiteenvallen van de Pu-38 atomen) levert energie dus het is een exotherm proces. er komt energie vrij aantal protonen:
SCHEIKUNDEOLYMPIADE 2018
 SCHEIKUNDEOLYMPIADE 018 CORRECTIEMODEL VOORRONDE 1 af te nemen in de periode van 15 tot en met 7 januari 018 Deze voorronde bestaat uit 0 meerkeuzevragen verdeeld over 8 onderwerpen en opgaven met in totaal
SCHEIKUNDEOLYMPIADE 018 CORRECTIEMODEL VOORRONDE 1 af te nemen in de periode van 15 tot en met 7 januari 018 Deze voorronde bestaat uit 0 meerkeuzevragen verdeeld over 8 onderwerpen en opgaven met in totaal
Curie Hoofdstuk 6 HAVO 4
 Rekenen aan reacties Curie Hoofdstuk 6 HAVO 4 6.1 Rekenen met de mol 6.2 Rekenen met massa s 6.3 Concentratie 6.4 SPA en Stappenplan 6.1 Rekenen met de mol Eenheden en grootheden 1d dozijn potloden 12
Rekenen aan reacties Curie Hoofdstuk 6 HAVO 4 6.1 Rekenen met de mol 6.2 Rekenen met massa s 6.3 Concentratie 6.4 SPA en Stappenplan 6.1 Rekenen met de mol Eenheden en grootheden 1d dozijn potloden 12
Hoofdstuk 8. Opgave 2. Opgave 1. Oefenvragen scheikunde, hoofdstuk 8 en 10, 5 VWO,
 Oefenvragen scheikunde, hoofdstuk 8 en 10, 5 VWO, Hoofdstuk 8 Opgave 1 Bruistabletten bevatten onder andere natriumwaterstofcarbonaat. Als je deze tabletten in water brengt, treedt een reactie op waarbij
Oefenvragen scheikunde, hoofdstuk 8 en 10, 5 VWO, Hoofdstuk 8 Opgave 1 Bruistabletten bevatten onder andere natriumwaterstofcarbonaat. Als je deze tabletten in water brengt, treedt een reactie op waarbij
NATIONALE SCHEIKUNDEOLYMPIADE
 NATIONALE SCHEIKUNDEOLYMPIADE CORRECTIEMODEL VOORRONDE 1 af te nemen in de periode van 28 januari tot en met 4 februari 2015 Deze voorronde bestaat uit 20 meerkeuzevragen verdeeld over 8 onderwerpen en
NATIONALE SCHEIKUNDEOLYMPIADE CORRECTIEMODEL VOORRONDE 1 af te nemen in de periode van 28 januari tot en met 4 februari 2015 Deze voorronde bestaat uit 20 meerkeuzevragen verdeeld over 8 onderwerpen en
Samenvatting Scheikunde H3 Reacties
 Samenvatting Scheikunde H3 Reacties Samenvatting door L. 710 woorden 7 december 2016 6,8 24 keer beoordeeld Vak Methode Scheikunde Chemie overal Scheikunde Hoofdstuk 3: Reacties 3.2 Kenmerken van een chemische
Samenvatting Scheikunde H3 Reacties Samenvatting door L. 710 woorden 7 december 2016 6,8 24 keer beoordeeld Vak Methode Scheikunde Chemie overal Scheikunde Hoofdstuk 3: Reacties 3.2 Kenmerken van een chemische
Eindexamen scheikunde havo 2001-I
 Eindexamen scheikunde havo -I 4 Antwoordmodel Nieuw element (in de tekst staat:) deze atomen zijn eerst ontdaan van een aantal elektronen dus de nikkeldeeltjes zijn positief geladen Indien in een overigens
Eindexamen scheikunde havo -I 4 Antwoordmodel Nieuw element (in de tekst staat:) deze atomen zijn eerst ontdaan van een aantal elektronen dus de nikkeldeeltjes zijn positief geladen Indien in een overigens
Hoofdstuk 3-5. Reacties. Klas
 Hoofdstuk 3-5 Reacties Klas 3 MOLECUULFORMULES OPDRACHT 1: MOLECUULFORMULES LEVEL 1 A H 2O C 2H 6 C C 2H 6O D CO 2 E F C 4H 8O CHN OPDRACHT 2: MOLECUULFORMULES LEVEL 1 A HNO C 3H 6O C C 2H 2 D C 6H 5NO
Hoofdstuk 3-5 Reacties Klas 3 MOLECUULFORMULES OPDRACHT 1: MOLECUULFORMULES LEVEL 1 A H 2O C 2H 6 C C 2H 6O D CO 2 E F C 4H 8O CHN OPDRACHT 2: MOLECUULFORMULES LEVEL 1 A HNO C 3H 6O C C 2H 2 D C 6H 5NO
5 Water, het begrip ph
 5 Water, het begrip ph 5.1 Water Waterstofchloride is een sterk zuur, het reageert als volgt met water: HCI(g) + H 2 0(I) Cl (aq) + H 3 O + (aq) z b Hierbij reageert water als base. Ammoniak is een zwakke
5 Water, het begrip ph 5.1 Water Waterstofchloride is een sterk zuur, het reageert als volgt met water: HCI(g) + H 2 0(I) Cl (aq) + H 3 O + (aq) z b Hierbij reageert water als base. Ammoniak is een zwakke
SCHEIKUNDEOLYMPIADE 2019
 SCHEIKUNDEOLYMPIADE 019 CORRECTIEMODEL VOORRONDE 1 af te nemen in de periode van 1 tot en met 5 januari 019 Deze voorronde bestaat uit 0 meerkeuzevragen verdeeld over 8 onderwerpen en 3 opgaven met in
SCHEIKUNDEOLYMPIADE 019 CORRECTIEMODEL VOORRONDE 1 af te nemen in de periode van 1 tot en met 5 januari 019 Deze voorronde bestaat uit 0 meerkeuzevragen verdeeld over 8 onderwerpen en 3 opgaven met in
SCHEIKUNDEOLYMPIADE 2017
 SCHEIKUNDEOLYMPIADE 2017 CORRECTIEMODEL VOORRONDE 1 af te nemen in de periode van 18 tot en met 25 januari 2017 Deze voorronde bestaat uit 20 meerkeuzevragen verdeeld over 8 onderwerpen en 2 opgaven met
SCHEIKUNDEOLYMPIADE 2017 CORRECTIEMODEL VOORRONDE 1 af te nemen in de periode van 18 tot en met 25 januari 2017 Deze voorronde bestaat uit 20 meerkeuzevragen verdeeld over 8 onderwerpen en 2 opgaven met
namen formules ionogene stoffen van Als je de negatieve ionen (behalve OH - ) koppelt aan H + - ionen ontstaan verbindingen die men zuren noemt.
 namen en formules van ionogene stoffen CH 3 COO - acetaat afkomstig van azijnzuur (ethaanzuur) C 2 O 4 samengestelde ionen HC 2 O 4 - oxalaat beide afkomstig van oxaalzuur (ethaandizuur) waterstofoxalaat
namen en formules van ionogene stoffen CH 3 COO - acetaat afkomstig van azijnzuur (ethaanzuur) C 2 O 4 samengestelde ionen HC 2 O 4 - oxalaat beide afkomstig van oxaalzuur (ethaandizuur) waterstofoxalaat
Eindexamen scheikunde havo 2005-II
 4 Beoordelingsmodel Jood-129 1 aantal protonen: 53 aantal elektronen: 53 aantal protonen: 53 1 aantal elektronen: gelijk aan aantal protonen 1 2 Een voorbeeld van een juist antwoord is: Er ontstaan geen
4 Beoordelingsmodel Jood-129 1 aantal protonen: 53 aantal elektronen: 53 aantal protonen: 53 1 aantal elektronen: gelijk aan aantal protonen 1 2 Een voorbeeld van een juist antwoord is: Er ontstaan geen
