INFORMATIE VOOR DE ARTS
|
|
|
- Paula Pauwels
- 5 jaren geleden
- Aantal bezoeken:
Transcriptie
1 De Belgische gezondheidsautoriteiten hebben bepaalde voorwaarden verbonden aan het in de handel brengen van het geneesmiddel Azzalure. Het verplicht plan voor risicobeperking in België, waarvan deze informatie deel uitmaakt, is een maatregel genomen om een veilig en doeltreffend gebruik van Azzalure te waarborgen (RMA gewijzigde versie 04/2016). Azzalure (botulinetoxine type A) 10 Speywood-eenheden/0,05 ml gereconstitueerde oplossing INFORMATIE VOOR DE ARTS Dit materiaal bevat niet alle informatie. Voor de volledige informatie: lees aandachtig de SKP (in bijlage) vooraleer Azzalure voor te schrijven (en/of te gebruiken en/of af te leveren). De volledige en geactualiseerde tekst van deze SKP is beschikbaar op de website rubriek BIJSLUITER en SKP van een geneesmiddel.
2 Doel van dit materiaal (RMA of Risk Minimisation Activities) Deze informatie maakt deel uit van het Belgische risicobeheerplan, dat informatiemateriaal beschikbaar stelt aan gezondheidszorgbeoefenaars (en patiënten). Deze bijkomende risicobeperkende activiteiten hebben als doel een veilig en doeltreffend gebruik van Azzalure te waarborgen en moeten volgende belangrijke onderdelen bevatten : De informatie voor artsen over AZZALURE moet de volgende sleutelelementen bevatten : risico op oogafwijkingen, het voorkomen van verre verspreiding van het effect van het toxine, het voorkomen van neutraliserende antilichaam vorming volgend op het gebruik van Azzalure. De informatie voor patiënten over AZZALURE moet de volgende informatie bevatten: risico op oogafwijkingen, het voorkomen van verre verspreiding van het effect van het toxine, het voorkomen van neutraliserende antilichaam vorming volgend op het gebruik van Azzalure. Page 2 of 9
3 Therapeutische indicaties Azzalure is geïndiceerd voor de tijdelijke verbetering van het uiterlijk van matig ernstige tot ernstige glabellalijnen (de verticale lijntjes tussen de wenkbrauwen), die bij het fronsen van het voorhoofd te zien zijn, bij volwassen patiënten jonger dan 65 jaar, wanneer de ernst van deze lijnen een belangrijke psychologische invloed heeft op de patiënt. Er is geen relevante indicatie voor het gebruik van Azzalure bij patiënten jonger dan 18 jaar. De veiligheid en doeltreffendheid van Azzalure is bij personen jonger dan 18 jaar niet aangetoond. Dosering en toediening van Azzalure Botulinetoxine-eenheden zijn verschillend afhankelijk van het geneesmiddel. De Speywoodeenheden Azzalure zijn specifiek voor dit preparaat en zijn niet uitwisselbaar met eenheden van andere botulinetoxineproducten. Azzalure mag alleen worden toegediend door een arts die beschikt over de juiste kwalificaties en ervaring met deze behandeling en die in het bezit is van de noodzakelijke apparatuur. Het aanbevolen doseringsregime dat in de Samenvatting van de Productkenmerken wordt aanbevolen moet worden aangehouden. De behandeling moet zo nodig worden herhaald om opnieuw optreden van de symptomen te voorkomen, maar niet vaker dan in de Samenvatting van de Productkenmerken wordt aanbevolen. Voorzichtigheid is geboden bij het gebruik van Azzalure indien de doelspier zwakheid of atrofie vertoont. Toedieningsinstructies - Verwijder make-up en desinfecteer de huid met een lokaal ontsmettingsmiddel. - Intramusculaire injecties moeten worden toegediend in een rechte hoek op de huid met behulp van een steriele injectienaald van gauge. - De aanbevolen dosis is 50 Speywood-eenheden (0,25 ml gereconstitueerde oplossing) Azzalure te verdelen over 5 injectieplaatsen. In elk van de vijf injectieplaatsen moet intramusculair 10 Speywood-eenheden (0,05 ml van de gereconstitueerde oplossing) worden toegediend: 2 injecties in elke musculus corrugator en één in de musculus procerus dicht bij de nasofrontale hoek, zoals hieronder wordt aangegeven: Page 3 of 9
4 - De anatomische referentiepunten kunnen beter worden geïdentificeerd indien ze worden bekeken en gepalpeerd bij een maximaal fronsen. Vóór de injectie plaatst u de duim of wijsvinger stevig onder de orbitale rand om extravasatie onder de orbitale rand te vermijden. De naald moet tijdens de injectie naar boven en mediaal wijzen. Om het risico van ptosis te vermijden, moeten injecties dicht bij de musculus levator palpebrae superioris worden vermeden, vooral bij patiënten met een goed ontwikkelde musculus depressor supercilii. Injecties in de musculus corrugator moeten in het centrale gedeelte van die spier worden toegediend, minimaal 1 cm boven de orbitale rand. - De arts moet ervoor zorgen dat een intravasculaire injectie wordt vermeden. Mogelijke risico's van het gebruik van Azzalure De aard van de mogelijke bijwerkingen is consistent met de farmacologische werking van botulinetoxine type A en de injectieprocedure. Ze kunnen bestaan uit reacties op de plaats van de injectie, hoofdpijn of klinisch detecteerbare effecten in de spieren die grenzen aan de geïnjecteerde doelspieren. Injectie van te veel botulinetoxine (dat wil zeggen overdosering) moet te allen tijde worden vermeden, omdat botulinetoxine in dat geval kan binden aan plaatsen buiten het doelgebied en in zeer zeldzame gevallen zelfs kan leiden tot een effect van botulinetoxine op afstand van de injectieplaats. Kennis van de anatomie van het aangezicht, training in het injecteren van botulinetoxine A in de glabella, in acht name van het doel van de patiënt, onderzoek van de gezichtsmimiek en rimpels van de patiënt en het gebruik van Azzalure in overeenstemming met de aanbevelingen in de SKP m.b.t. de dosering, reconstitutie van het product en de injectieplaatsen, zal het effect van de behandeling en de veiligheid optimaliseren. Page 4 of 9
5 De meest frequent voorkomende bijwerkingen zijn hoofdpijn en reacties ter hoogte van de injectieplaats. Over het algemeen treden reacties die verbonden zijn met de behandeling/injectietechniek, op binnen een week na de injectie en zijn van voorbijgaande aard. Oculaire bijwerkingen De ongewenste verspreiding van botulinetoxine weg van de injectieplaats kan resulteren in volgende oculaire bijwerkingen met als frequentie : Vaak : asthenopie, ptosis, ooglidoedeem, toegenomen traanafscheiding, droge ogen, spiertrekkingen (trekken van spieren rondom de ogen). Soms : visusstoornissen, wazig zien, diplopie en stoornis van de oogbewegingen. Systemische bijwerkingen Ernstige bijwerkingen waarvan wordt vermoed dat ze gerelateerd zijn met de verspreiding op afstand van de effecten van botulinetoxine buiten het doelweefsel werden gemeld met alle botulinetoxine preparaten, waaronder dysfagie en in zeldzame gevallen excessieve spierzwakte of aspiratiepneumonie met fataal gevolg in sommige gevallen. In zeer zeldzame gevallen is melding gemaakt van bijwerkingen met een fatale afloop. In de klinische studies met Azzalure voor de behandeling van matige tot ernstige glabellalijnen hebben zich geen (ernstige of nieternstige) bijwerkingen voorgedaan waarvan wordt vermoed dat ze gerelateerd zijn aan de verspreiding op afstand van de effecten van botulinetoxine buiten het doelweefsel. Risicofactoren : Patiënten met een verhoogd risico op deze bijwerkingen en die bijgevolg met uiterste voorzichtigheid moeten worden behandeld, zijn de volgende : onderliggende neurologische afwijkingen, voorgeschiedenis van slikproblemen, voorgeschiedenis van ademhalingsproblemen, voorgeschiedenis van aspiratie, gelijktijdige behandeling met geneesmiddelen die direct of indirect interfereren met de neuromusculaire functie (bv. aminoglycosiden, curareachtige niet-depolariserende blokkers), Klinische aanwijzingen voor duidelijk defecte neuromusculaire transmissie. Page 5 of 9
6 Deze patiënten moeten dan ook enkel behandeld worden als het voordeel van de behandeling met botulinetoxine opweegt tegen het risico. Om het risico op ernstige verspreidingsreacties van botulinetoxine te beperken, is het van essentieel belang dat de dosering, de waarschuwingen en de voorzorgsmaatregelen strikt worden gevolgd zoals weergegeven in de SKP. De patiënten moeten : - geïnformeerd worden over de mogelijke risico s die gepaard gaan met het gebruik van botulinetoxine type A, - instructies krijgen om tekenen van belangrijke ongewenste effecten vroegtijdig te herkennen (slik-, spraak-, ademhalings-moeilijkheden of overmatige spierzwakte, allergische reactie), - aangespoord worden om dringende medische hulp in te roepen indien zij slik-, spraak-, ademhalingsmoeilijkheden ervaren, - instructies krijgen om andere gezondheidszorgbeoefenaars te informeren over hun gebruik van botulinetoxine type A, wanneer ze voor andere aandoeningen worden behandeld. Neutraliserende antistoffen De ontwikkeling van neutraliserende antistoffen tegen botulinetoxine type A, waardoor de respons bij herhaalde toediening kan afnemen of verdwijnen, is uiterst zeldzaam bij indicaties waarvoor een lage therapeutische dosis noodzakelijk is. Door injecties met een korter interval of met een hogere dosis kan het risico van vorming van antistoffen tegen botulinetoxine toenemen. Om het risico te beperken, mogen de maximale dosering of minimale duur van het interval tussen de behandelingen, aanbevolen in de SKP, niet worden overschreden. Om het risico van de secundaire non-respons te verminderen mag het interval tussen de behandelingen niet korter zijn dan 3 maanden. Klinisch gezien kan de vorming van neutraliserende antistoffen de effectiviteit van een volgende behandeling verminderen. In het geval van falen of van verminderd effect van de behandeling als gevolg van herhaalde injecties, moeten alternatieve behandelingsmethoden worden toegepast. In het geval van falen van de behandeling na de eerste behandelingssessie, kunnen de volgende aanpakken overwogen worden: analyse van de oorzaken van het falen, bijv. injectie van de verkeerde spieren, de injectietechniek zelf en de vorming van neutraliserende antistoffen; herevaluatie van de relevantie van de behandeling met botulinetoxine A. Page 6 of 9
7 Reconstitutie, bewaren en verwijderen Reconstitutie moet op de juiste wijze gebeuren, in het bijzonder met betrekking tot asepsis. Azzalure moet worden gereconstitueerd met een natriumchloride-oplossing 9 mg/ml (0,9%) voor injectie. Volgens de onderstaande verdunningstabel moet de vereiste hoeveelheid natriumchloride 9 mg/ml (0,9%) oplossing voor injectie opgetrokken worden in een spuit om een gereconstitueerde heldere oplossing van 10 E/0,05 ml te verkrijgen. Hoeveelheid oplosmiddel (0,9% natriumchloride oplossing) toegevoegd aan een flacon van 125 E 0,63 ml 10 E Resulterende dosis (Eenheden per 0,05 ml) Het nauwkeurig afmeten van 0,63 ml kan worden bereikt met behulp van insulinespuiten van 1 ml. Deze zijn tot 1ml in stapjes van 0,1 ml en 0,01 ml onderverdeeld. De stop van de injectieflacon Azzalure moet met alcohol worden gereinigd en daarna moet het oplosmiddel langzaam in de injectieflacon worden aangebracht. De injectieflacon moet voorzichtig worden gemengd om de inhoud ervan op te lossen. Dit geeft een heldere oplossing die 125 Speywood-eenheden actief bestanddeel bevat met een concentratie van 10 Speywoodeenheden per 0,05 ml gereconstitueerde oplossing. Azzalure moet bij een temperatuur van 2-8 C worden bewaard. Na reconstitutie wordt onmiddellijk gebruik aanbevolen, hoewel opgelost Azzalure gedurende 24 uur voorafgaand aan gebruik bij een temperatuur van 2-8 C in een koelkast kan worden bewaard. Azzalure mag niet worden ingevroren. Na oplossing mag Azzalure alleen worden gebruikt voor de behandeling van één enkele patiënt, tijdens één sessie. Aanbevelingen voor het verwijderen van gecontamineerde materialen Onmiddellijk na het gebruik en voorafgaand aan het verwijderen moet ongebruikt opgelost Azzalure (in de injectieflacon of in de spuit) worden gedeactiveerd met 2 ml verdunde natriumhypochlorietoplossing van 0,55 of 1% (Dakin oplossing). Gebruikte injectieflacons, spuiten en materialen mogen niet worden leeggemaakt en moeten worden weggegooid in de daarvoor bedoelde containers en worden overeenkomstig lokale voorschriften vernietigd. Page 7 of 9
8 Aanbevelingen voor eventuele incidenten tijdens het hanteren van botulinetoxine Deze aanbevelingen zijn strikt op te volgen. Gemorst product moet worden opgeveegd, in geval van poeder met absorberend materiaal geïmpregneerd met een oplossing van natriumhypochloriet (bleekmiddel), of in geval van opgelost product met droog, absorberend materiaal. De verontreinigde oppervlakken moeten worden gereinigd met behulp van absorberend materiaal dat is geïmpregneerd met een oplossing van natriumhypochloriet (bleekmiddel) en moeten daarna worden gedroogd. Als een injectieflacon is gebroken, ga dan te werk zoals hierboven is vermeld door het zorgvuldig verzamelen van de stukjes gebroken glas en het opvegen van het product, waarbij wordt voorkomen dat er sneetjes in de huid ontstaan. Indien het product in contact komt met de huid moet de aangetaste zone met een oplossing van natriumhypochloriet (bleekmiddel) worden gewassen en daarna overvloedig met water worden gespoeld. Wanneer het product in contact komt met de ogen, spoel dan onmiddellijk en overvloedig met water of met een oplossing voor het spoelen van de ogen. Wanneer het product in contact komt met een wonde, een snee of met beschadigde huid, spoel dan onmiddellijk en overvloedig met water en onderneem de juiste medische stappen overeenkomstig de geïnjecteerde dosis. Informatie voor de patiënt De behandelend arts is verantwoordelijk om de voordelen en risico s van de behandeling te bespreken met de patiënt alsook het patiëntmateriaal te overhandingen. De patiënt moet geïnformeerd worden over de alternatieve behandelingen, de mogelijke bijwerkingen en de gekende risicofactoren. De patiënt moet eveneens geïnformeerd worden wat te doen indien een mogelijke bijwerking van botulinetoxine zich voordoet. U kan steeds de informatiebrochure voor de patiënt bijbestellen door contact op te nemen met Galderma Benelux B.V., tel fax of via info.be@galderma.com. Deze materialen zijn eveneens gepubliceerd op de website van het FAGG met betrekking tot de additionele risicobeperkende activiteiten : kader onderaan met de links naar nuttige pagina s voor de gezondheidszorgbeoefenaars RMA materialen (alfabetisch gerangschikt). Page 8 of 9
9 Melden van bijwerkingen: De gezondheidszorgbeoefenaars worden verzocht bijwerkingen geassocieerd met het gebruik van Azzalure te melden aan de afdeling Vigilantie van het federaal agentschap voor geneesmiddelen en gezondheidsproducten (fagg). Het melden kan online gebeuren via of via de papieren gele fiche beschikbaar via het Gecommentarieerd Geneesmiddelenrepertorium en via de Folia Pharmacotherapeutica. De gele fiche kan worden verzonden per post naar het adres Fagg Afdeling Vigilantie Eurostation II Victor Hortaplein 40/ Brussel, per fax op het nummer 02/ , of per mail naar: Bijwerkingen kunnen eveneens gemeld worden aan de Medische afdeling van Galderma per e- mail : medical.benelux@galderma.com. Page 9 of 9
RISICOMINIMALISATIEMATERIAAL BETREFFENDE AZZALURE
 DOSERING EN TOEDIENING RISICOMINIMALISATIEMATERIAAL BETREFFENDE AZZALURE VOOR VOORSCHRIJVENDE EN BEHANDELENDE SPECIALISTEN IN OVEREENSTEMMING MET HET EUROPESE RISICOBEHEERSPLAN VOOR BOTULINETOXINEPRODUCTEN
DOSERING EN TOEDIENING RISICOMINIMALISATIEMATERIAAL BETREFFENDE AZZALURE VOOR VOORSCHRIJVENDE EN BEHANDELENDE SPECIALISTEN IN OVEREENSTEMMING MET HET EUROPESE RISICOBEHEERSPLAN VOOR BOTULINETOXINEPRODUCTEN
RISICOMINIMALISATIEMATERIAAL BETREFFENDE AZZALURE
 DOSERING EN TOEDIENING RISICOMINIMALISATIEMATERIAAL BETREFFENDE AZZALURE VOOR VOORSCHRIJVENDE EN BEHANDELENDE SPECIALISTEN IN OVEREENSTEMMING MET HET EUROPESE RISICOBEHEERSPLAN VOOR BOTULINETOXINEPRODUCTEN
DOSERING EN TOEDIENING RISICOMINIMALISATIEMATERIAAL BETREFFENDE AZZALURE VOOR VOORSCHRIJVENDE EN BEHANDELENDE SPECIALISTEN IN OVEREENSTEMMING MET HET EUROPESE RISICOBEHEERSPLAN VOOR BOTULINETOXINEPRODUCTEN
INFORMATIE VOOR DE PATIËNT
 De Belgische gezondheidsautoriteiten hebben bepaalde voorwaarden verbonden aan het in de handel brengen van het geneesmiddel Azzalure. Het verplichte plan voor risicobeperking in België, waarvan deze informatie
De Belgische gezondheidsautoriteiten hebben bepaalde voorwaarden verbonden aan het in de handel brengen van het geneesmiddel Azzalure. Het verplichte plan voor risicobeperking in België, waarvan deze informatie
Educatief materiaal voor gezondheidsbeoefenaars (Powerpointpresentatie)
 De Belgische gezondheidsautoriteiten hebben bepaalde voorwaarden verbonden aan het in de handel brengen van het geneesmiddel BOCOUTURE. Het verplicht plan voor risicobeperking in België, waarvan deze informatie
De Belgische gezondheidsautoriteiten hebben bepaalde voorwaarden verbonden aan het in de handel brengen van het geneesmiddel BOCOUTURE. Het verplicht plan voor risicobeperking in België, waarvan deze informatie
VISTABEL (botulinum toxine type A) Educatieve brochure voor artsen. 50 Allerganeenheden Poeder voor oplossing voor injectie
 De Belgische gezondheidsautoriteiten hebben bepaalde voorwaarden verbonden aan het in de handel brengen van het geneesmiddel VISTABEL. Het verplicht plan voor risicobeperking in België, waarvan deze informatie
De Belgische gezondheidsautoriteiten hebben bepaalde voorwaarden verbonden aan het in de handel brengen van het geneesmiddel VISTABEL. Het verplicht plan voor risicobeperking in België, waarvan deze informatie
RECONSTITUTIE, DOSERING EN TOEDIENING
 De Europese gezondheidsautoriteiten hebben bepaalde voorwaarden verbonden aan het in de handel brengen van het geneesmiddel VELCADE. Het verplicht plan voor risicobeperking in België, waarvan deze informatie
De Europese gezondheidsautoriteiten hebben bepaalde voorwaarden verbonden aan het in de handel brengen van het geneesmiddel VELCADE. Het verplicht plan voor risicobeperking in België, waarvan deze informatie
Belangrijke informatie voor zorgverleners over de nieuwe formulering van FLOLAN
 De Belgische gezondheidsautoriteiten hebben bepaalde voorwaarden verbonden aan het in de handel brengen van het geneesmiddel FLOLAN. Het verplicht plan voor risicobeperking in België, waarvan deze informatie
De Belgische gezondheidsautoriteiten hebben bepaalde voorwaarden verbonden aan het in de handel brengen van het geneesmiddel FLOLAN. Het verplicht plan voor risicobeperking in België, waarvan deze informatie
BIJSLUITER: INFORMATIE VOOR DE GEBRUIKER. Azzalure, 10 Speywood-eenheden/0,05 ml, poeder voor oplossing voor injectie. botulinetoxine type A
 BIJSLUITER: INFORMATIE VOOR DE GEBRUIKER Azzalure, 10 Speywood-eenheden/0,05 ml, poeder voor oplossing voor injectie botulinetoxine type A Lees goed de hele bijsluiter voordat u dit geneesmiddel gaat gebruiken,
BIJSLUITER: INFORMATIE VOOR DE GEBRUIKER Azzalure, 10 Speywood-eenheden/0,05 ml, poeder voor oplossing voor injectie botulinetoxine type A Lees goed de hele bijsluiter voordat u dit geneesmiddel gaat gebruiken,
BIJSLUITER: INFORMATIE VOOR DE GEBRUIKER. Azzalure, 10 Speywood-eenheden/0,05 ml, poeder voor oplossing voor injectie. botulinetoxine type A
 1 VAN 7 BIJSLUITER: INFORMATIE VOOR DE GEBRUIKER Azzalure, 10 Speywood-eenheden/0,05 ml, poeder voor oplossing voor injectie botulinetoxine type A Lees goed de hele bijsluiter voordat u dit geneesmiddel
1 VAN 7 BIJSLUITER: INFORMATIE VOOR DE GEBRUIKER Azzalure, 10 Speywood-eenheden/0,05 ml, poeder voor oplossing voor injectie botulinetoxine type A Lees goed de hele bijsluiter voordat u dit geneesmiddel
RECONSTITUTIE, DOSERING EN TOEDIENING
 De Europese gezondheidsautoriteiten hebben bepaalde voorwaarden verbonden aan het in de handel brengen van het geneesmiddel VELCADE. Het verplicht plan voor risicobeperking in België, waarvan deze informatie
De Europese gezondheidsautoriteiten hebben bepaalde voorwaarden verbonden aan het in de handel brengen van het geneesmiddel VELCADE. Het verplicht plan voor risicobeperking in België, waarvan deze informatie
FLOLAN INFORMATIEGIDS VOOR PATIENTEN - FLOLAN
 De Belgische gezondheidsautoriteiten hebben bepaalde voorwaarden verbonden aan het in de handel brengen van het geneesmiddel FLOLAN. Het verplicht plan voor risicobeperking in België, waarvan deze informatie
De Belgische gezondheidsautoriteiten hebben bepaalde voorwaarden verbonden aan het in de handel brengen van het geneesmiddel FLOLAN. Het verplicht plan voor risicobeperking in België, waarvan deze informatie
BROCHURE VOOR RECONSTITUTIE, DOSERING EN TOEDIENING
 De Belgische gezondheidsautoriteiten hebben bepaalde voorwaarden verbonden aan het in de handel brengen van het geneesmiddel Bortezomib Sandoz 3,5 mg poeder voor oplossing voor injectie. Het verplicht
De Belgische gezondheidsautoriteiten hebben bepaalde voorwaarden verbonden aan het in de handel brengen van het geneesmiddel Bortezomib Sandoz 3,5 mg poeder voor oplossing voor injectie. Het verplicht
Vectibix (panitumumab) Educatief materiaal voor de arts
 De Europese gezondheidsautoriteiten hebben bepaalde voorwaarden verbonden aan het in de handel brengen van het geneesmiddel Vectibix. Het verplicht plan voor risicobeperking in België, waarvan deze informatie
De Europese gezondheidsautoriteiten hebben bepaalde voorwaarden verbonden aan het in de handel brengen van het geneesmiddel Vectibix. Het verplicht plan voor risicobeperking in België, waarvan deze informatie
BIJSLUITER: INFORMATIE VOOR DE GEBRUIKER. Azzalure, 10 Speywood-eenheden/0,05 ml, poeder voor oplossing voor injectie. botulinetoxine type A
 VERTROUWELIJK 1 VAN 6 BIJSLUITER: INFORMATIE VOOR DE GEBRUIKER Azzalure, 10 Speywood-eenheden/0,05 ml, poeder voor oplossing voor injectie botulinetoxine type A Lees goed de hele bijsluiter voordat u dit
VERTROUWELIJK 1 VAN 6 BIJSLUITER: INFORMATIE VOOR DE GEBRUIKER Azzalure, 10 Speywood-eenheden/0,05 ml, poeder voor oplossing voor injectie botulinetoxine type A Lees goed de hele bijsluiter voordat u dit
BOTOX (botulinum toxine type A) Educatieve brochure voor artsen. 100 Allerganeenheden Poeder voor oplossing voor injectie
 De Belgische gezondheidsautoriteiten hebben bepaalde voorwaarden verbonden aan het in de handel brengen van het geneesmiddel BOTOX. Het verplicht plan voor risicobeperking in België, waarvan deze informatie
De Belgische gezondheidsautoriteiten hebben bepaalde voorwaarden verbonden aan het in de handel brengen van het geneesmiddel BOTOX. Het verplicht plan voor risicobeperking in België, waarvan deze informatie
Checklist voor voorschrijvers
 De Nederlandse en Belgische gezondheidsautoriteiten hebben bepaalde voorwaarden verbonden aan het in de handel brengen van het geneesmiddel Jext. Het verplicht plan voor risicobeperking in Nederland en
De Nederlandse en Belgische gezondheidsautoriteiten hebben bepaalde voorwaarden verbonden aan het in de handel brengen van het geneesmiddel Jext. Het verplicht plan voor risicobeperking in Nederland en
NEBIDO (TESTOSTERONUNDECANOAAT) 1000 mg/4 ml oplossing voor injectie GIDS VOOR DE VOORSCHRIJVER
 De Belgische gezondheidsautoriteiten hebben bepaalde voorwaarden verbonden aan het in de handel brengen van het geneesmiddel Nebido. Het verplicht plan voor risicobeperking in België, waarvan deze informatie
De Belgische gezondheidsautoriteiten hebben bepaalde voorwaarden verbonden aan het in de handel brengen van het geneesmiddel Nebido. Het verplicht plan voor risicobeperking in België, waarvan deze informatie
Kyleena (19,5 mg levonorgestrel) afleveringsysteem voor intra-uterien gebruik
 De Belgische gezondheidsautoriteiten hebben bepaalde voorwaarden verbonden aan het in de handel brengen van het geneesmiddel Kyleena. Het verplicht plan voor risicobeperking in België, waarvan deze informatie
De Belgische gezondheidsautoriteiten hebben bepaalde voorwaarden verbonden aan het in de handel brengen van het geneesmiddel Kyleena. Het verplicht plan voor risicobeperking in België, waarvan deze informatie
Educatief materiaal. EFIENT (Prasugrel) Dit geneesmiddel is onderworpen aan aanvullende monitoring.
 De Europese gezondheidsautoriteiten hebben bepaalde voorwaarden verbonden aan het in de handel brengen van het geneesmiddel EFIENT. Het verplicht plan voor risicobeperking in België, waarvan deze informatie
De Europese gezondheidsautoriteiten hebben bepaalde voorwaarden verbonden aan het in de handel brengen van het geneesmiddel EFIENT. Het verplicht plan voor risicobeperking in België, waarvan deze informatie
VALDOXAN (agomelatine) Informatie voor beroepsbeoefenaren in de gezondheidszorg. Aanbevelingen met betrekking tot:
 De Europese gezondheidsautoriteiten hebben bepaalde voorwaarden verbonden aan het in de handel brengen van het geneesmiddel Valdoxan 25 mg. Het verplicht plan voor risicobeperking in België, waarvan deze
De Europese gezondheidsautoriteiten hebben bepaalde voorwaarden verbonden aan het in de handel brengen van het geneesmiddel Valdoxan 25 mg. Het verplicht plan voor risicobeperking in België, waarvan deze
CINRYZE (C1-REMMER [HUMAAN])
![CINRYZE (C1-REMMER [HUMAAN]) CINRYZE (C1-REMMER [HUMAAN])](/thumbs/66/54698885.jpg) De Europese gezondheidsautoriteiten hebben bepaalde voorwaarden verbonden aan het in de handel brengen van het geneesmiddel CINRYZE. Het verplicht plan voor risicobeperking in België, waarvan deze informatie
De Europese gezondheidsautoriteiten hebben bepaalde voorwaarden verbonden aan het in de handel brengen van het geneesmiddel CINRYZE. Het verplicht plan voor risicobeperking in België, waarvan deze informatie
VOORLICHTINGSBROCHURE VOOR DE GEZONDHEIDSZORGBEOEFENAAR
 De Belgische gezondheidsautoriteiten hebben bepaalde voorwaarden verbonden aan het in de handel brengen van het geneesmiddel ACCUSOL 35. Het verplicht plan voor risicobeperking in België, waarvan deze
De Belgische gezondheidsautoriteiten hebben bepaalde voorwaarden verbonden aan het in de handel brengen van het geneesmiddel ACCUSOL 35. Het verplicht plan voor risicobeperking in België, waarvan deze
GIDS VOOR DE VOORSCHRIJVER
 De Europese gezondheidsautoriteiten hebben bepaalde voorwaarden verbonden aan het in handel brengen van het geneesmiddel Cerdelga. Het verplicht plan voor risicobeperking in België, waarvan deze informatie
De Europese gezondheidsautoriteiten hebben bepaalde voorwaarden verbonden aan het in handel brengen van het geneesmiddel Cerdelga. Het verplicht plan voor risicobeperking in België, waarvan deze informatie
Azzalure, 10 Speywood-eenheden/0,05ml, poeder voor oplossing voor injectie
 1. NAAM VAN HET GENEESMIDDEL Azzalure, 10 Speywood-eenheden/0,05ml, poeder voor oplossing voor injectie 2. KWALITATIEVE EN KWANTITATIEVE SAMENSTELLING Botulinetoxine type A * 10 Speywood-eenheden ** 0,05
1. NAAM VAN HET GENEESMIDDEL Azzalure, 10 Speywood-eenheden/0,05ml, poeder voor oplossing voor injectie 2. KWALITATIEVE EN KWANTITATIEVE SAMENSTELLING Botulinetoxine type A * 10 Speywood-eenheden ** 0,05
In geval van vermoedelijke onjuiste toediening van Depo-Eligard moeten de testosteronespiegels bepaald worden.
 Een Direct Healthcare Professional Communication (DHPC) is een schrijven dat naar de gezondheidszorgbeoefenaars wordt gezonden door de farmaceutische firma s, om hen te informeren over mogelijke risico
Een Direct Healthcare Professional Communication (DHPC) is een schrijven dat naar de gezondheidszorgbeoefenaars wordt gezonden door de farmaceutische firma s, om hen te informeren over mogelijke risico
Mysimba 8 mg/90 mg tabletten met verlengde afgifte. (naltrexonhydrochloride en bupropionhydrochloride)
 1 De Europese gezondheidsautoriteiten hebben bepaaide voorwaarden verbonden aan het in de handel brengen van het geneesmiddel Mysimba 8 mg/90 mg tabletten met verlengde afgifte. Het verplichte plan voor
1 De Europese gezondheidsautoriteiten hebben bepaaide voorwaarden verbonden aan het in de handel brengen van het geneesmiddel Mysimba 8 mg/90 mg tabletten met verlengde afgifte. Het verplichte plan voor
SAMENVATTING VAN DE PRODUCTKENMERKEN
 1 VAN 11 SAMENVATTING VAN DE PRODUCTKENMERKEN 1. NAAM VAN HET GENEESMIDDEL Azzalure, 10 Speywood-eenheden/0,05ml, poeder voor oplossing voor injectie 2. KWALITATIEVE EN KWANTITATIEVE SAMENSTELLING Botulinetoxine
1 VAN 11 SAMENVATTING VAN DE PRODUCTKENMERKEN 1. NAAM VAN HET GENEESMIDDEL Azzalure, 10 Speywood-eenheden/0,05ml, poeder voor oplossing voor injectie 2. KWALITATIEVE EN KWANTITATIEVE SAMENSTELLING Botulinetoxine
VALDOXAN. (agomelatine) Informatie voor beroepsbeoefenaren in de gezondheidszorg: Aanbevelingen met betrekking tot:
 De Europese gezondheidsautoriteiten hebben bepaalde voorwaarden verbonden aan het in de handel brengen van het geneesmiddel Valdoxan 25 mg. Het verplicht plan voor risicobeperking in België, waarvan deze
De Europese gezondheidsautoriteiten hebben bepaalde voorwaarden verbonden aan het in de handel brengen van het geneesmiddel Valdoxan 25 mg. Het verplicht plan voor risicobeperking in België, waarvan deze
Azzalure, 125 Speywood-eenheden, poeder voor oplossing voor injectie
 1. NAAM VAN HET GENEESMIDDEL Azzalure, 125 Speywood-eenheden, poeder voor oplossing voor injectie 2. KWALITATIEVE EN KWANTITATIEVE SAMENSTELLING Botulinetoxine type A* Hoeveelheid overeenkomend met 125
1. NAAM VAN HET GENEESMIDDEL Azzalure, 125 Speywood-eenheden, poeder voor oplossing voor injectie 2. KWALITATIEVE EN KWANTITATIEVE SAMENSTELLING Botulinetoxine type A* Hoeveelheid overeenkomend met 125
Handleiding voor zorgverleners
 De Europese gezondheidsautoriteiten hebben bepaalde voorwaarden verbonden aan het in handel brengen van het geneesmiddel Toujeo. Het verplicht plan voor risicobeperking in België, waarvan deze informatie
De Europese gezondheidsautoriteiten hebben bepaalde voorwaarden verbonden aan het in handel brengen van het geneesmiddel Toujeo. Het verplicht plan voor risicobeperking in België, waarvan deze informatie
Selectie en training van patiënten voor thuistoediening van Nplate
 De Europese gezondheidsautoriteiten hebben bepaalde voorwaarden verbonden aan het in de handel brengen van het geneesmiddel Nplate. Dit verplicht plan voor risicobeperking in België, waarvan deze informatie
De Europese gezondheidsautoriteiten hebben bepaalde voorwaarden verbonden aan het in de handel brengen van het geneesmiddel Nplate. Dit verplicht plan voor risicobeperking in België, waarvan deze informatie
LEIDRAAD VOOR BEROEPSBEOEFENAREN IN DE GEZONDHEIDSZORG
 De Europese gezondheidsautoriteiten hebben bepaalde voorwaarden verbonden aan het in de handel brengen van het geneesmiddel KANUMA. Het verplicht plan voor risicobeperking in België, waarvan deze informatie
De Europese gezondheidsautoriteiten hebben bepaalde voorwaarden verbonden aan het in de handel brengen van het geneesmiddel KANUMA. Het verplicht plan voor risicobeperking in België, waarvan deze informatie
EDUCATIEVE INFORMATIE VOOR PATIËNTEN
 De Belgische gezondheidsautoriteiten hebben bepaalde voorwaarden verbonden aan het in de handel brengen van het geneesmiddel BOCOUTURE. Het verplicht plan voor risicobeperking in België, waarvan deze informatie
De Belgische gezondheidsautoriteiten hebben bepaalde voorwaarden verbonden aan het in de handel brengen van het geneesmiddel BOCOUTURE. Het verplicht plan voor risicobeperking in België, waarvan deze informatie
Postdatum. Geachte Dokter,
 De Belgische gezondheidsautoriteiten hebben bepaalde voorwaarden verbonden aan het in de handel brengen van het geneesmiddel Quetiapine Krka 50 mg / 200 mg / 300 mg/400 mg tabletten met verlengde afgifte.
De Belgische gezondheidsautoriteiten hebben bepaalde voorwaarden verbonden aan het in de handel brengen van het geneesmiddel Quetiapine Krka 50 mg / 200 mg / 300 mg/400 mg tabletten met verlengde afgifte.
Gelieve de patiëntenwaarschuwingskaart van Entyvio in te vullen en te overhandigen aan elke patiënt.
 Deze informatie maakt deel uit van het Belgische en Luxemburgse risicobeheerplan, dat informatiemateriaal beschikbaar stelt aan gezondheidszorgbeoefenaars (en patiënten). Deze bijkomende risicobeperkende
Deze informatie maakt deel uit van het Belgische en Luxemburgse risicobeheerplan, dat informatiemateriaal beschikbaar stelt aan gezondheidszorgbeoefenaars (en patiënten). Deze bijkomende risicobeperkende
Dit geneesmiddel is onderworpen aan aanvullende monitoring
 De Europese gezondheidsautoriteiten hebben bepaalde voorwaarden verbonden aan het in de handel brengen van het geneesmiddel Alofisel. Het verplicht plan voor risicobeperking in België, waarvan deze informatie
De Europese gezondheidsautoriteiten hebben bepaalde voorwaarden verbonden aan het in de handel brengen van het geneesmiddel Alofisel. Het verplicht plan voor risicobeperking in België, waarvan deze informatie
Informatiefiche voor artsen voor een veilig en doeltreffend gebruik van het geneesmiddel
 Een Direct Healthcare Professional Communication (DHPC) is een schrijven dat naar de gezondheidszorgbeoefenaars wordt gezonden door de farmaceutische firma s, om hen te informeren over mogelijke risico
Een Direct Healthcare Professional Communication (DHPC) is een schrijven dat naar de gezondheidszorgbeoefenaars wordt gezonden door de farmaceutische firma s, om hen te informeren over mogelijke risico
Jext : Instructies voor gebruik
 RMA versie 06/2017 Jext : Instructies voor gebruik 1 2 3 4 Ik heb een risico op anafylaxie, een levensbedreigende allergische reactie op: Als ik niet in staat ben om mezelf te helpen, volg dan de instructies
RMA versie 06/2017 Jext : Instructies voor gebruik 1 2 3 4 Ik heb een risico op anafylaxie, een levensbedreigende allergische reactie op: Als ik niet in staat ben om mezelf te helpen, volg dan de instructies
Servier Benelux S.A. PROTELOS. (strontiumranelaat) GIDS EN CHECKLIST VOOR DE ARTS
 De Europese gezondheidsautoriteiten hebben bepaalde voorwaarden verbonden aan het in de handel brengen van het geneesmiddel Protelos 2 g. Het verplicht plan voor risicobeperking in België, waarvan deze
De Europese gezondheidsautoriteiten hebben bepaalde voorwaarden verbonden aan het in de handel brengen van het geneesmiddel Protelos 2 g. Het verplicht plan voor risicobeperking in België, waarvan deze
Informatie verspreid onder het gezag van het federaal agentschap voor geneesmiddelen en gezondheidsproducten
 Een Direct Healthcare Professional Communication (DHPC) is een schrijven dat naar de gezondheidszorgbeoefenaars wordt gezonden door de farmaceutische firma s, om hen te informeren over mogelijke risico
Een Direct Healthcare Professional Communication (DHPC) is een schrijven dat naar de gezondheidszorgbeoefenaars wordt gezonden door de farmaceutische firma s, om hen te informeren over mogelijke risico
Brochure voor de professionele zorgverleners
 De Belgische gezondheidsautoriteiten hebben bepaalde voorwaarden verbonden aan het in de handel brengen van het geneesmiddel Mitoxantrone Sandoz. Het verplicht plan voor risicobeperking in België, waarvan
De Belgische gezondheidsautoriteiten hebben bepaalde voorwaarden verbonden aan het in de handel brengen van het geneesmiddel Mitoxantrone Sandoz. Het verplicht plan voor risicobeperking in België, waarvan
ACTYNOX 50%/50% v/v Distikstofoxide (N 2 O) en Zuurstof (O 2 ) Medicinaal gas, samengeperst
 De Belgische gezondheidsautoriteiten hebben bepaalde voorwaarden verbonden aan het in de handel brengen van het geneesmiddel ACTYNOX. Het verplicht plan voor risicobeperking in België, waarvan deze informatie
De Belgische gezondheidsautoriteiten hebben bepaalde voorwaarden verbonden aan het in de handel brengen van het geneesmiddel ACTYNOX. Het verplicht plan voor risicobeperking in België, waarvan deze informatie
ARIPIPRAZOLE EG (aripiprazol)
 De Belgische gezondheidsautoriteiten hebben bepaalde voorwaarden verbonden aan het in de handel brengen van het geneesmiddel Aripiprazole EG 10 mg -15 mg 30 mg tabletten. Het verplicht plan voor risicobeperking
De Belgische gezondheidsautoriteiten hebben bepaalde voorwaarden verbonden aan het in de handel brengen van het geneesmiddel Aripiprazole EG 10 mg -15 mg 30 mg tabletten. Het verplicht plan voor risicobeperking
Hemlibra (emicizumab) Subcutane injectie Dit geneesmiddel is onderworpen aan aanvullende monitoring. Informatiebrochure voor de patiënt/verzorger
 Om een maximaal voordeel te halen voor uw gezondheid uit de effecten van het geneesmiddel Hemlibra, om voor een goed gebruik ervan te zorgen en om de ongewenste effecten ervan te beperken, zijn er bepaalde
Om een maximaal voordeel te halen voor uw gezondheid uit de effecten van het geneesmiddel Hemlibra, om voor een goed gebruik ervan te zorgen en om de ongewenste effecten ervan te beperken, zijn er bepaalde
Dit geneesmiddel is onderworpen aan aanvullende monitoring. Belangrijke informatie voor beroepsbeoefenaren
 De gezondheidsautoriteiten van de Europese Unie hebben het in de handel brengen van het geneesmiddel Kadcyla verbonden aan bepaalde voorwaarden. Het verplichte farmacovigilantieplan ter minimalisatie van
De gezondheidsautoriteiten van de Europese Unie hebben het in de handel brengen van het geneesmiddel Kadcyla verbonden aan bepaalde voorwaarden. Het verplichte farmacovigilantieplan ter minimalisatie van
ZypAdhera. Informatie bestemd voor professionelen uit de gezondheidszorg en verpleegkundigen Risicobeleidsplan
 De Europese gezondheidsautoriteiten hebben bepaalde voorwaarden verbonden aan het in de handel brengen van het geneesmiddel ZypAdhera. Het verplicht plan voor risicobeperking in België, waarvan deze informatie
De Europese gezondheidsautoriteiten hebben bepaalde voorwaarden verbonden aan het in de handel brengen van het geneesmiddel ZypAdhera. Het verplicht plan voor risicobeperking in België, waarvan deze informatie
RECONSTITUTIE, DOSERING EN TOEDIENING
 Additioneel risico minimalisatie materiaal betreffende bortezomib voor beroepsbeoefenaren in de gezondheidszorg Belangrijke informatie over de RECONSTITUTIE, DOSERING EN TOEDIENING van bortezomib 3,5 mg
Additioneel risico minimalisatie materiaal betreffende bortezomib voor beroepsbeoefenaren in de gezondheidszorg Belangrijke informatie over de RECONSTITUTIE, DOSERING EN TOEDIENING van bortezomib 3,5 mg
ENKEL VOOR NON HODGKIN LYMFOOM (NHL)
 De Europese gezondheidsautoriteiten hebben bepaalde voorwaarden verbonden aan het in de handel brengen van het geneesmiddel MabThera oplossing voor subcutane injectie (SC). Het verplicht plan voor risicobeperking
De Europese gezondheidsautoriteiten hebben bepaalde voorwaarden verbonden aan het in de handel brengen van het geneesmiddel MabThera oplossing voor subcutane injectie (SC). Het verplicht plan voor risicobeperking
Brochure voor beroepsbeoefenaren in de gezondheidszorg
 De Europese gezondheidsautoriteiten hebben bepaalde voorwaarden verbonden aan het in de handel brengen van het geneesmiddel Suliqua TM. Het verplicht plan voor risicobeperking in België, waarvan deze informatie
De Europese gezondheidsautoriteiten hebben bepaalde voorwaarden verbonden aan het in de handel brengen van het geneesmiddel Suliqua TM. Het verplicht plan voor risicobeperking in België, waarvan deze informatie
CINRYZE (C1-REMMER [HUMAAN])
![CINRYZE (C1-REMMER [HUMAAN]) CINRYZE (C1-REMMER [HUMAAN])](/thumbs/66/54698857.jpg) De Europese gezondheidsautoriteiten hebben bepaalde voorwaarden verbonden aan het in de handel brengen van het geneesmiddel CINRYZE. Het verplicht plan voor risicobeperking in België, waarvan deze informatie
De Europese gezondheidsautoriteiten hebben bepaalde voorwaarden verbonden aan het in de handel brengen van het geneesmiddel CINRYZE. Het verplicht plan voor risicobeperking in België, waarvan deze informatie
Fronslijnen behandelen met VISTABEL
 Uw arts heeft u verteld dat u in aanmerking komt voor een behandeling met VISTABEL. In deze folder vindt u extra informatie over deze behandeling en enkele algemene tips voor de verzorging van de huid.
Uw arts heeft u verteld dat u in aanmerking komt voor een behandeling met VISTABEL. In deze folder vindt u extra informatie over deze behandeling en enkele algemene tips voor de verzorging van de huid.
INFORMATIE VOOR DE PATIENT
 De Europese gezondheidsautoriteiten hebben bepaalde voorwaarden verbonden aan het in de handel brengen van het geneesmiddel Increlex. Het verplicht plan voor risicobeperking in België, waarvan deze informatie
De Europese gezondheidsautoriteiten hebben bepaalde voorwaarden verbonden aan het in de handel brengen van het geneesmiddel Increlex. Het verplicht plan voor risicobeperking in België, waarvan deze informatie
Educatieve PrEP-brochure voor voorschrijvers 1
 De Europese gezondheidsautoriteiten hebben bepaalde voorwaarden verbonden aan het in de handel brengen van het geneesmiddel Emtricitabine/Tenofovirdisoproxil Mylan 200 mg/245 mg filmomhulde tabletten.
De Europese gezondheidsautoriteiten hebben bepaalde voorwaarden verbonden aan het in de handel brengen van het geneesmiddel Emtricitabine/Tenofovirdisoproxil Mylan 200 mg/245 mg filmomhulde tabletten.
Capecitabine Accord moet permanent worden stopgezet bij patiënten die een ernstige huidreactie hebben gehad tijdens de behandeling.
 Een Direct Healthcare Professional Communication (DHPC) is een schrijven dat naar de gezondheidszorgbeoefenaars wordt gezonden door de farmaceutische firma s, om hen te informeren over mogelijke risico
Een Direct Healthcare Professional Communication (DHPC) is een schrijven dat naar de gezondheidszorgbeoefenaars wordt gezonden door de farmaceutische firma s, om hen te informeren over mogelijke risico
Samenvatting van risico s en acties om deze te voorkomen of verminderen:
 T.a.v. Adresregel 1 Adresregel 2 Risico minimalisatie materialen betreffende: BOTOX, botulinum toxine type A, voor artsen en patiënten. Geachte Heer / Mevrouw In overleg met het College ter Beoordeling
T.a.v. Adresregel 1 Adresregel 2 Risico minimalisatie materialen betreffende: BOTOX, botulinum toxine type A, voor artsen en patiënten. Geachte Heer / Mevrouw In overleg met het College ter Beoordeling
BIJSLUITER: INFORMATIE VOOR DE GEBRUIK(ST)ER. VISTABEL, 4 Allergan-eenheden/0,1 ml, poeder voor oplossing voor injectie Botulinumtoxine type A
 BIJSLUITER: INFORMATIE VOOR DE GEBRUIK(ST)ER VISTABEL, 4 Allergan-eenheden/0,1 ml, poeder voor oplossing voor injectie Botulinumtoxine type A Lees de hele bijsluiter zorgvuldig door voordat u start met
BIJSLUITER: INFORMATIE VOOR DE GEBRUIK(ST)ER VISTABEL, 4 Allergan-eenheden/0,1 ml, poeder voor oplossing voor injectie Botulinumtoxine type A Lees de hele bijsluiter zorgvuldig door voordat u start met
Baxter S.A. Water voor Injecties (Viaflo) Samenvatting van de productkenmerken 1/6 1. NAAM VAN HET GENEESMIDDEL
 Samenvatting van de productkenmerken 1/6 1. NAAM VAN HET GENEESMIDDEL Water voor Injecties Viaflo, oplosmiddel voor parenteraal gebruik. 2. KWALITATIEVE EN KWANTITATIEVE SAMENSTELLING Elke zak bevat 100
Samenvatting van de productkenmerken 1/6 1. NAAM VAN HET GENEESMIDDEL Water voor Injecties Viaflo, oplosmiddel voor parenteraal gebruik. 2. KWALITATIEVE EN KWANTITATIEVE SAMENSTELLING Elke zak bevat 100
ARIPIPRAZOL SANDOZ VRAAG & ANTWOORD BROCHURE VOOR MEDISCHE ZORGVERLENERS
 De Europese gezondheidsautoriteiten hebben bepaalde voorwaarden verbonden aan het in de handel brengen van het geneesmiddel Aripiprazol Sandoz. Het verplicht plan voor risicobeperking in België, waarvan
De Europese gezondheidsautoriteiten hebben bepaalde voorwaarden verbonden aan het in de handel brengen van het geneesmiddel Aripiprazol Sandoz. Het verplicht plan voor risicobeperking in België, waarvan
De volgende informatie is alleen bestemd voor artsen of andere beroepsbeoefenaren in de gezondheidszorg.
 De Belgische gezondheidsautoriteiten hebben bepaalde voorwaarden verbonden aan het in de handel brengen van het geneesmiddel Levonortis. Het verplicht plan voor risicobeperking in België, waarvan deze
De Belgische gezondheidsautoriteiten hebben bepaalde voorwaarden verbonden aan het in de handel brengen van het geneesmiddel Levonortis. Het verplicht plan voor risicobeperking in België, waarvan deze
Onderwerp: Ernstige huidreacties geassocieerd met Capecitabine (Xeloda )
 Een Direct Healthcare Professional Communication (DHPC) is een schrijven dat naar de gezondheidszorgbeoefenaars wordt gezonden door de farmaceutische firma s, om hen te informeren over mogelijke risico
Een Direct Healthcare Professional Communication (DHPC) is een schrijven dat naar de gezondheidszorgbeoefenaars wordt gezonden door de farmaceutische firma s, om hen te informeren over mogelijke risico
BIJLAGE I SAMENVATTING VAN DE PRODUCTKENMERKEN
 BIJLAGE I SAMENVATTING VAN DE PRODUCTKENMERKEN 1. NAAM VAN HET GENEESMIDDEL Oculo-Heel; Oogdruppels, oplossing 2. KWALITATIEVE EN KWANTITATIEVE SAMENSTELLING Oculo-Heel bevat per monodosis van 0,45 ml
BIJLAGE I SAMENVATTING VAN DE PRODUCTKENMERKEN 1. NAAM VAN HET GENEESMIDDEL Oculo-Heel; Oogdruppels, oplossing 2. KWALITATIEVE EN KWANTITATIEVE SAMENSTELLING Oculo-Heel bevat per monodosis van 0,45 ml
Rechtstreekse melding aan de gezondheidszorgbeoefenaars
 Een Direct Healthcare Professional Communication (DHPC) is een schrijven dat naar de gezondheidszorgbeoefenaars wordt gezonden door de farmaceutische firma s, om hen te informeren over mogelijke risico
Een Direct Healthcare Professional Communication (DHPC) is een schrijven dat naar de gezondheidszorgbeoefenaars wordt gezonden door de farmaceutische firma s, om hen te informeren over mogelijke risico
ARIPIPRAZOLE TEVA VRAAG & ANTWOORD BROCHURE VOOR MEDISCHE ZORGVERLENERS
 De Belgische gezondheidsautoriteiten hebben bepaalde voorwaarden verbonden aan het in de handel brengen van het geneesmiddel ARIPIPRAZOLE TEVA. Het verplicht plan voor risicobeperking in België, waarvan
De Belgische gezondheidsautoriteiten hebben bepaalde voorwaarden verbonden aan het in de handel brengen van het geneesmiddel ARIPIPRAZOLE TEVA. Het verplicht plan voor risicobeperking in België, waarvan
MEDICA KEELSPRAY MENTHOL, 20 mg/10 ml; 5 mg/10 ml, spray voor oromucosaal gebruik Chloorhexidine gluconaat - Lidocaïne hydrochloride
 MEDICA KEELSPRAY MENTHOL, 20 mg/10 ml; 5 mg/10 ml, spray voor oromucosaal gebruik Chloorhexidine gluconaat - Lidocaïne hydrochloride Lees goed de hele bijsluiter voordat u dit geneesmiddel gaat gebruiken,
MEDICA KEELSPRAY MENTHOL, 20 mg/10 ml; 5 mg/10 ml, spray voor oromucosaal gebruik Chloorhexidine gluconaat - Lidocaïne hydrochloride Lees goed de hele bijsluiter voordat u dit geneesmiddel gaat gebruiken,
Educatieve PrEP-brochure voor voorschrijvers 1
 De Belgische gezondheidsautoriteiten hebben bepaalde voorwaarden verbonden aan het in de handel brengen van het geneesmiddel Emtricitabin/ Tenofovir Disoproxil Sandoz. Het verplicht plan voor risicobeperking
De Belgische gezondheidsautoriteiten hebben bepaalde voorwaarden verbonden aan het in de handel brengen van het geneesmiddel Emtricitabin/ Tenofovir Disoproxil Sandoz. Het verplicht plan voor risicobeperking
Inhoud: 1) Informatiefolder voor de patiënt (met bijgevoegde audio-cd) 2) Bijsluiter: informatie voor gebruikers
 De Europese gezondheidsautoriteiten hebben bepaalde voorwaarden verbonden aan het in de handel brengen van het geneesmiddel OZURDEX. Het verplicht plan voor risicobeperking in België, waarvan deze informatie
De Europese gezondheidsautoriteiten hebben bepaalde voorwaarden verbonden aan het in de handel brengen van het geneesmiddel OZURDEX. Het verplicht plan voor risicobeperking in België, waarvan deze informatie
NEBIDO (TESTOSTERONUNDECANOAAT) 1000 mg/4 ml oplossing voor injectie
 De Belgische gezondheidsautoriteiten hebben bepaalde voorwaarden verbonden aan het in de handel brengen van het geneesmiddel Nebido. Het verplicht plan voor risicobeperking in België, waarvan deze informatie
De Belgische gezondheidsautoriteiten hebben bepaalde voorwaarden verbonden aan het in de handel brengen van het geneesmiddel Nebido. Het verplicht plan voor risicobeperking in België, waarvan deze informatie
Selectie en training van volwassen * patiënten voor thuistoediening van Nplate
 De Europese gezondheidsautoriteiten hebben bepaalde voorwaarden verbonden aan het in de handel brengen van het geneesmiddel Nplate. Het verplicht plan voor risicobeperking in België, waarvan deze informatie
De Europese gezondheidsautoriteiten hebben bepaalde voorwaarden verbonden aan het in de handel brengen van het geneesmiddel Nplate. Het verplicht plan voor risicobeperking in België, waarvan deze informatie
Informatiebrochure voor laboratoriumpersoneel
 De Europese gezondheidsautoriteiten hebben bepaalde voorwaarden verbonden aan het in de handel brengen van het geneesmiddel hemlibra. Het verplicht plan voor risicobeperking in België en het Groothertogdom
De Europese gezondheidsautoriteiten hebben bepaalde voorwaarden verbonden aan het in de handel brengen van het geneesmiddel hemlibra. Het verplicht plan voor risicobeperking in België en het Groothertogdom
BIJSLUITER: INFORMATIE VOOR DE GEBRUIKER
 BIJSLUITER: INFORMATIE VOOR DE GEBRUIKER BOCOUTURE 50 eenheden poeder voor oplossing voor injectie BOCOUTURE 100 eenheden poeder voor oplossing voor injectie Botulinum toxine type A (150 kd), vrij van
BIJSLUITER: INFORMATIE VOOR DE GEBRUIKER BOCOUTURE 50 eenheden poeder voor oplossing voor injectie BOCOUTURE 100 eenheden poeder voor oplossing voor injectie Botulinum toxine type A (150 kd), vrij van
INFORMATIEGIDS VOOR PATIENTEN
 De Belgische gezondheidsautoriteiten hebben bepaalde voorwaarden verbonden aan het in de handel brengen van het geneesmiddel FLOLAN. Het verplicht plan voor risicobeperking in België, waarvan deze informatie
De Belgische gezondheidsautoriteiten hebben bepaalde voorwaarden verbonden aan het in de handel brengen van het geneesmiddel FLOLAN. Het verplicht plan voor risicobeperking in België, waarvan deze informatie
Olumiant (baricitinib) filmomhulde tabletten Dit geneesmiddel is onderworpen aan aanvullende monitoring
 De Europese gezondheidsautoriteiten hebben bepaalde voorwaarden verbonden aan het in de handel brengen van het geneesmiddel Olumiant. Het verplicht plan voor risicobeperking in België, waarvan deze informatie
De Europese gezondheidsautoriteiten hebben bepaalde voorwaarden verbonden aan het in de handel brengen van het geneesmiddel Olumiant. Het verplicht plan voor risicobeperking in België, waarvan deze informatie
Directe communicatie aan gezondheidszorgbeoefenaars over de associatie van Sprycel (dasatinib) met Pulmonaire Arteriële Hypertensie (PAH)
 Een Direct Healthcare Professional Communication (DHPC) is een schrijven dat naar de gezondheidszorgbeoefenaars wordt gezonden door de farmaceutische firma s, om hen te informeren over mogelijke risico
Een Direct Healthcare Professional Communication (DHPC) is een schrijven dat naar de gezondheidszorgbeoefenaars wordt gezonden door de farmaceutische firma s, om hen te informeren over mogelijke risico
INFORMATIE VOOR DE PATIENT
 De Europese gezondheidsautoriteiten hebben bepaalde voorwaarden verbonden aan het in de handel brengen van het geneesmiddel Increlex. Het verplicht plan voor risicobeperking in België, waarvan deze informatie
De Europese gezondheidsautoriteiten hebben bepaalde voorwaarden verbonden aan het in de handel brengen van het geneesmiddel Increlex. Het verplicht plan voor risicobeperking in België, waarvan deze informatie
ARIPIPRAZOLE TEVA JOUW HANDLEIDING INFORMATIEBROCHURE VOOR PATIËNTEN / VERZORGERS. (door de arts af te geven aan elke patiënt/verzorger)
 De Belgische gezondheidsautoriteiten hebben bepaalde voorwaarden verbonden aan het in de handel brengen van het geneesmiddel ARIPIPRAZOLE TEVA. Het verplicht plan voor risicobeperking in België, waarvan
De Belgische gezondheidsautoriteiten hebben bepaalde voorwaarden verbonden aan het in de handel brengen van het geneesmiddel ARIPIPRAZOLE TEVA. Het verplicht plan voor risicobeperking in België, waarvan
PATIËNTENHANDLEIDING VOOR ZELFINJECTIE
 De Europese gezondheidsautoriteiten hebben bepaalde voorwaarden verbonden aan het in de handel brengen van het geneesmiddel STRENSIQ. Het verplicht plan voor risicobeperking in België, waarvan deze informatie
De Europese gezondheidsautoriteiten hebben bepaalde voorwaarden verbonden aan het in de handel brengen van het geneesmiddel STRENSIQ. Het verplicht plan voor risicobeperking in België, waarvan deze informatie
INFORMATIEBROCHURE VOOR PATIËNTEN / VERZORGERS
 De Belgische gezondheidsautoriteiten hebben bepaalde voorwaarden verbonden aan het in de handel brengen van het geneesmiddel ARIPIPRAZOLE EG 10 mg 15 mg 30 mg tabletten. Het verplicht plan voor risicobeperking
De Belgische gezondheidsautoriteiten hebben bepaalde voorwaarden verbonden aan het in de handel brengen van het geneesmiddel ARIPIPRAZOLE EG 10 mg 15 mg 30 mg tabletten. Het verplicht plan voor risicobeperking
Bijwerking van bijzonder belang Bloedbaaninfecties geassocieerd met Remodulin intraveneus
 De Belgische gezondheidsautoriteiten hebben enkele voorwaarden gesteld aan het in de handel brengen van het geneesmiddel Remodulin. Het verplichte plan om risico s in België te minimaliseren, waarvan deze
De Belgische gezondheidsautoriteiten hebben enkele voorwaarden gesteld aan het in de handel brengen van het geneesmiddel Remodulin. Het verplichte plan om risico s in België te minimaliseren, waarvan deze
(asfotase alfa) 40 mg/ml 100 mg/ml oplossing voor injectie (asfotase-alfa) INJECTIEHANDLEIDING. Ouders/zorgverleners van jonge patiënten
 De Europese gezondheidsautoriteiten hebben bepaalde voorwaarden verbonden aan het in de handel brengen van het geneesmiddel STRENSIQ. Het verplicht plan voor risicobeperking in België, waarvan deze informatie
De Europese gezondheidsautoriteiten hebben bepaalde voorwaarden verbonden aan het in de handel brengen van het geneesmiddel STRENSIQ. Het verplicht plan voor risicobeperking in België, waarvan deze informatie
Educatief trainingsmateriaal voor artsen (Powerpointpresentatie)
 De Belgische gezondheidsautoriteiten hebben bepaalde voorwaarden verbonden aan het in de handel brengen van het geneesmiddel Bocouture. Het verplicht plan voor risicobeperking in België, waarvan deze informatie
De Belgische gezondheidsautoriteiten hebben bepaalde voorwaarden verbonden aan het in de handel brengen van het geneesmiddel Bocouture. Het verplicht plan voor risicobeperking in België, waarvan deze informatie
Bijsluiter: informatie voor de gebruiker. Neurobion 100 mg 100 mg 1 mg / 3 ml oplossing voor injectie Vitaminen B 1 + B 6 + B 12
 Bijsluiter: informatie voor de gebruiker Neurobion 100 mg 100 mg 1 mg / 3 ml oplossing voor injectie Vitaminen B 1 + B 6 + B 12 Lees goed de hele bijsluiter voordat u dit geneesmiddel gaat gebruiken want
Bijsluiter: informatie voor de gebruiker Neurobion 100 mg 100 mg 1 mg / 3 ml oplossing voor injectie Vitaminen B 1 + B 6 + B 12 Lees goed de hele bijsluiter voordat u dit geneesmiddel gaat gebruiken want
Informatie verstrekt onder het gezag van het Federaal Agentschap voor Geneesmiddelen en Gezondheidsproducten
 Een Direct Healthcare Professional Communication (DHPC) is een schrijven dat naar de gezondheidszorgbeoefenaars wordt gezonden door de farmaceutische firma s, om hen te informeren over mogelijke risico
Een Direct Healthcare Professional Communication (DHPC) is een schrijven dat naar de gezondheidszorgbeoefenaars wordt gezonden door de farmaceutische firma s, om hen te informeren over mogelijke risico
BIJLAGE I SAMENVATTING VAN DE PRODUCTKENMERKEN
 BIJLAGE I SAMENVATTING VAN DE PRODUCTKENMERKEN 1. NAAM VAN HET GENEESMIDDEL Ferrum-Homaccord; Druppels voor oraal gebruik, oplossing 2. KWALITATIEVE EN KWANTITATIEVE SAMENSTELLING 100 g oplossing bevat:
BIJLAGE I SAMENVATTING VAN DE PRODUCTKENMERKEN 1. NAAM VAN HET GENEESMIDDEL Ferrum-Homaccord; Druppels voor oraal gebruik, oplossing 2. KWALITATIEVE EN KWANTITATIEVE SAMENSTELLING 100 g oplossing bevat:
BIJLAGE I SAMENVATTING VAN DE PRODUCTKENMERKEN
 BIJLAGE I SAMENVATTING VAN DE PRODUCTKENMERKEN 1. NAAM VAN HET GENEESMIDDEL Neurexan; Tabletten 2. KWALITATIEVE EN KWANTITATIEVE SAMENSTELLING 1 tablet (301,5 mg) bevat: Avena sativa D2 0,6 mg Coffea cruda
BIJLAGE I SAMENVATTING VAN DE PRODUCTKENMERKEN 1. NAAM VAN HET GENEESMIDDEL Neurexan; Tabletten 2. KWALITATIEVE EN KWANTITATIEVE SAMENSTELLING 1 tablet (301,5 mg) bevat: Avena sativa D2 0,6 mg Coffea cruda
Rechtstreekse mededeling aan de Gezondheidszorgbeoefenaars
 Een Direct Healthcare Professional Communication (DHPC) is een schrijven dat naar de gezondheidszorgbeoefenaars wordt gezonden door de farmaceutische firma s, om hen te informeren over mogelijke risico
Een Direct Healthcare Professional Communication (DHPC) is een schrijven dat naar de gezondheidszorgbeoefenaars wordt gezonden door de farmaceutische firma s, om hen te informeren over mogelijke risico
ABILIFY (aripiprazol)
 De Europese gezondheidsautoriteiten hebben bepaalde voorwaarden verbonden aan het in de handel brengen van het geneesmiddel ABILIFY. Het verplicht plan voor risicobeperking in België, waarvan deze informatie
De Europese gezondheidsautoriteiten hebben bepaalde voorwaarden verbonden aan het in de handel brengen van het geneesmiddel ABILIFY. Het verplicht plan voor risicobeperking in België, waarvan deze informatie
INFORMATIE VOOR DE ARTS
 De Europese gezondheidsautoriteiten hebben bepaalde voorwaarden verbonden aan het in de handel brengen van het geneesmiddel Increlex. Het verplicht plan voor risicobeperking in België, waarvan deze informatie
De Europese gezondheidsautoriteiten hebben bepaalde voorwaarden verbonden aan het in de handel brengen van het geneesmiddel Increlex. Het verplicht plan voor risicobeperking in België, waarvan deze informatie
BIJLAGE I SAMENVATTING VAN DE PRODUCTKENMERKEN
 BIJLAGE I SAMENVATTING VAN DE PRODUCTKENMERKEN 1. NAAM VAN HET GENEESMIDDEL Vertigoheel; Tabletten 2. KWALITATIEVE EN KWANTITATIEVE SAMENSTELLING 1 tablet (301,5 mg) bevat: Cocculus indicus D4 210 mg Conium
BIJLAGE I SAMENVATTING VAN DE PRODUCTKENMERKEN 1. NAAM VAN HET GENEESMIDDEL Vertigoheel; Tabletten 2. KWALITATIEVE EN KWANTITATIEVE SAMENSTELLING 1 tablet (301,5 mg) bevat: Cocculus indicus D4 210 mg Conium
INFORMATIEBROCHURE VOOR PATIËNTEN / VERZORGERS
 De Europese gezondheidsautoriteiten hebben bepaalde voorwaarden verbonden aan het in de handel brengen van het geneesmiddel ABILIFY. Het verplicht plan voor risicobeperking in België, waarvan deze informatie
De Europese gezondheidsautoriteiten hebben bepaalde voorwaarden verbonden aan het in de handel brengen van het geneesmiddel ABILIFY. Het verplicht plan voor risicobeperking in België, waarvan deze informatie
Samenvatting. 26 juni 2015
 Een Direct Healthcare Professional Communication (DHPC) is een schrijven dat naar de gezondheidszorgbeoefenaars wordt gezonden door de farmaceutische firma s, om hen te informeren over mogelijke risico
Een Direct Healthcare Professional Communication (DHPC) is een schrijven dat naar de gezondheidszorgbeoefenaars wordt gezonden door de farmaceutische firma s, om hen te informeren over mogelijke risico
INSTRUCTIES VOOR HET BEREIDEN EN TOEDIENEN VAN DE SOMAVERT INJECTIE
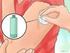 INSTRUCTIES VOOR HET BEREIDEN EN TOEDIENEN VAN DE SOMAVERT INJECTIE Inleiding In de volgende instructies wordt uitgelegd hoe SOMAVERT moet worden bereid en geïnjecteerd. Lees deze instructies aandachtig
INSTRUCTIES VOOR HET BEREIDEN EN TOEDIENEN VAN DE SOMAVERT INJECTIE Inleiding In de volgende instructies wordt uitgelegd hoe SOMAVERT moet worden bereid en geïnjecteerd. Lees deze instructies aandachtig
RECONSTITUTIE, DOSERING EN TOEDIENING
 Belangrijke informatie over de RECONSTITUTIE, DOSERING EN TOEDIENING van bortezomib 3,5 mg injectieflacon voor subcutaan (SC) en intraveneus (IV) gebruik Teva Nederland BV Swensweg 5 Postbus 552 2003 RN
Belangrijke informatie over de RECONSTITUTIE, DOSERING EN TOEDIENING van bortezomib 3,5 mg injectieflacon voor subcutaan (SC) en intraveneus (IV) gebruik Teva Nederland BV Swensweg 5 Postbus 552 2003 RN
BIJSLUITER: INFORMATIE VOOR DE PATIËNT. Yttrium ( 90 Y)-citraat
 BIJSLUITER: INFORMATIE VOOR DE PATIËNT Yttrium( 90 Y)-citraat 37-370 MBq/ml suspensie voor injectie Yttrium ( 90 Y)-citraat Lees goed de hele bijsluiter voordat dit geneesmiddel aan u wordt toegediend
BIJSLUITER: INFORMATIE VOOR DE PATIËNT Yttrium( 90 Y)-citraat 37-370 MBq/ml suspensie voor injectie Yttrium ( 90 Y)-citraat Lees goed de hele bijsluiter voordat dit geneesmiddel aan u wordt toegediend
BIJLAGE I SAMENVATTING VAN DE PRODUCTKENMERKEN
 BIJLAGE I SAMENVATTING VAN DE PRODUCTKENMERKEN 1. NAAM VAN HET GENEESMIDDEL Nux vomica-homaccord; Druppels voor oraal gebruik, oplossing. 2. KWALITATIEVE EN KWANTITATIEVE SAMENSTELLING 100 g oplossing
BIJLAGE I SAMENVATTING VAN DE PRODUCTKENMERKEN 1. NAAM VAN HET GENEESMIDDEL Nux vomica-homaccord; Druppels voor oraal gebruik, oplossing. 2. KWALITATIEVE EN KWANTITATIEVE SAMENSTELLING 100 g oplossing
VISTABEL, 4 Allerganeenheden/0,1 ml, Poeder voor oplossing voor injectie. Botulinumtoxine type A
 VISTABEL Bijsluiter: informatie voor de gebruiker VISTABEL, 4 Allerganeenheden/0,1 ml, Poeder voor oplossing voor injectie Botulinumtoxine type A Lees goed de hele bijsluiter voordat u dit geneesmiddel
VISTABEL Bijsluiter: informatie voor de gebruiker VISTABEL, 4 Allerganeenheden/0,1 ml, Poeder voor oplossing voor injectie Botulinumtoxine type A Lees goed de hele bijsluiter voordat u dit geneesmiddel
2. KWALITATIEVE EN KWANTITATIEVE SAMENSTELLING. Actief bestanddeel: Gezuiverd capsulair Vi polyoside van Salmonella typhi (stam Ty2): 25 microgram
 SAMENVATTING VAN DE PRODUCTKENMERKEN 1. NAAM VAN HET GENEESMIDDEL TYPHIM Vi, 25 microgram/dosis, oplossing voor injectie Polyoside buiktyfusvaccin 2. KWALITATIEVE EN KWANTITATIEVE SAMENSTELLING Eén dosis
SAMENVATTING VAN DE PRODUCTKENMERKEN 1. NAAM VAN HET GENEESMIDDEL TYPHIM Vi, 25 microgram/dosis, oplossing voor injectie Polyoside buiktyfusvaccin 2. KWALITATIEVE EN KWANTITATIEVE SAMENSTELLING Eén dosis
CAPRELSA (vandetanib)
 De Europese gezondheidsautoriteiten hebben bepaalde voorwaarden verbonden aan het in de handel brengen van het geneesmiddel CAPRELSA. Het verplicht plan voor risicobeperking in België, waarvan deze informatie
De Europese gezondheidsautoriteiten hebben bepaalde voorwaarden verbonden aan het in de handel brengen van het geneesmiddel CAPRELSA. Het verplicht plan voor risicobeperking in België, waarvan deze informatie
BIJSLUITER: INFORMATIE VOOR DE GEBRUIKER. SICCAGENT 20 mg/ml oogdruppels, oplossing. Povidone K25
 BIJSLUITER: INFORMATIE VOOR DE GEBRUIKER SICCAGENT 20 mg/ml oogdruppels, oplossing Povidone K25 Lees goed de hele bijsluiter voordat u dit geneesmiddel gaat gebruiken want er staat belangrijke informatie
BIJSLUITER: INFORMATIE VOOR DE GEBRUIKER SICCAGENT 20 mg/ml oogdruppels, oplossing Povidone K25 Lees goed de hele bijsluiter voordat u dit geneesmiddel gaat gebruiken want er staat belangrijke informatie
BIJSLUITER. MELOXIDYL 0,5 mg/ml suspensie voor oraal gebruik voor katten
 BIJSLUITER MELOXIDYL 0,5 mg/ml suspensie voor oraal gebruik voor katten 1. NAAM EN HET ADRES VAN DE HOUDER VAN DE VERGUNNING VOOR HET IN DE HANDEL BRENGEN EN VAN DE FABRIKANT VERANTWOORDELIJK VOOR DE VRIJGIFTE,
BIJSLUITER MELOXIDYL 0,5 mg/ml suspensie voor oraal gebruik voor katten 1. NAAM EN HET ADRES VAN DE HOUDER VAN DE VERGUNNING VOOR HET IN DE HANDEL BRENGEN EN VAN DE FABRIKANT VERANTWOORDELIJK VOOR DE VRIJGIFTE,
1. NAAM VAN HET GENEESMIDDEL
 1. NAAM VAN HET GENEESMIDDEL DURATEARS oogzalf 2. KWALITATIEVE EN KWANTITATIEVE SAMENSTELLING Dit geneesmiddel bevat geen werkzame stoffen. Hulpstof met gekend effect: 1 g oogzalf bevat 30 mg lanoline.
1. NAAM VAN HET GENEESMIDDEL DURATEARS oogzalf 2. KWALITATIEVE EN KWANTITATIEVE SAMENSTELLING Dit geneesmiddel bevat geen werkzame stoffen. Hulpstof met gekend effect: 1 g oogzalf bevat 30 mg lanoline.
