Frank Povel. a1. De twee factoren zijn: 1. er moeten geladen deeltjes zijn; 2. de geladen deeltjes moeten zich kunnen verplaatsen.
|
|
|
- Nora de Smet
- 7 jaren geleden
- Aantal bezoeken:
Transcriptie
1 UITWERKING CCVS-TENTAMEN 26 november 2014 Frank Povel NB. Deze uitwerking is door mij gemaakt en is niet de uitwerking die de CCVS hanteert. Er kunnen dan ook op geen enkele wijze rechten aan deze uitwerking ontleend worden. De CCVS-geeft per opgave het totaal aantal te behalen punten en vermeldt dat op het voorblad van het tentamen. Per deelvraag worden de te behalen punten niet aangegeven. Ik heb dat hier wel gedaan. Per vraag heb ik een aantal punten toegewezen op grond van de op het voorblad gegeven totalen en op grond van wat ik denk dat redelijk is. Ook hieraan kunnen uiteraard geen rechten ontleend worden. OPGAVE 1 supergeleiding a1. De twee factoren zijn: 1. er moeten geladen deeltjes zijn; 2. de geladen deeltjes moeten zich kunnen verplaatsen. ( 1pt) a2. Een zout moet in opgeloste of in gesmolten toestand zijn om de elektrische stroom te begeleiden. In beide toestanden is aan de twee bovengenoemde factoren voldaan. (1 pt) b. Eén van de manieren om de verhoudingsformule te vinden is door de reactievergelijking op te stellen. ½ Y 2 O 3 2 BaCO 3 3 CuO YBa 2 Cu 3 O 6,5 2 CO 2 Vanwege de 2 CO groepen voor de pijl, ontstaan er 2 moleculen CO 2, goed voor 4 zuurstofatomen. Er zijn in totaal 10,5 zuurstofatomen (ionen) voor de pijl. 10,5-4 = 6,5 Een andere manier is om je te realiseren dat de twee CO 2 moleculen ontstaan door een decompositie van het bariumcarbonaat volgens: BaCO3 BaO CO 2 De reactievergelijking vereenvoudigt daarmee tot : ½ Y 2 O 3 2 BaO 3 CuO YBa 2 Cu 3 O 6,5 Dus simpelweg optellen van de O-atomen (ionen). Een derde manier is het optellen van de plusladingen (Y is 3, vanwege Y 2 O 3, Ba is 2 en Cu is 2, vanwege CuO ) en dat delen door 2 voor het aantal O 2- -deeltjes. c. De molverhouding Cu 2 en Cu 3 = 5 : 1 In de formule YBa 2 Cu 3 O 6,75 is de totale min-lading 13,5. De totale plus-lading dus ook. Y is 3 (vanwege Y 2 O 3 ), Ba is 2 dus de 3 Cu ionen moeten samen 6,5 zijn. 1
2 Dit levert twee vergelijkingen met twee onbekenden: stel a Cu 2 en b Cu3 dan is a b = 3 en 2a 3b = 6,5. Hieruit bereken je a =2,5 en b = 0,5. De verhouding wordt daarmee 5 : 1. Er is ook nog een andere manier gebaseerd op de redoxreactie: Cu 2 Cu 3 e - 2x O 2 e - O 2-1x Cu 2 O 2 Cu 3 O 2- Aangezien er in de verhoudingsformule ¼ O bij komt (6,5 wordt 6,75) kan je de bovenstaande vergelijking schrijven als: ½ Cu 2 ¼ O ½ Cu 3 ¼ O 2- Met andere woorden van de 3 Cu 2 - ionen wordt er een halve omgezet in Cu 3. Na afloop zijn er dus 2½ Cu 2 en ½ Cu 3 leidend tot de verhouding 5 : 1. d. Door de behandeling met zoutzuur is alle Cu 3 weer terug omgezet in Cu 2. Per mmol van de verbinding is er dan dus 3 mmol Cu 2 en, blijkens de vergelijking van de reactie met I -, ontstaat hieruit 1,5 mmol I 2. e. 0,362 mmol I 2, dus 0,241 mmol YBa 2 Cu 3 O x en dit heeft een massa van 160 mg. Dus de molmassa van het zout is 663,9 g. Met behulp van de molmassa s van Y, Ba en Cu bereken je dat er 109,7 g voor de O overblijft. x is dus 109,7 : 16 = 6,86. OPGAVE 2 PVC a1. CH 2 = CH 2 Cl 2 CH 2 Cl CH 2 Cl CH 2 Cl CH 2 Cl CH 2 = CHCl HCl a2. CH 2 CHCl CH 2 CHCl CH 2 CHCl b. 2 ( CH 2 CHCl ) n 5n O 2 4n CO 2 2n H 2 O 2n HCl c. polyethyn (1 pt) d. C 6 H 6 : 6 x 12 6 x 1 = 78 u voor A en C 6 D 6 : 6 x 12 6 x 2 = 84 u voor B. (1 pt) e. 2
3 f. Ja, die had je dan ook aangetroffen want er zullen ook twee niet D-houdende ketens met elkaar reageren evenals twee D-houdende ketens. OPGAVE 3 pijnstiller a. ph = 2,18 dus [H 3 O ] = 6, M K z = (6, ) 2 / (0,05 6, ) = 1, b. De K z van benzenol (1, ) en de K z van benzeencarbonzuur (6, ) c. Bij 4-hydroxybenzeencarbonzuur zit de hydroxygroep aan de overkant van de benzeen ring ten opzichte van de carbonzuurgroep en daarmee te ver voor een inwendige waterstofbrug. Dit bevestigt dan inderdaad de verklaring van een inwendige waterstofbrug bij salicylzuur. d. Omdat de hydroxygroep in 4-hydroxybenzeencarbonzuur vrij is om waterstofbruggen aan te gaan met andere moleculen, zal er meer binding zijn tussen de moleculen. Dit leidt tot een hoger smeltpunt. e. OPGAVE 4 nitraat in drinkwater a. - NO 3 4 H 3 e - NO 2 H 2 O 1x Fe 2 Fe 3 e - 3x NO H 3 Fe 2 NO 2 H 2 O 3 Fe 3 b1. Fe 2 NO Fe(NO) 2 b2. De redoxreactie vindt plaats in zuur milieu, dus op zijn minst in de buurt van de zwavelzuurlaag. Het gevormde NO zal daar dan reageren met de aanwezige (overmaat) Fe 2. c. Er is 50/62,01 = 0,8063 mmol NO 3 - aanwezig per liter. Per 100 ml dus 0,08063 mmol. Dit reageert met 8/3 x 0,08063 mmol Al. Dit is 5,80 mg Al. 3
4 d. De ammoniumzouten reageren met het aanwezige OH - en leveren daarmee extra NH 3. Je meet dus teveel NH 3 en berekent daarmee teveel nitraat leidend tot een te hoog nitraatgehalte. OPGAVE 5 paraldehyde a. Het Ag van Ag(NH 3 ) 2 wordt Ag, dus er is elektronenoverdracht, dus het is een redoxreactie. (1 pt) b1. De oplossing bevat de base NH 3. Dus als er propaanzuur ontstaat dan staat het een H af aan NH 3. b2. Ag(NH 3 ) 2 e - Ag 2 NH 3 2x C 2 H 5 CHO H 2 O 3 NH 3 C 2 H 5 COO - 3 NH 4 2e - 1x Ag(NH 3 ) 2 C 2 H 5 CHO H 2 O 3 NH 3 2 Ag 4 NH 3 C 2 H 5 COO - 3 NH 4 Opschonen levert op: 2 Ag(NH 3 ) 2 C 2 H 5 CHO H 2 O 2 Ag NH 3 C 2 H 5 COO - 3 NH 4 c. 4 d. Paraldehyde is een groter molecuul met een grotere massa per molecuul. Daardoor is de vanderwaalsbinding tussen de moleculen sterker hetgeen een hoger kookpunt tot gevolg heeft. e. Er is sprake van cis-trans-isomerie. Aangezien er maar drie methylgroepen zijn, is er maar één trans-isomeer (2 methylgroepen aan dezelfde kant van de ring en één aan de andere kant). En uiteraard is er maar één cis-isomeer (alle drie de methylgroepen aan dezelfde kant van de ring). Hoewel het cis-trans-isomeer twee asymmetrische koolstofatomen heeft, is er geen sprake van optische isomerie omdat alle configuraties een intern spiegelvlak hebben en dus niet optisch actief zijn. Er zijn dus in totaal twee stereoisomeren. Vergelijk het bovenstaande met bv. 1,2,3- trichloorcyclopropaan of 1,3,5-trichloorcyclohexaan. (Buiten beschouwing is gelaten dat er ook sprake is van een verschillende oriëntatie ten opzichte van de zuurstofatomen, zie bv. Wikipedia).
5 f. NB. Deze opgave bevat een onduidelijkheid. Er wordt geschreven In een kolf van 2,5 dm 3 zit 0,1 mol paraldehyde. Wat zit er verder in de kolf? Is dat 2,5 dm 3 water? Dat zou wel kunnen omdat zowel ethanal als paraldehyde voldoende oplosbaar zijn in water bij deze hoeveelheden. Het is niet waarschijnlijk dat het in de gasfase is (wat zou kunnen omdat er wordt gezegd: bij een bepaalde temperatuur ) omdat er verderop gesproken wordt over destillatie van het evenwichtsmengsel. Bovendien zou in de gasfase zwavelzuur niet als katalysator kunnen optreden omdat het een te hoog kookpunt heeft. In het vervolg van dit antwoord ga ik ervan uit dat er bedoeld wordt: een oplossing van 0,1 mol paraldehyde in 2,5 dm 3 water. [paraldehyde] = 0,04 M K= [paraldehyde]/[ethanal] 3 = 6, dus [ethanal] = M dus in 2,5 L oplossing zit 1, mol ethanal. g. Ethanal heeft een lager kookpunt dan paraldhehyde, water en zwavelzuur en verdwijnt daarom als eerste uit het mengsel. Het evenwicht verschuift daardoor richting het ethanal zolang als de destillatie duurt (en het zwavelzuur als katalysator aanwezig blijft, wat het geval zal zijn). Na verloop van tijd is er geen paraldehyde meer over in het mengsel en is er alleen maar ethanal overgedestilleerd. Er is dan ook geen residu van paraldehyde in het water. In het destillaat vormt zich geen paraldehyde om dat daar de katalysator zwavelzuur ontbreekt, dat ook niet overdestilleert en in het water opgelost blijft. EINDE 5
UITWERKING CCVS-TENTAMEN 16 april 2018
 l UITWERKING CCVS-TENTAMEN 16 april 2018 Frank Povel NB. Deze uitwerking is door mij gemaakt en is niet de uitwerking die de CCVS hanteert. Er kunnen dan ook op geen enkele wijze rechten aan deze uitwerking
l UITWERKING CCVS-TENTAMEN 16 april 2018 Frank Povel NB. Deze uitwerking is door mij gemaakt en is niet de uitwerking die de CCVS hanteert. Er kunnen dan ook op geen enkele wijze rechten aan deze uitwerking
UITWERKING CCVS-TENTAMEN 27 november OPGAVE 1 zeven stoffen. Frank Povel
 l UITWERKING CCVS-TENTAMEN 27 november 2018 Frank Povel NB. Deze uitwerking is door mij gemaakt en is niet de uitwerking die de CCVS hanteert. Er kunnen dan ook op geen enkele wijze rechten aan deze uitwerking
l UITWERKING CCVS-TENTAMEN 27 november 2018 Frank Povel NB. Deze uitwerking is door mij gemaakt en is niet de uitwerking die de CCVS hanteert. Er kunnen dan ook op geen enkele wijze rechten aan deze uitwerking
UITWERKING CCVS-TENTAMEN 27 juli 2015
 UITWERKING CCVS-TENTAMEN 27 juli 2015 Frank Povel NB. Deze uitwerking is door mij gemaakt en is niet de uitwerking die de CCVS hanteert. Er kunnen dan ook op geen enkele wijze rechten aan deze uitwerking
UITWERKING CCVS-TENTAMEN 27 juli 2015 Frank Povel NB. Deze uitwerking is door mij gemaakt en is niet de uitwerking die de CCVS hanteert. Er kunnen dan ook op geen enkele wijze rechten aan deze uitwerking
UITWERKING CCVS-TENTAMEN 15 april 2019
 l UITWERKING CCVS-TENTAMEN 15 april 2019 Frank Povel NB. Deze uitwerking is door mij gemaakt en is niet de uitwerking die de CCVS hanteert. Er kunnen dan ook op geen enkele wijze rechten aan deze uitwerking
l UITWERKING CCVS-TENTAMEN 15 april 2019 Frank Povel NB. Deze uitwerking is door mij gemaakt en is niet de uitwerking die de CCVS hanteert. Er kunnen dan ook op geen enkele wijze rechten aan deze uitwerking
UITWERKING CCVS-TENTAMEN 26 mei 2015
 UITWERKING CCVS-TENTAMEN 26 mei 2015 Frank Povel NB. Deze uitwerking is door mij gemaakt en is niet de uitwerking die de CCVS hanteert. Er kunnen dan ook op geen enkele wijze rechten aan deze uitwerking
UITWERKING CCVS-TENTAMEN 26 mei 2015 Frank Povel NB. Deze uitwerking is door mij gemaakt en is niet de uitwerking die de CCVS hanteert. Er kunnen dan ook op geen enkele wijze rechten aan deze uitwerking
UITWERKING CCVS-TENTAMEN 28 november OPGAVE 1 chroomaluin. OPGAVE 2 - deodorant. Frank Povel
 l UITWERKING CCVS-TENTAMEN 28 november 2017 Frank Povel NB. Deze uitwerking is door mij gemaakt en is niet de uitwerking die de CCVS hanteert. Er kunnen dan ook op geen enkele wijze rechten aan deze uitwerking
l UITWERKING CCVS-TENTAMEN 28 november 2017 Frank Povel NB. Deze uitwerking is door mij gemaakt en is niet de uitwerking die de CCVS hanteert. Er kunnen dan ook op geen enkele wijze rechten aan deze uitwerking
UITWERKING CCVS-TENTAMEN 28 november OPGAVE 1 chroomaluin. OPGAVE 2 - deodorant. Frank Povel
 l UITWERKING CCVS-TENTAMEN 28 november 2017 Frank Povel NB. Deze uitwerking is door mij gemaakt en is niet de uitwerking die de CCVS hanteert. Er kunnen dan ook op geen enkele wijze rechten aan deze uitwerking
l UITWERKING CCVS-TENTAMEN 28 november 2017 Frank Povel NB. Deze uitwerking is door mij gemaakt en is niet de uitwerking die de CCVS hanteert. Er kunnen dan ook op geen enkele wijze rechten aan deze uitwerking
UITWERKING CCVS-TENTAMEN 16 mei 2014 Frank Povel
 UITWERKING CCVSTENTAMEN 16 mei 2014 Frank Povel NB. Deze uitwerking is door mij gemaakt en is niet de uitwerking die de CCVS hanteert. Er kunnen dan ook op geen enkele wijze rechten aan deze uitwerking
UITWERKING CCVSTENTAMEN 16 mei 2014 Frank Povel NB. Deze uitwerking is door mij gemaakt en is niet de uitwerking die de CCVS hanteert. Er kunnen dan ook op geen enkele wijze rechten aan deze uitwerking
NATIONALE SCHEIKUNDEOLYMPIADE
 NATIONALE SCHEIKUNDEOLYMPIADE CORRECTIEMODEL VOORRONDE 1 af te nemen in de periode van woensdag 5 januari 01 tot en met woensdag 1 februari 01 Deze voorronde bestaat uit 4 meerkeuzevragen verdeeld over
NATIONALE SCHEIKUNDEOLYMPIADE CORRECTIEMODEL VOORRONDE 1 af te nemen in de periode van woensdag 5 januari 01 tot en met woensdag 1 februari 01 Deze voorronde bestaat uit 4 meerkeuzevragen verdeeld over
UITWERKING CCVS-TENTAMEN 24 november 2015
 Uitwerking CCVStentamen 24 november 2015 door Frank Povel UITWERKING CCVSTENTAMEN 24 november 2015 Frank Povel NB. Deze uitwerking is door mij gemaakt en is niet de uitwerking die de CCVS hanteert. Er
Uitwerking CCVStentamen 24 november 2015 door Frank Povel UITWERKING CCVSTENTAMEN 24 november 2015 Frank Povel NB. Deze uitwerking is door mij gemaakt en is niet de uitwerking die de CCVS hanteert. Er
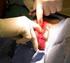
Frank Povel. a. Fe + 2H + Fe 2+ + H 2 Er zullen gasbelletjes te zien zijn en de oplossing zal licht groen worden.
 UITWERKING CCVS-TENTAMEN 29 november 2016 Frank Povel NB. Deze uitwerking is door mij gemaakt en is niet de uitwerking die de CCVS hanteert. Er kunnen dan ook op geen enkele wijze rechten aan deze uitwerking
UITWERKING CCVS-TENTAMEN 29 november 2016 Frank Povel NB. Deze uitwerking is door mij gemaakt en is niet de uitwerking die de CCVS hanteert. Er kunnen dan ook op geen enkele wijze rechten aan deze uitwerking
UITWERKING CCVS-TENTAMEN 21 juli 2017
 UITWERKING CCVS-TENTAMEN 21 juli 2017 Frank Povel NB. Deze uitwerking is door mij gemaakt en is niet de uitwerking die de CCVS hanteert. Er kunnen dan ook op geen enkele wijze rechten aan deze uitwerking
UITWERKING CCVS-TENTAMEN 21 juli 2017 Frank Povel NB. Deze uitwerking is door mij gemaakt en is niet de uitwerking die de CCVS hanteert. Er kunnen dan ook op geen enkele wijze rechten aan deze uitwerking
UITWERKING CCVS-TENTAMEN 18 april 2017
 UITWERKING CCVSTENTAMEN 18 april 2017 Frank Povel NB. Deze uitwerking is door mij gemaakt en is niet de uitwerking die de CCVS hanteert. Er kunnen dan ook op geen enkele wijze rechten aan deze uitwerking
UITWERKING CCVSTENTAMEN 18 april 2017 Frank Povel NB. Deze uitwerking is door mij gemaakt en is niet de uitwerking die de CCVS hanteert. Er kunnen dan ook op geen enkele wijze rechten aan deze uitwerking
SCHEIKUNDEOLYMPIADE 2018
 SCHEIKUNDEOLYMPIADE 018 CORRECTIEMODEL VOORRONDE 1 af te nemen in de periode van 15 tot en met 7 januari 018 Deze voorronde bestaat uit 0 meerkeuzevragen verdeeld over 8 onderwerpen en opgaven met in totaal
SCHEIKUNDEOLYMPIADE 018 CORRECTIEMODEL VOORRONDE 1 af te nemen in de periode van 15 tot en met 7 januari 018 Deze voorronde bestaat uit 0 meerkeuzevragen verdeeld over 8 onderwerpen en opgaven met in totaal
CCVS-tentamen 16 mei 2014 - Uitwerking
 CCVStentamen 16 mei 2014 Uitwerking door Frank Povel NB. De puntentoekenning is door mij gedaan op grond van de totalen per opgave zoals weergegeven op bij het tentamen behorende voorblad. OPGAVE 1 koper
CCVStentamen 16 mei 2014 Uitwerking door Frank Povel NB. De puntentoekenning is door mij gedaan op grond van de totalen per opgave zoals weergegeven op bij het tentamen behorende voorblad. OPGAVE 1 koper
OEFENOPGAVEN VWO EVENWICHTEN
 OPGAVE 1 OEFENOPGAVEN VWO EVENWICHTEN In een ruimte van 5,00 liter brengt men 9,50 mol HCl(g) en 2,60 mol O 2 (g). Na evenwichtsinstelling is 40,0% van de beginstoffen omgezet en is er Cl 2 (g) en H 2
OPGAVE 1 OEFENOPGAVEN VWO EVENWICHTEN In een ruimte van 5,00 liter brengt men 9,50 mol HCl(g) en 2,60 mol O 2 (g). Na evenwichtsinstelling is 40,0% van de beginstoffen omgezet en is er Cl 2 (g) en H 2
OEFENOPGAVEN MOLBEREKENINGEN
 OEFENOPGAVEN MOLBEREKENINGEN * = voor VWO Salmiak, NH 4 Cl(s), kan gemaakt worden door waterstofchloride, HCl(g), te laten reageren met ammoniak, NH 3 (g) 01 Wat is de chemische naam voor salmiak? 02 Geef
OEFENOPGAVEN MOLBEREKENINGEN * = voor VWO Salmiak, NH 4 Cl(s), kan gemaakt worden door waterstofchloride, HCl(g), te laten reageren met ammoniak, NH 3 (g) 01 Wat is de chemische naam voor salmiak? 02 Geef
Fosfor kan met waterstof reageren. d Geef de vergelijking van de reactie van fosfor met waterstof.
 1 Een oplossing van zwavelzuur en een oplossing van bariumhydroxide geladen beide elektriciteit. Wordt bij de zwavelzuuroplossing een oplossing van bariumhydroxide gedruppeld, dan neemt het elektrisch
1 Een oplossing van zwavelzuur en een oplossing van bariumhydroxide geladen beide elektriciteit. Wordt bij de zwavelzuuroplossing een oplossing van bariumhydroxide gedruppeld, dan neemt het elektrisch
Eindexamen scheikunde 1 vwo 2001-I
 Eindexamen scheikunde vwo -I 4 Antwoordmodel Parkeerkaartje Het juiste antwoord is: S O 8 - + I - SO4 - + I S O 8 - voor de pijl en SO4 - na de pijl I - voor de pijl en I na de pijl Indien de volgende
Eindexamen scheikunde vwo -I 4 Antwoordmodel Parkeerkaartje Het juiste antwoord is: S O 8 - + I - SO4 - + I S O 8 - voor de pijl en SO4 - na de pijl I - voor de pijl en I na de pijl Indien de volgende
Opgave 1. n = m / M. e 500 mg soda (Na 2CO 3) = 0,00472 mol. Opgave 2. m = n x M
 Hoofdstuk 8 Rekenen met de mol bladzijde 1 Opgave 1 n = m / M a 64,0 g zuurstofgas (O 2) = 2,00 mol (want n = 64,0 / 32,0) enz b 10,0 g butaan (C 4H 10) = 0,172 mol c 1,00 g suiker (C 12H 22O 11) = 0,00292
Hoofdstuk 8 Rekenen met de mol bladzijde 1 Opgave 1 n = m / M a 64,0 g zuurstofgas (O 2) = 2,00 mol (want n = 64,0 / 32,0) enz b 10,0 g butaan (C 4H 10) = 0,172 mol c 1,00 g suiker (C 12H 22O 11) = 0,00292
SCHEIKUNDE VWO 4 MOLBEREKENINGEN ANTW.
 OPGAVE 1 LEVEL 1 Uit de opgave haal je dat koper en zuurstof links van de pijl moeten staan en koper(ii)oxide rechts van de pijl. Daarna maak je de reactievergelijking kloppend. 2 Cu + O 2 à 2 CuO Filmpje
OPGAVE 1 LEVEL 1 Uit de opgave haal je dat koper en zuurstof links van de pijl moeten staan en koper(ii)oxide rechts van de pijl. Daarna maak je de reactievergelijking kloppend. 2 Cu + O 2 à 2 CuO Filmpje
NATIONALE SCHEIKUNDEOLYMPIADE
 NATINALE SHEIKUNDELYMPIADE RRETIEMDEL VRRNDE 1 (de week van) woensdag 4 februari 2009 Deze voorronde bestaat uit 24 meerkeuzevragen verdeeld over 5 onderwerpen en 3 open vragen met in totaal 13 deelvragen
NATINALE SHEIKUNDELYMPIADE RRETIEMDEL VRRNDE 1 (de week van) woensdag 4 februari 2009 Deze voorronde bestaat uit 24 meerkeuzevragen verdeeld over 5 onderwerpen en 3 open vragen met in totaal 13 deelvragen
SCHEIKUNDEOLYMPIADE 2017
 SCHEIKUNDEOLYMPIADE 2017 CORRECTIEMODEL VOORRONDE 1 af te nemen in de periode van 18 tot en met 25 januari 2017 Deze voorronde bestaat uit 20 meerkeuzevragen verdeeld over 8 onderwerpen en 2 opgaven met
SCHEIKUNDEOLYMPIADE 2017 CORRECTIEMODEL VOORRONDE 1 af te nemen in de periode van 18 tot en met 25 januari 2017 Deze voorronde bestaat uit 20 meerkeuzevragen verdeeld over 8 onderwerpen en 2 opgaven met
ßCalciumChloride oplossing
 Samenvatting door R. 1673 woorden 17 februari 2013 8 1 keer beoordeeld Vak Methode Scheikunde Pulsar chemie Additiereactie Bij een reactie tussen hexeen en broom springt de C=C binding open. Aan het molecuul
Samenvatting door R. 1673 woorden 17 februari 2013 8 1 keer beoordeeld Vak Methode Scheikunde Pulsar chemie Additiereactie Bij een reactie tussen hexeen en broom springt de C=C binding open. Aan het molecuul
Reacties en stroom 1
 Reacties en stroom 1 Elektronenoverdracht (1) Een bekende reactie is: 2 Na(s) + Cl 2 (g) 2 NaCl(s) (oude notatie: Na + Cl - ) Hierbij is sprake van elektronenoverdracht. Dit kan als volgt worden voorgesteld:
Reacties en stroom 1 Elektronenoverdracht (1) Een bekende reactie is: 2 Na(s) + Cl 2 (g) 2 NaCl(s) (oude notatie: Na + Cl - ) Hierbij is sprake van elektronenoverdracht. Dit kan als volgt worden voorgesteld:
vrijdag 15 juni 2012 15:26:05 Midden-Europese zomertijd H6 Zuren en basen 4havo voorjaar 2012
 H6 Zuren en basen 4havo voorjaar 2012 Toetsing in periode 4! 6 juni! DTM-T zuur/base t/m 6.6! Tabel 6.10,6.13,6.17 en ph-berekeningen (zoals in vragen 14,15,26 en 27)! Toetsweek einde periode! TW441 H1
H6 Zuren en basen 4havo voorjaar 2012 Toetsing in periode 4! 6 juni! DTM-T zuur/base t/m 6.6! Tabel 6.10,6.13,6.17 en ph-berekeningen (zoals in vragen 14,15,26 en 27)! Toetsweek einde periode! TW441 H1
CENTRALE COMMISSIE VOORTENTAMEN SCHEIKUNDE TENTAMEN SCHEIKUNDE. datum : donderdag 29 juli 2010
 CENTRALE COMMISSIE VOORTENTAMEN SCHEIKUNDE TENTAMEN SCHEIKUNDE datum : donderdag 29 juli 2010 tijd : 14.00 tot 17.00 uur aantal opgaven : 6 Iedere opgave dient op een afzonderlijk vel te worden gemaakt
CENTRALE COMMISSIE VOORTENTAMEN SCHEIKUNDE TENTAMEN SCHEIKUNDE datum : donderdag 29 juli 2010 tijd : 14.00 tot 17.00 uur aantal opgaven : 6 Iedere opgave dient op een afzonderlijk vel te worden gemaakt
Eindexamen scheikunde 1-2 vwo 2007-I
 Beoordelingsmodel Epoxypropaan 1 maximumscore 3 methoxyetheen stamnaam etheen 1 voorvoegsel methoxy 2 Indien een naam is gegeven waarin als enige fout een onjuist voorvoegsel voorkomt, maar uit de naam
Beoordelingsmodel Epoxypropaan 1 maximumscore 3 methoxyetheen stamnaam etheen 1 voorvoegsel methoxy 2 Indien een naam is gegeven waarin als enige fout een onjuist voorvoegsel voorkomt, maar uit de naam
Stabilisator voor PVC
 Stabilisator voor PVC 1 maximumscore 2 Voorbeelden van een juist antwoord zijn: Als chlooretheen polymeriseert ontstaan lange ketens zonder dwarsverbindingen. De ketens kunnen langs elkaar bewegen (bij
Stabilisator voor PVC 1 maximumscore 2 Voorbeelden van een juist antwoord zijn: Als chlooretheen polymeriseert ontstaan lange ketens zonder dwarsverbindingen. De ketens kunnen langs elkaar bewegen (bij
Stoffen, structuur en bindingen
 Hoofdstuk 1: Stoffen, structuur en bindingen Scheikunde vwo 2011/2012 www.lyceo.nl Onderwerpen Scheikunde 2011 2012 Stoffen, structuur en binding Kenmerken van Reacties Zuren en base Redox Chemische technieken
Hoofdstuk 1: Stoffen, structuur en bindingen Scheikunde vwo 2011/2012 www.lyceo.nl Onderwerpen Scheikunde 2011 2012 Stoffen, structuur en binding Kenmerken van Reacties Zuren en base Redox Chemische technieken
Eindexamen scheikunde havo I
 pgave (mono)stikstofmono-oxide Indien als antwoord stikstofoxide is gegeven 2 Een juiste verklaring leidt tot de uitkomst 7 (elektronen). elk atoom bevat 8 elektronen in totaal bevat het 2 - ion dus 2
pgave (mono)stikstofmono-oxide Indien als antwoord stikstofoxide is gegeven 2 Een juiste verklaring leidt tot de uitkomst 7 (elektronen). elk atoom bevat 8 elektronen in totaal bevat het 2 - ion dus 2
NATIONALE SCHEIKUNDEOLYMPIADE
 NATIONALE SCHEIKUNDEOLYMPIADE CORRECTIEMODEL VOORRONDE 1 af te nemen in de periode van woensdag 30 januari 2013 tot en met woensdag 6 februari 2013 Deze voorronde bestaat uit 22 meerkeuzevragen verdeeld
NATIONALE SCHEIKUNDEOLYMPIADE CORRECTIEMODEL VOORRONDE 1 af te nemen in de periode van woensdag 30 januari 2013 tot en met woensdag 6 februari 2013 Deze voorronde bestaat uit 22 meerkeuzevragen verdeeld
Curie Hoofdstuk 6 HAVO 4
 Rekenen aan reacties Curie Hoofdstuk 6 HAVO 4 6.1 Rekenen met de mol 6.2 Rekenen met massa s 6.3 Concentratie 6.4 SPA en Stappenplan 6.1 Rekenen met de mol Eenheden en grootheden 1d dozijn potloden 12
Rekenen aan reacties Curie Hoofdstuk 6 HAVO 4 6.1 Rekenen met de mol 6.2 Rekenen met massa s 6.3 Concentratie 6.4 SPA en Stappenplan 6.1 Rekenen met de mol Eenheden en grootheden 1d dozijn potloden 12
Eindexamen scheikunde havo 2008-I
 Beoordelingsmodel Uraan 1 maximumscore 2 aantal protonen: 92 aantal neutronen: 146 aantal protonen: 92 1 aantal neutronen: 238 verminderen met het aantal protonen 1 2 maximumscore 2 UO 2 + 4 HF UF 4 +
Beoordelingsmodel Uraan 1 maximumscore 2 aantal protonen: 92 aantal neutronen: 146 aantal protonen: 92 1 aantal neutronen: 238 verminderen met het aantal protonen 1 2 maximumscore 2 UO 2 + 4 HF UF 4 +
PbSO 4(s) d NH 4Cl + KOH KCl + H 2O + NH 3(g) NH 4. + OH - NH 3(g) + H 2O e 2 NaOH + CuCl 2 Cu(OH) 2(s) + 2 NaCl
 Hoofdstuk 11 Chemische reacties bladzijde 1 Opgave 1 De ionen die in water ontstaan: a NaCl Na Cl - b AgNO 3 Ag - NO 3 c (NH 4) 2SO 4 2 NH 4 SO 4 d KOH K OH - e NiSO 4 Ni 2 SO 4 Opgave 2 Schrijf de volgende
Hoofdstuk 11 Chemische reacties bladzijde 1 Opgave 1 De ionen die in water ontstaan: a NaCl Na Cl - b AgNO 3 Ag - NO 3 c (NH 4) 2SO 4 2 NH 4 SO 4 d KOH K OH - e NiSO 4 Ni 2 SO 4 Opgave 2 Schrijf de volgende
NATIONALE SCHEIKUNDEOLYMPIADE 2016
 NATIONALE SCHEIKUNDEOLYMPIADE 016 CORRECTIEMODEL VOORRONDE 1 af te nemen in de periode van 0 tot en met 7 januari 016 Deze voorronde bestaat uit 0 meerkeuzevragen verdeeld over 8 onderwerpen en opgaven
NATIONALE SCHEIKUNDEOLYMPIADE 016 CORRECTIEMODEL VOORRONDE 1 af te nemen in de periode van 0 tot en met 7 januari 016 Deze voorronde bestaat uit 0 meerkeuzevragen verdeeld over 8 onderwerpen en opgaven
EXAMEN MIDDELBAAR ALGEMEEN VOORTGEZET ONDERWIJS IN Dit examen bestaat voor iedere kandidaat uit 5 OPGAVEN
 MAVO-4 II EXAMEN MIDDELBAAR ALGEMEEN VOORTGEZET ONDERWIJS IN 1974 MAVO-4 Dinsdag 11 juni, 9.00 11.00 NATUUR-EN SCHEIKUNDE II (Scheikunde) OPEN VRAGEN Dit examen bestaat voor iedere kandidaat uit 5 OPGAVEN
MAVO-4 II EXAMEN MIDDELBAAR ALGEMEEN VOORTGEZET ONDERWIJS IN 1974 MAVO-4 Dinsdag 11 juni, 9.00 11.00 NATUUR-EN SCHEIKUNDE II (Scheikunde) OPEN VRAGEN Dit examen bestaat voor iedere kandidaat uit 5 OPGAVEN
Vraag Antwoord Scores
 Ademtest 1 maximumscore 2 Voorbeelden van een juist antwoord zijn: Een ureummolecuul bevat NH 2 groepen / N-H bindingen, zodat er waterstbruggen (met watermoleculen) gevormd kunnen worden. (Dus ureum is
Ademtest 1 maximumscore 2 Voorbeelden van een juist antwoord zijn: Een ureummolecuul bevat NH 2 groepen / N-H bindingen, zodat er waterstbruggen (met watermoleculen) gevormd kunnen worden. (Dus ureum is
Weet je het nog? Welke bewerking moet in afbeelding 21.1 langs elke pijl staan?
 Hoofdstuk 21 Chemisch rekenen (4) bladzijde 1 Opgave 1 Weet je het nog? Welke bewerking moet in afbeelding 21.1 langs elke pijl staan? Opgave 2 We lossen op: 25,0 g NaCl in een maatkolf tot 100 ml. De
Hoofdstuk 21 Chemisch rekenen (4) bladzijde 1 Opgave 1 Weet je het nog? Welke bewerking moet in afbeelding 21.1 langs elke pijl staan? Opgave 2 We lossen op: 25,0 g NaCl in een maatkolf tot 100 ml. De
BUFFEROPLOSSINGEN. Inleiding
 BUFFEROPLOSSINGEN Inleiding Zowel in de analytische chemie als in de biochemie is het van belang de ph van een oplossing te regelen. Denk bijvoorbeeld aan een complexometrische titratie met behulp van
BUFFEROPLOSSINGEN Inleiding Zowel in de analytische chemie als in de biochemie is het van belang de ph van een oplossing te regelen. Denk bijvoorbeeld aan een complexometrische titratie met behulp van
ZUREN EN BASEN. Samenvatting voor het HAVO. versie mei 2013
 ZUREN EN BASEN Samenvatting voor het HAVO versie mei 2013 INHOUDSOPGAVE 1. Vooraf 2. Algemeen 3. Zuren 4. Basen 5. Het waterevenwicht 6. Definities ph en poh 7. ph BEREKENINGEN 7.1. Algemeen 7.2. Water
ZUREN EN BASEN Samenvatting voor het HAVO versie mei 2013 INHOUDSOPGAVE 1. Vooraf 2. Algemeen 3. Zuren 4. Basen 5. Het waterevenwicht 6. Definities ph en poh 7. ph BEREKENINGEN 7.1. Algemeen 7.2. Water
Zelfs zuiver water geleidt in zeer kleine mate elektrische stroom en dus wijst dit op de aanwezigheid van geladen deeltjes.
 Cursus Chemie 4-1 Hoofdstuk 4: CHEMISCH EVENWICHT 1. DE STERKTE VAN ZUREN EN BASEN Als HCl in water opgelost wordt dan bekomen we een oplossing die bijna geen enkele covalente HCl meer bevat. In de reactievergelijking
Cursus Chemie 4-1 Hoofdstuk 4: CHEMISCH EVENWICHT 1. DE STERKTE VAN ZUREN EN BASEN Als HCl in water opgelost wordt dan bekomen we een oplossing die bijna geen enkele covalente HCl meer bevat. In de reactievergelijking
Je kunt de ph van een oplossing meten met een ph-meter, met universeelindicatorpapier of met behulp van zuur-base-indicatoren.
 Boekverslag door Merel 797 woorden 22 januari 2017 6.9 14 keer beoordeeld Vak Methode Scheikunde Chemie overal Zie de bijlage voor de grafiek en alle tabellen. H8 Zuren en en Basen Chemie Overal 8.2 De
Boekverslag door Merel 797 woorden 22 januari 2017 6.9 14 keer beoordeeld Vak Methode Scheikunde Chemie overal Zie de bijlage voor de grafiek en alle tabellen. H8 Zuren en en Basen Chemie Overal 8.2 De
Dit examen bestaat voor iedere kandidaat uit 20 vragen
 MAVO-4 II EXAMEN MIDDELBAAR ALGEMEEN VOORTGEZET ONDERWIJS IN 1983 MAVO-4 Woensdag 15 juni, 9.00 11.00 NATUUR-EN SCHEIKUNDE II (Scheikunde) MEERKEUZETOETS Dit examen bestaat voor iedere kandidaat uit 20
MAVO-4 II EXAMEN MIDDELBAAR ALGEMEEN VOORTGEZET ONDERWIJS IN 1983 MAVO-4 Woensdag 15 juni, 9.00 11.00 NATUUR-EN SCHEIKUNDE II (Scheikunde) MEERKEUZETOETS Dit examen bestaat voor iedere kandidaat uit 20
Voorbereiding toelatingsexamen arts/tandarts
 Voorbereiding toelatingsexamen arts/tandarts Oplossingen van 2018 Arts Geel 29 september 2018 Brenda Casteleyn, PhD Vraag 1 Welke waarden moeten worden toegekend aan x en y in de onderstaande reactievergelijking
Voorbereiding toelatingsexamen arts/tandarts Oplossingen van 2018 Arts Geel 29 september 2018 Brenda Casteleyn, PhD Vraag 1 Welke waarden moeten worden toegekend aan x en y in de onderstaande reactievergelijking
Opgaven zuurgraad (ph) berekenen. ph = -log [H + ] poh = -log [OH - ] [H + ] = 10 -ph [OH - ] = 10 -poh. ph = 14 poh poh = 14 ph ph + poh = 14
![Opgaven zuurgraad (ph) berekenen. ph = -log [H + ] poh = -log [OH - ] [H + ] = 10 -ph [OH - ] = 10 -poh. ph = 14 poh poh = 14 ph ph + poh = 14 Opgaven zuurgraad (ph) berekenen. ph = -log [H + ] poh = -log [OH - ] [H + ] = 10 -ph [OH - ] = 10 -poh. ph = 14 poh poh = 14 ph ph + poh = 14](/thumbs/82/85039734.jpg) Opgaven zuurgraad (ph) berekenen Met behulp van deze formules dien je berekeningen te kunnen uitvoeren. Deze hoef je niet uit je hoofd te leren, maar je moet ze wel kunnen toepassen. Bij een toets zullen
Opgaven zuurgraad (ph) berekenen Met behulp van deze formules dien je berekeningen te kunnen uitvoeren. Deze hoef je niet uit je hoofd te leren, maar je moet ze wel kunnen toepassen. Bij een toets zullen
CENTRALE COMMISSIE VOORTENTAMEN SCHEIKUNDE TENTAMEN SCHEIKUNDE. datum : woensdag 26 januari 2011
 CENTRALE COMMISSIE VOORTENTAMEN SCHEIKUNDE TENTAMEN SCHEIKUNDE datum : woensdag 26 januari 2011 tijd : 19.00 tot 22.00 uur aantal opgaven : 6 Iedere opgave dient op een afzonderlijk vel te worden gemaakt
CENTRALE COMMISSIE VOORTENTAMEN SCHEIKUNDE TENTAMEN SCHEIKUNDE datum : woensdag 26 januari 2011 tijd : 19.00 tot 22.00 uur aantal opgaven : 6 Iedere opgave dient op een afzonderlijk vel te worden gemaakt
Eindexamen scheikunde vwo II
 Beoordelingsmodel aarverzorging maximumscore 3 Een juist antwoord kan er als volgt uitzien: N 2 2 2 N N 2 2 S de peptidebindingen juist getekend de zijketens juist getekend het begin van de structuurformule
Beoordelingsmodel aarverzorging maximumscore 3 Een juist antwoord kan er als volgt uitzien: N 2 2 2 N N 2 2 S de peptidebindingen juist getekend de zijketens juist getekend het begin van de structuurformule
38 e Nationale Scheikundeolympiade
 8 e Nationale Scheikundeolympiade Rijksuniversiteit Groningen THEORIETOETS correctievoorschrift dinsdag juni 207 Deze theorietoets bestaat uit 6 opgaven met in totaal 4 deelvragen. Gebruik voor elke opgave
8 e Nationale Scheikundeolympiade Rijksuniversiteit Groningen THEORIETOETS correctievoorschrift dinsdag juni 207 Deze theorietoets bestaat uit 6 opgaven met in totaal 4 deelvragen. Gebruik voor elke opgave
Eindexamen scheikunde havo 2007-II
 Beoordelingsmodel Kwik 1 maximumscore 2 aantal protonen: 160 aantal elektronen: 158 aantal protonen: 160 1 aantal elektronen: het gegeven aantal protonen verminderd met 2 1 2 maximumscore 2 g 2 Cl 2 Indien
Beoordelingsmodel Kwik 1 maximumscore 2 aantal protonen: 160 aantal elektronen: 158 aantal protonen: 160 1 aantal elektronen: het gegeven aantal protonen verminderd met 2 1 2 maximumscore 2 g 2 Cl 2 Indien
Een reactie blijkt bij verdubbeling van alle concentraties 8 maal zo snel te verlopen. Van welke orde zou deze reactie zijn?
 Hoofdstuk 19 Reactiesnelheid en evenwicht bladzijde 1 Opgave 1 Voor de volgende reactie: 4 NH 3(g) + 5 O 2(g) 4 NO(g) + 6 H 2O(g) blijkt onder bepaalde omstandigheden: S = 2,5 mol/l s. Hoe groot zijn:
Hoofdstuk 19 Reactiesnelheid en evenwicht bladzijde 1 Opgave 1 Voor de volgende reactie: 4 NH 3(g) + 5 O 2(g) 4 NO(g) + 6 H 2O(g) blijkt onder bepaalde omstandigheden: S = 2,5 mol/l s. Hoe groot zijn:
Module 2 Chemische berekeningen Antwoorden
 2 Meten is weten 1 Nee, want bijvoorbeeld 0,0010 kg is net zo nauwkeurig als 1,0 gram. 2 De minst betrouwbare meting is de volumemeting. Deze variabele bepaald het aantal significante cijfers. 3 IJs: 1,5
2 Meten is weten 1 Nee, want bijvoorbeeld 0,0010 kg is net zo nauwkeurig als 1,0 gram. 2 De minst betrouwbare meting is de volumemeting. Deze variabele bepaald het aantal significante cijfers. 3 IJs: 1,5
Eindexamen scheikunde havo 2008-II
 Beoordelingsmodel Forams 1 maximumscore 2 aantal protonen: 14 aantal neutronen: 16 aantal protonen: 14 1 aantal neutronen: 30 verminderd met het aantal protonen 1 Indien het juiste aantal protonen (7)
Beoordelingsmodel Forams 1 maximumscore 2 aantal protonen: 14 aantal neutronen: 16 aantal protonen: 14 1 aantal neutronen: 30 verminderd met het aantal protonen 1 Indien het juiste aantal protonen (7)
Bindingen. Suiker Suiker heeft de molecuulformule C 12 H 22 O 11
 Bindingen Suiker Suiker heeft de molecuulformule C 12 H 22 O 11 1. Leg uit dat suiker een moleculaire stof is 2. Van suiker is de oplosbaarheid in water zeer hoog. Leg uit waarom suiker zo goed in water
Bindingen Suiker Suiker heeft de molecuulformule C 12 H 22 O 11 1. Leg uit dat suiker een moleculaire stof is 2. Van suiker is de oplosbaarheid in water zeer hoog. Leg uit waarom suiker zo goed in water
Oefenopgaven REDOX vwo
 Oefenopgaven REDOX vwo OPGAVE 1 Geef de halfreactie waarbij 01 P 2 O 5 wordt omgezet in PH 3. 02 Jodaat, IO 3 - in neutraal milieu wordt omgezet in H 5 IO 6. 03 Methanol in zuur milieu wordt omgezet in
Oefenopgaven REDOX vwo OPGAVE 1 Geef de halfreactie waarbij 01 P 2 O 5 wordt omgezet in PH 3. 02 Jodaat, IO 3 - in neutraal milieu wordt omgezet in H 5 IO 6. 03 Methanol in zuur milieu wordt omgezet in
4. Van twee stoffen is hieronder de structuurformule weergegeven.
 MAVO Herexamen 1976 1. Beantwoord de volgende vragen over het element calcium. a. Hoeveel protonen bevat een atoom van dit element? Licht het antwoord toe. b. Hoe zijn de elektronen over de schillen verdeeld?
MAVO Herexamen 1976 1. Beantwoord de volgende vragen over het element calcium. a. Hoeveel protonen bevat een atoom van dit element? Licht het antwoord toe. b. Hoe zijn de elektronen over de schillen verdeeld?
Eindexamen scheikunde 1 vwo I
 Beoordelingsmodel PKU 1 maximumscore 3 Een juist antwoord kan er als volgt uitzien: CH 3 S H 2 N CH 2 CH 2 C H O C N H OH CH 2 C H O C N H HO CH 3 CH C H O C peptidebindingen juist getekend 1 het begin
Beoordelingsmodel PKU 1 maximumscore 3 Een juist antwoord kan er als volgt uitzien: CH 3 S H 2 N CH 2 CH 2 C H O C N H OH CH 2 C H O C N H HO CH 3 CH C H O C peptidebindingen juist getekend 1 het begin
NATIONALE SCHEIKUNDEOLYMPIADE
 NATIONALE SCHEIKUNDEOLYMPIADE CORRECTIEMODEL VOORRONDE af te nemen in de periode van januari tot en met 5 februari 04 Deze voorronde bestaat uit 0 meerkeuzevragen verdeeld over 8 onderwerpen en open opgaven
NATIONALE SCHEIKUNDEOLYMPIADE CORRECTIEMODEL VOORRONDE af te nemen in de periode van januari tot en met 5 februari 04 Deze voorronde bestaat uit 0 meerkeuzevragen verdeeld over 8 onderwerpen en open opgaven
Oefenopgaven ZUREN en BASEN havo
 Oefenopgaven ZUREN en BASEN havo OPGAVE 1 Men lost de volgende zouten op in water: (i) ammoniumnitraat (ii) kaliumsulfide (iii) natriumwaterstofsulfaat 01 Geef voor elk van deze zouten de oplosvergelijking.
Oefenopgaven ZUREN en BASEN havo OPGAVE 1 Men lost de volgende zouten op in water: (i) ammoniumnitraat (ii) kaliumsulfide (iii) natriumwaterstofsulfaat 01 Geef voor elk van deze zouten de oplosvergelijking.
UITWERKING TOELICHTING OP DE ANTWOORDEN VAN HET EXAMEN 2001-I VAK: SCHEIKUNDE 1,2 EXAMEN: 2001-I
 UITWERKING TOELICHTING OP DE ANTWOORDEN VAN HET EXAMEN 2001-I VAK: SCHEIKUNDE 1,2 NIVEAU: VWO EXAMEN: 2001-I De uitgever heeft ernaar gestreefd de auteursrechten te regelen volgens de wettelijke bepalingen.
UITWERKING TOELICHTING OP DE ANTWOORDEN VAN HET EXAMEN 2001-I VAK: SCHEIKUNDE 1,2 NIVEAU: VWO EXAMEN: 2001-I De uitgever heeft ernaar gestreefd de auteursrechten te regelen volgens de wettelijke bepalingen.
1. Elementaire chemie en chemisch rekenen
 In onderstaande zelftest zijn de vragen gebundeld die als voorbeeldvragen zijn opgenomen in het bijhorend overzicht van de verwachte voorkennis chemie. 1. Elementaire chemie en chemisch rekenen 1.1 Grootheden
In onderstaande zelftest zijn de vragen gebundeld die als voorbeeldvragen zijn opgenomen in het bijhorend overzicht van de verwachte voorkennis chemie. 1. Elementaire chemie en chemisch rekenen 1.1 Grootheden
SCHEIKUNDEOLYMPIADE 2019
 SCHEIKUNDEOLYMPIADE 019 CORRECTIEMODEL VOORRONDE 1 af te nemen in de periode van 1 tot en met 5 januari 019 Deze voorronde bestaat uit 0 meerkeuzevragen verdeeld over 8 onderwerpen en 3 opgaven met in
SCHEIKUNDEOLYMPIADE 019 CORRECTIEMODEL VOORRONDE 1 af te nemen in de periode van 1 tot en met 5 januari 019 Deze voorronde bestaat uit 0 meerkeuzevragen verdeeld over 8 onderwerpen en 3 opgaven met in
Eindexamen scheikunde 1-2 vwo 2004-II
 4 Beoordelingsmodel Ky-auto 1 Een juiste uitleg leidt tot de conclusie dat de elektrode waaraan zuurstof reageert de positieve elektrode is. zuurstof is de oxidator / neemt elektronen op / zuurstofmoleculen
4 Beoordelingsmodel Ky-auto 1 Een juiste uitleg leidt tot de conclusie dat de elektrode waaraan zuurstof reageert de positieve elektrode is. zuurstof is de oxidator / neemt elektronen op / zuurstofmoleculen
Oefenopgaven REDOXREACTIES vwo Reactievergelijkingen en halfreacties
 Oefenopgaven REDOXREACTIES vwo Reactievergelijkingen en halfreacties OPGAVE 1 Geef de halfreactie waarbij 01 P 2 O 5 wordt omgezet in PH 3. 02 Jodaat, IO 3 - in neutraal milieu wordt omgezet in H 5 IO
Oefenopgaven REDOXREACTIES vwo Reactievergelijkingen en halfreacties OPGAVE 1 Geef de halfreactie waarbij 01 P 2 O 5 wordt omgezet in PH 3. 02 Jodaat, IO 3 - in neutraal milieu wordt omgezet in H 5 IO
3. Welke van onderstaande formules geeft een zout aan? A. Al 2O 3 B. P 2O 3 C. C 2H 6 D. NH 3
 Toelatingsexamens en Ondersteunend Onderwijs VOORBLAD EXAMENOPGAVEN Toetsdatum: n.v.t. Vak: Scheikunde voorbeeldexamen 2015 Tijdsduur: 2 uur en 30 minuten De volgende hulpmiddelen zijn toegestaan bij het
Toelatingsexamens en Ondersteunend Onderwijs VOORBLAD EXAMENOPGAVEN Toetsdatum: n.v.t. Vak: Scheikunde voorbeeldexamen 2015 Tijdsduur: 2 uur en 30 minuten De volgende hulpmiddelen zijn toegestaan bij het
_ Correctievoorschrift VWO
 _ Correctievoorschrift VWO Cl) "C r:::: ::::J ~ Cl).r:::: (.) Cl) Voorbereidend Wetenschappelijk Onderwijs. 9 Tijdvak 9 Inhoud Algemene regels 2 Scoringsvoorschrift 2. Scoringsregels 2.2 Antwoordmodel
_ Correctievoorschrift VWO Cl) "C r:::: ::::J ~ Cl).r:::: (.) Cl) Voorbereidend Wetenschappelijk Onderwijs. 9 Tijdvak 9 Inhoud Algemene regels 2 Scoringsvoorschrift 2. Scoringsregels 2.2 Antwoordmodel
Eindexamen scheikunde havo II
 Opgave aantal protonen : 48 aantal elektronen : 46 aantal protonen: 48 aantal elektronen: aantal protonen minus 2 2 selenide ion : Se 2- cadmium(ii)selenide : dse selenide-ion: Se 2- formule cadmiumselenide
Opgave aantal protonen : 48 aantal elektronen : 46 aantal protonen: 48 aantal elektronen: aantal protonen minus 2 2 selenide ion : Se 2- cadmium(ii)selenide : dse selenide-ion: Se 2- formule cadmiumselenide
ZUREN EN BASEN. Samenvatting voor het VWO. versie mei 2013
 ZUREN EN BASEN Samenvatting voor het VWO versie mei 2013 INHOUDSOPGAVE 1. Vooraf 2. Algemeen 3. Zuren 4. Basen 5. Het waterevenwicht 6. Definities ph en poh 7. ph BEREKENINGEN 7.1. Algemeen 7.2. Water
ZUREN EN BASEN Samenvatting voor het VWO versie mei 2013 INHOUDSOPGAVE 1. Vooraf 2. Algemeen 3. Zuren 4. Basen 5. Het waterevenwicht 6. Definities ph en poh 7. ph BEREKENINGEN 7.1. Algemeen 7.2. Water
1. Elementaire chemie en chemisch rekenen
 In onderstaande zelftest zijn de vragen gebundeld die als voorbeeldvragen zijn opgenomen in het bijhorend overzicht van de verwachte voorkennis chemie. 1. Elementaire chemie en chemisch rekenen 1.1 Grootheden
In onderstaande zelftest zijn de vragen gebundeld die als voorbeeldvragen zijn opgenomen in het bijhorend overzicht van de verwachte voorkennis chemie. 1. Elementaire chemie en chemisch rekenen 1.1 Grootheden
Eindexamen scheikunde havo 2006-I
 4 Beoordelingsmodel Rood licht Maximumscore 1 1 edelgassen 2 Voorbeelden van een juist antwoord zijn: De (negatieve) elektronen bewegen zich richting elektrode A dus is elektrode A de positieve elektrode.
4 Beoordelingsmodel Rood licht Maximumscore 1 1 edelgassen 2 Voorbeelden van een juist antwoord zijn: De (negatieve) elektronen bewegen zich richting elektrode A dus is elektrode A de positieve elektrode.
Eindexamen scheikunde havo 2001-I
 Eindexamen scheikunde havo -I 4 Antwoordmodel Nieuw element (in de tekst staat:) deze atomen zijn eerst ontdaan van een aantal elektronen dus de nikkeldeeltjes zijn positief geladen Indien in een overigens
Eindexamen scheikunde havo -I 4 Antwoordmodel Nieuw element (in de tekst staat:) deze atomen zijn eerst ontdaan van een aantal elektronen dus de nikkeldeeltjes zijn positief geladen Indien in een overigens
Eindexamen scheikunde vwo 2010 - II
 Beoordelingsmodel Alcoholintolerantie 1 maximumscore 2 Voorbeelden van een juist antwoord zijn: et is de omzetting van een (primaire) alcohol tot een alkanal; daarbij reageert de (primaire) alcohol met
Beoordelingsmodel Alcoholintolerantie 1 maximumscore 2 Voorbeelden van een juist antwoord zijn: et is de omzetting van een (primaire) alcohol tot een alkanal; daarbij reageert de (primaire) alcohol met
Vraag Antwoord Scores. na de pijl 1. + HCl NH 4. O NH OH gevolgd door H + + OH H 2
 Ademtest 1 maximumscore 2 NH 3 + H + NH 4 + H + voor de pijl 1 NH 3 voor de pijl en NH + 4 na de pijl 1 Indien als antwoord is gegeven NH 3 + HCl NH 4 Cl 1 Wanneer een antwoord is gegeven als: NH 3 + H
Ademtest 1 maximumscore 2 NH 3 + H + NH 4 + H + voor de pijl 1 NH 3 voor de pijl en NH + 4 na de pijl 1 Indien als antwoord is gegeven NH 3 + HCl NH 4 Cl 1 Wanneer een antwoord is gegeven als: NH 3 + H
5.4 ph van oplossingen van zwakke zuren of zwakke basen
 Opmerking: We gaan ervan uit, dat bij het mengen van oplossingen geen volumecontractie optreedt. Bij verdunde oplossingen is die veronderstelling gerechtvaardigd. 5.4 ph van oplossingen van zwakke zuren
Opmerking: We gaan ervan uit, dat bij het mengen van oplossingen geen volumecontractie optreedt. Bij verdunde oplossingen is die veronderstelling gerechtvaardigd. 5.4 ph van oplossingen van zwakke zuren
NATIONALE SCHEIKUNDEOLYMPIADE 2016
 NATIONALE SCHEIKUNDEOLYMPIADE 2016 CORRECTIEMODEL VOORRONDE 2 af te nemen in de periode van 23 tot en met 30 maart 2016 Deze voorronde bestaat uit 20 meerkeuzevragen verdeeld over 9 onderwerpen en 3 opgaven
NATIONALE SCHEIKUNDEOLYMPIADE 2016 CORRECTIEMODEL VOORRONDE 2 af te nemen in de periode van 23 tot en met 30 maart 2016 Deze voorronde bestaat uit 20 meerkeuzevragen verdeeld over 9 onderwerpen en 3 opgaven
Augustus geel Chemie Vraag 1
 Chemie Vraag 1 Men beschikt over een oplossing van ijzer(ii)nitraat met c = 3,00 mol/l en heeft voor een experiment 0,600 mol nitraationen nodig. Hoeveel ml van de oplossing dient men te gebruiken?
Chemie Vraag 1 Men beschikt over een oplossing van ijzer(ii)nitraat met c = 3,00 mol/l en heeft voor een experiment 0,600 mol nitraationen nodig. Hoeveel ml van de oplossing dient men te gebruiken?
_ Examen VWO. .c e ~.- (1)'
 _ Examen VWO (I) "C C ".:::::1 ~.- (1)'.c e Cl) Voorbereidend Wetenschappelijk Onderwijs 19 89 Tijdvak 1 Maandag 22 mei 9.00-12.00 uur Als bij een vraag een verklaring, uitleg of berekening gevraagd wordt,
_ Examen VWO (I) "C C ".:::::1 ~.- (1)'.c e Cl) Voorbereidend Wetenschappelijk Onderwijs 19 89 Tijdvak 1 Maandag 22 mei 9.00-12.00 uur Als bij een vraag een verklaring, uitleg of berekening gevraagd wordt,
OEFENOPGAVEN VWO6sk1 TENTAMEN H1-11
 OEFENOPGAVEN VWO6sk1 TENTAMEN H1-11 06-07, HU, oktober 2006 1. POLARITEIT, WATERSTOFBRUGGEN Zie het apart uitgedeelde stencil voor extra theorie (is tentamenstof!) en een oefenopgave. 2. CHEMISCH REKENEN
OEFENOPGAVEN VWO6sk1 TENTAMEN H1-11 06-07, HU, oktober 2006 1. POLARITEIT, WATERSTOFBRUGGEN Zie het apart uitgedeelde stencil voor extra theorie (is tentamenstof!) en een oefenopgave. 2. CHEMISCH REKENEN
Eindexamen scheikunde 1-2 vwo 2007-II
 Beoordelingsmodel EcoEthanol TM 1 maximumscore 2 Voorbeelden van juiste argumenten zijn: Er komt minder broeikasgas / de toename van het CO 2 gehalte in de atmosfeer wordt minder / het gaat de opwarming
Beoordelingsmodel EcoEthanol TM 1 maximumscore 2 Voorbeelden van juiste argumenten zijn: Er komt minder broeikasgas / de toename van het CO 2 gehalte in de atmosfeer wordt minder / het gaat de opwarming
Samenvatting Scheikunde Hoofdstuk 1 en 2
 Samenvatting Scheikunde Hoofdstuk 1 en 2 Samenvatting door een scholier 918 woorden 13 januari 2005 6,3 193 keer beoordeeld Vak Methode Scheikunde Chemie overal Hoofdstuk 1 1.2: De bouw van een atoom.
Samenvatting Scheikunde Hoofdstuk 1 en 2 Samenvatting door een scholier 918 woorden 13 januari 2005 6,3 193 keer beoordeeld Vak Methode Scheikunde Chemie overal Hoofdstuk 1 1.2: De bouw van een atoom.
NATIONALE SCHEIKUNDEOLYMPIADE
 NATIONALE SCHEIKUNDEOLYMPIADE CORRECTIEMODEL VOORRONDE af te nemen in de week van woensdag 10 april 013 Deze voorronde bestaat uit 0 meerkeuzevragen verdeeld over 6 onderwerpen en 3 open opgaven met in
NATIONALE SCHEIKUNDEOLYMPIADE CORRECTIEMODEL VOORRONDE af te nemen in de week van woensdag 10 april 013 Deze voorronde bestaat uit 0 meerkeuzevragen verdeeld over 6 onderwerpen en 3 open opgaven met in
NATIONALE SCHEIKUNDEOLYMPIADE
 NATIONALE SCHEIKUNDEOLYMPIADE CORRECTIEMODEL VOORRONDE 1 (de week van) woensdag 3 februari 2010 Deze voorronde bestaat uit 24 meerkeuzevragen verdeeld over 6 onderwerpen en 3 open vragen met in totaal
NATIONALE SCHEIKUNDEOLYMPIADE CORRECTIEMODEL VOORRONDE 1 (de week van) woensdag 3 februari 2010 Deze voorronde bestaat uit 24 meerkeuzevragen verdeeld over 6 onderwerpen en 3 open vragen met in totaal
Eindexamen scheikunde 1-2 vwo 2001-I
 Eindexamen scheikunde - vwo -I 4 Antwoordmodel Parkeerkaartje Het juiste antwoord is: S 8 - + I - S4 - + I S 8 - voor de pijl en S4 - na de pijl I - voor de pijl en I na de pijl juiste coëfficiënten Indien
Eindexamen scheikunde - vwo -I 4 Antwoordmodel Parkeerkaartje Het juiste antwoord is: S 8 - + I - S4 - + I S 8 - voor de pijl en S4 - na de pijl I - voor de pijl en I na de pijl juiste coëfficiënten Indien
NATIONALE SCHEIKUNDEOLYMPIADE
 NATIONALE SCHEIKUNDEOLYMPIADE CORRECTIEMODEL VOORRONDE af te nemen in de week van woensdag 8 maart 01 Deze voorronde bestaat uit 0 meerkeuzevragen verdeeld over 6 onderwerpen en open opgaven met in totaal
NATIONALE SCHEIKUNDEOLYMPIADE CORRECTIEMODEL VOORRONDE af te nemen in de week van woensdag 8 maart 01 Deze voorronde bestaat uit 0 meerkeuzevragen verdeeld over 6 onderwerpen en open opgaven met in totaal
SCHEIKUNDEOLYMPIADE 2017
 SCHEIKUNDEOLYMPIADE 2017 CORRECTIEMODEL VOORRONDE 2 af te nemen in de periode van 20 tot en met 24 maart 2017 Deze voorronde bestaat uit 20 meerkeuzevragen verdeeld over 7 onderwerpen en 3 opgaven met
SCHEIKUNDEOLYMPIADE 2017 CORRECTIEMODEL VOORRONDE 2 af te nemen in de periode van 20 tot en met 24 maart 2017 Deze voorronde bestaat uit 20 meerkeuzevragen verdeeld over 7 onderwerpen en 3 opgaven met
Oefenvraagstukken 5 VWO Hoofdstuk 11. Opgave 1 [HCO ] [H O ] x x. = 4,5 10 [CO ] 1,00 x 10
![Oefenvraagstukken 5 VWO Hoofdstuk 11. Opgave 1 [HCO ] [H O ] x x. = 4,5 10 [CO ] 1,00 x 10 Oefenvraagstukken 5 VWO Hoofdstuk 11. Opgave 1 [HCO ] [H O ] x x. = 4,5 10 [CO ] 1,00 x 10](/thumbs/19/200750.jpg) Oefenvraagstukken 5 VWO Hoofdstuk 11 Zuren en basen Opgave 1 1 Ga na of de volgende zuren en basen met elkaar kunnen reageren. Zo ja, geef de reactievergelijking. Zo nee, leg duidelijk uit waarom niet.
Oefenvraagstukken 5 VWO Hoofdstuk 11 Zuren en basen Opgave 1 1 Ga na of de volgende zuren en basen met elkaar kunnen reageren. Zo ja, geef de reactievergelijking. Zo nee, leg duidelijk uit waarom niet.
OEFENOPGAVEN VWO ZUREN EN BASEN + ph-berekeningen
 OEFENOPGAVEN VWO ZUREN EN BASEN + ph-berekeningen OPGAVE 1 01 Bereken hoeveel mmol HCOOH is opgelost in 40 ml HCOOH oplossing met ph = 3,60. 02 Bereken ph van 0,300 M NaF oplossing. 03 Bereken hoeveel
OEFENOPGAVEN VWO ZUREN EN BASEN + ph-berekeningen OPGAVE 1 01 Bereken hoeveel mmol HCOOH is opgelost in 40 ml HCOOH oplossing met ph = 3,60. 02 Bereken ph van 0,300 M NaF oplossing. 03 Bereken hoeveel
5 Water, het begrip ph
 5 Water, het begrip ph 5.1 Water Waterstofchloride is een sterk zuur, het reageert als volgt met water: HCI(g) + H 2 0(I) Cl (aq) + H 3 O + (aq) z b Hierbij reageert water als base. Ammoniak is een zwakke
5 Water, het begrip ph 5.1 Water Waterstofchloride is een sterk zuur, het reageert als volgt met water: HCI(g) + H 2 0(I) Cl (aq) + H 3 O + (aq) z b Hierbij reageert water als base. Ammoniak is een zwakke
Eindexamen scheikunde 1-2 vwo 2005-I
 4 Beoordelingsmodel Polymelkzuur 1 Het juiste antwoord kan bijvoorbeeld zijn genoteerd als: CH H H C H H C CH Indien slechts één juiste ruimtelijke structuurformule van melkzuur is getekend 0 Indien de
4 Beoordelingsmodel Polymelkzuur 1 Het juiste antwoord kan bijvoorbeeld zijn genoteerd als: CH H H C H H C CH Indien slechts één juiste ruimtelijke structuurformule van melkzuur is getekend 0 Indien de
ZUUR-BASE BUFFERS Samenvatting voor het VWO
 ZUUR-BASE BUFFERS Samenvatting voor het VWO versie december 2014 INHOUDSOPGAVE 1. Vooraf 2. Wat is een buffer? 3. Hoe werkt een buffer? 4. Geconjugeerd zuur/base-paar 5. De ph van een buffer De volgende
ZUUR-BASE BUFFERS Samenvatting voor het VWO versie december 2014 INHOUDSOPGAVE 1. Vooraf 2. Wat is een buffer? 3. Hoe werkt een buffer? 4. Geconjugeerd zuur/base-paar 5. De ph van een buffer De volgende
Uitwerkingen van de opgaven uit: CHEMISCHE ANALYSE ISBN , 1 e druk, Uitgeverij Syntax Media Hoofdstuk 3 Acidimetrie bladzijde 1
 Hoofdstuk 3 Acidimetrie bladzijde 1 Opgave 1 a We titreren HCl met NaOH. Welke van de boven gegeven indicatoren kunnen we gebruiken? Elke genoemde indicator, de phverandering gaat ongeveer van ph = 3 tot
Hoofdstuk 3 Acidimetrie bladzijde 1 Opgave 1 a We titreren HCl met NaOH. Welke van de boven gegeven indicatoren kunnen we gebruiken? Elke genoemde indicator, de phverandering gaat ongeveer van ph = 3 tot
EXAMEN MIDDELBAAR ALGEMEEN VOORTGEZET ONDERWIJS IN Dit examen bestaat voor iedere kandidaat uit 5 OPGAVEN
 MAVO-4 I EXAMEN MIDDELBAAR ALGEMEEN VOORTGEZET ONDERWIJS IN 1974 MAVO-4 Woensdag 8 mei, 9.00 11.00 NATUUR-EN SCHEIKUNDE II (Scheikunde) OPEN VRAGEN Dit examen bestaat voor iedere kandidaat uit 5 OPGAVEN
MAVO-4 I EXAMEN MIDDELBAAR ALGEMEEN VOORTGEZET ONDERWIJS IN 1974 MAVO-4 Woensdag 8 mei, 9.00 11.00 NATUUR-EN SCHEIKUNDE II (Scheikunde) OPEN VRAGEN Dit examen bestaat voor iedere kandidaat uit 5 OPGAVEN
Opgave 1. Opgave 2. b En bij een verbruik van 10 ml? Dan wordt de procentuele onnauwkeurigheid 2 x zo groot: 0,03 / 20 x 100% = 0,3% Opgave 3
 Hoofdstuk 13 Titratieberekeningen bladzijde 1 Opgave 1 Wat is het theoretisch eindpunt? Het theoretisch eindpunt is het titratievolume waarbij de bedoelde reactie precies is afgelopen. En wat is dan het
Hoofdstuk 13 Titratieberekeningen bladzijde 1 Opgave 1 Wat is het theoretisch eindpunt? Het theoretisch eindpunt is het titratievolume waarbij de bedoelde reactie precies is afgelopen. En wat is dan het
Natuurlijk heb je nu nog géén massa s berekend. Maar dat kan altijd later nog. En dan kun je mooi kiezen, van welke stoffen je de massa wil berekenen.
 Hoofdstuk 17: Rekenen in molverhoudingen 17.1 Rekenen aan reacties: een terugblik én een alternatief In hoofdstuk 11 hebben we gerekend aan reacties. Het achterliggende idee was vaak, dat je bij een reactie
Hoofdstuk 17: Rekenen in molverhoudingen 17.1 Rekenen aan reacties: een terugblik én een alternatief In hoofdstuk 11 hebben we gerekend aan reacties. Het achterliggende idee was vaak, dat je bij een reactie
Toets02 Algemene en Anorganische Chemie. 30 oktober 2015 13:00-15:30 uur Holiday Inn Hotel, Leiden
 Toets02 Algemene en Anorganische Chemie 30 oktober 2015 13:00-15:30 uur Holiday Inn Hotel, Leiden Naam: Studentnummer Universiteit Leiden: Dit is de enige originele versie van jouw tentamen. Het bevat
Toets02 Algemene en Anorganische Chemie 30 oktober 2015 13:00-15:30 uur Holiday Inn Hotel, Leiden Naam: Studentnummer Universiteit Leiden: Dit is de enige originele versie van jouw tentamen. Het bevat
UITWERKING TOELICHTING OP DE ANTWOORDEN VAN HET EXAMEN 2001-I EXAMEN: 2001-I
 UITWERKING TOELICHTING OP DE ANTWOORDEN VAN HET EXAMEN 2001-I VAK: NIVEAU: SCHEIKUNDE HAVO EXAMEN: 2001-I De uitgever heeft ernaar gestreefd de auteursrechten te regelen volgens de wettelijke bepalingen.
UITWERKING TOELICHTING OP DE ANTWOORDEN VAN HET EXAMEN 2001-I VAK: NIVEAU: SCHEIKUNDE HAVO EXAMEN: 2001-I De uitgever heeft ernaar gestreefd de auteursrechten te regelen volgens de wettelijke bepalingen.
S S. Errata Nova scheikunde uitwerkingen leerjaar 4 havo 140,71. Met dank aan Mariëlle Marsman, Mill-Hill College, Goirle. Hoofdstuk 1 Atoombouw
 Errata Nova scheikunde uitwerkingen leerjaar 4 havo Met dank aan Mariëlle Marsman, Mill-Hill College, Goirle Hoofdstuk 1 Atoombouw Theorie 19 b 78,99 23,98504 10,00 24,98584 11,01 25,98259 24, 31 100 20
Errata Nova scheikunde uitwerkingen leerjaar 4 havo Met dank aan Mariëlle Marsman, Mill-Hill College, Goirle Hoofdstuk 1 Atoombouw Theorie 19 b 78,99 23,98504 10,00 24,98584 11,01 25,98259 24, 31 100 20
Hoofdstuk 12 Zuren en basen
 Hoofdstuk 12 Zuren en basen bladzijde 1 Opgave 1 Reactie van de volgende zuren met water: HNO 3 HNO 3 H 2O H 3O NO 3 C 2H 5NH 3 C 2H 5NH 3 H 2O H 3O C 2H 5NH 2 HCN HCN H 2O H 3O CN HClO 4 HClO 4 H 2O H
Hoofdstuk 12 Zuren en basen bladzijde 1 Opgave 1 Reactie van de volgende zuren met water: HNO 3 HNO 3 H 2O H 3O NO 3 C 2H 5NH 3 C 2H 5NH 3 H 2O H 3O C 2H 5NH 2 HCN HCN H 2O H 3O CN HClO 4 HClO 4 H 2O H
Voorronde Opgave 1. Opgave 2. Opgave punten. 8 punten. 9 punten. Opgaven. woensdag 6 februari
 Voorronde 1991 Opgaven woensdag 6 februari Opgave 1 15 punten 1 2 3 4 Men titreert 25,0 ml ammonia met 0,100 M zoutzuur. Met behulp van een ph-meter vindt men het bijgaand diagram. Geef de reactievergelijking
Voorronde 1991 Opgaven woensdag 6 februari Opgave 1 15 punten 1 2 3 4 Men titreert 25,0 ml ammonia met 0,100 M zoutzuur. Met behulp van een ph-meter vindt men het bijgaand diagram. Geef de reactievergelijking
ANTWOORDEN Herhaling zuren, basen en buffers
 ANTWOORDEN Herhaling zuren, basen en buffers 1) Wat geeft de onderstaande afbeelding weer? Je ziet deze deeltjes afgebeeld: het zwakke zuur HA (want veel deeltjes zijn niet geïoniseerd), de zwakke base
ANTWOORDEN Herhaling zuren, basen en buffers 1) Wat geeft de onderstaande afbeelding weer? Je ziet deze deeltjes afgebeeld: het zwakke zuur HA (want veel deeltjes zijn niet geïoniseerd), de zwakke base
